宫颈癌组织lncRNA FOXD2-AS1、miR-506-5p表达变化及其临床意义
李敏,赵妍丽,杜国波
川北医学院附属医院,四川南充637000
宫颈癌是女性第四大常见恶性肿瘤,全球每年新发病例约52.8万例,死亡达26.6万例[1]。随着宫颈癌筛查手段和技术不断提高,部分患者能够得以早期诊断和治疗,但在中低收入国家宫颈癌的发病率和病死率仍然较高[2]。目前,宫颈癌发病的分子机制尚不明确。因此,深入探索与宫颈癌发病相关的分子,寻找潜在的诊断标志物和治疗靶点具有重要意义。近年研究发现,细胞内无蛋白编码功能的非编码RNA分子有可能通过调控基因的表达,进而参与人类多种疾病的发生、发展,有望成为疾病的诊断标志物和治疗靶点[3]。长链非编码RNA(lncRNA)FOXD2-AS1基因定位于人染色体1p33,是一种与恶性肿瘤相关的lncRNA。lncRNA FOXD2-AS1通过与其他非编码RNA分子结合,从而对基因的表达进行精细调控,继而参与细胞的生长、发育、分化及物质代谢等过程[4]。近年有研究报道,lncRNA FOXD2-AS1在喉癌、食管癌组织中均存在异常表达现象;lncRNA FOXD2-AS1可能通过影响β-钙黏素、Akt、E2F转录因子1等下游癌基因表达,促进肿瘤细胞恶性增殖和迁移[5-6]。miR-506-5p编码基因定位于人染色体Xq27.3,其能与下游基因信使RNA的3′非翻译区结合,通过改变信使RNA的稳定性而调控基因的表达,继而影响细胞增殖、凋亡等生物学过程[7]。LI等[8]研究发现,miR-506-5p具有抑癌基因作用,其在乳腺癌、肺癌组织中低表达,通过上调细胞增殖相关基因的表达,如细胞周期素激酶4、Ras,导致肿瘤恶性进展。但目前lncRNA FOXD2-AS1、miR-506-5p表达与宫颈癌的关系尚不清楚。2015年4月—2016年4月,本研究分析了宫颈癌组织lncRNA FOXD2-AS1、miR-506-5p表达变化并探讨其临床意义。现报告如下。
1 资料与方法
1.1 临床资料 以同期川北医学院附属医院诊治的91例宫颈癌患者为研究对象。纳入标准:①经组织病理学检查明确诊断为宫颈癌;②接受根治性子宫切除术或改良根治性子宫切除术;③入院前未行放化疗、免疫或生物治疗。排除标准:①合并其他宫颈疾病者;②既往有其他器官或系统肿瘤史者;③伴心、肺、肾等脏器功能衰竭者。患者年龄30~72(45.2±7.1)岁,其中≥45岁42例、<45岁49例;病理类型:腺癌13例,鳞癌78例;FIGO分期[9]:Ⅰ、Ⅱ期50例,Ⅲ期41例;组织分化程度:低分化31例,高中分化60例;浸润深度:深肌层52例,浅肌层39例;淋巴结转移:有53例,无38例。本研究符合《赫尔辛基宣言》,经川北医学院附属医院伦理委员会审核,患者或其家属知情同意并签属知情同意书。
1.2 lncRNA FOXD2-AS1、miR-506-5p表达检测 取宫颈癌组织与癌旁组织(距肿瘤组织边缘>2 cm且经组织病理检查明确为正常宫颈组织),-80 ℃冰箱保存。待组织成批后,分别取50 mg,TRIzol法提取总RNA,经NanoDrop 2000超微量分光光度计鉴定,提取的总RNA浓度、纯度和完整性符合后续实验要求。然后将总RNA反转录为cDNA,-20 ℃保存。反转录条件:37 ℃ 1 h,85 ℃ 5 s。以cDNA为模板进行PCR扩增。引物序列由北京睿博科技有限公司设计合成。lncRNA FOXD2-AS1上游引物5′-AATGGACAGAAGCTATCCAGGC-3′、下游引物5′-AGTTGAAGGTGCACACACTG-3′,miR-506-5p上游引物5′-CCTTGGCACCCTTCTGTAGA-3′、下游引物5′-TGATGGGTTGTAGAGGCATCC-3′,内参U6上游引物5′-GCGAGATCGCACTCATCATCT-3′、下游引物3′-TCAGTGGTGGACCTGACC-5′。lncRNA FOXD2-AS1 PCR扩增体系20 μL:SYBR Green preMix 10 μL,上下游引物各0.5 μL,cDNA模板1 μL,ddH2O 8 μL;反应条件:95 ℃ 5 min,95 ℃ 30 s、60 ℃ 20 s、70 ℃ 20 s共40个循环。miR-506-5p PCR扩增体系20 μL:SYBR Green preMix 10 μL,上下游引物各1 μL,cDNA模板1 μL,ddH2O 7 μL;反应条件93 ℃ 15 min,93 ℃ 30 s、58 ℃ 20 s、72 ℃ 40 s共40个循环。收集各样本阈值循环数(CT)值。以U6为内参,以2-ΔΔCT计算目的基因相对表达量。
1.3 随访 以获得病理诊断结果作为随访起点,随访方式采取门诊复查形式,每3个月随访1次,随访截至2019年4月。以随访期间患者死亡或至随访截至时间为随访终点,统计患者生存情况。

2 结果
2.1 宫颈癌组织与癌旁正常组织lncRNA FOXD2-AS1、miR-506-5p表达比较 宫颈癌组织与癌旁正常组织lncRNA FOXD2-AS1相对表达量分别为1.117±0.305、0.924±0.297,miR-506-5p相对表达量分别为1.213±0.311、1.742±0.321。与癌旁正常组织相比,宫颈癌组织lncRNA FOXD2-AS1表达升高,miR-506-5p表达降低(t分别为4.325、11.291,P均<0.01)。
2.2 宫颈癌组织lncRNA FOXD2-AS1表达与miR-506-5p表达的关系 相关分析显示,宫颈癌组织lncRNA FOXD2-AS1表达与miR-506-5p表达呈显著负相关关系(r=-0.621,P<0.01)。
2.3 宫颈癌组织lncRNA FOXD2-AS1、miR-506-5p表达与患者临床病理特征的关系 见表1。
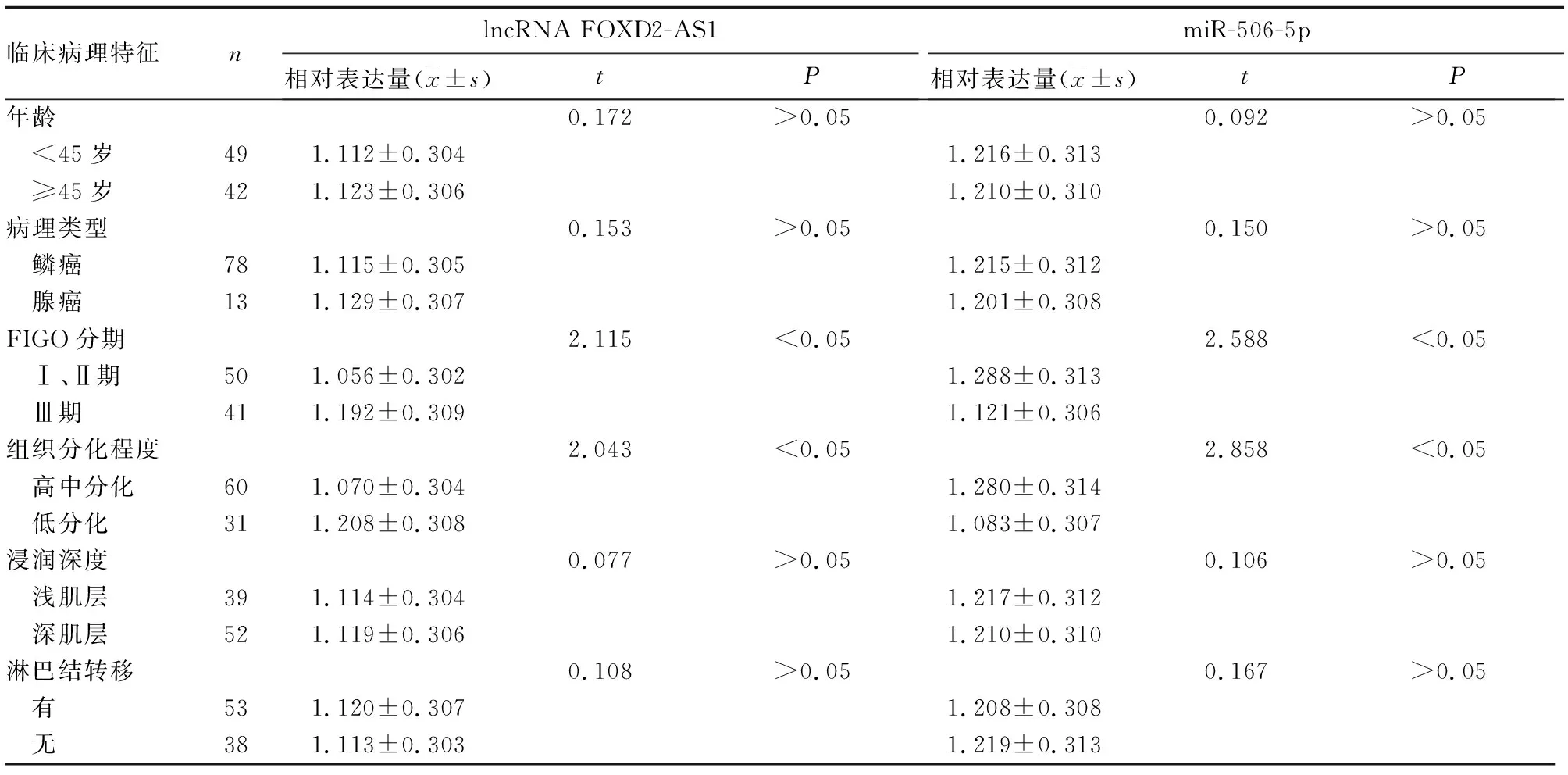
表1 宫颈癌组织lncRNA FOXD2-AS1、miR-506-5p表达与患者临床病理特征的关系
2.4 宫颈癌组织lncRNA FOXD2-AS1、miR-506-5p表达与患者预后的关系 所有患者随访3~48个月,中位随访时间31.3个月,随访期间死亡34例。以宫颈癌组织lncRNA FOXD2-AS1相对表达量的平均数(1.101)为截断值,将患者分为lncRNA FOXD2-AS1高表达者46例、lncRNA FOXD2-AS1低表达者45例。lncRNA FOXD2-AS1高表达者3年总生存率为34.6%(15/46),lncRNA FOXD2-AS1低表达者为82.5%(37/45)。lncRNA FOXD2-AS1高表达者3年总生存率低于lncRNA FOXD2-AS1低表达者(χ2=22.864,P<0.05)。见图1a。
以宫颈癌组织miR-506-5p相对表达量的平均数(1.245)为截断值,将患者分为miR-506-5p高表达者47例、miR-506-5p低表达者44例。miR-506-5p高表达者3年总生存率为78.7%(37/47),miR-506-5p低表达者3年总生存率为34.1%(15/44)。miR-506-5p高表达者3年总生存率高于miR-506-5p低表达者(χ2=18.485,P<0.05)。见图1b。
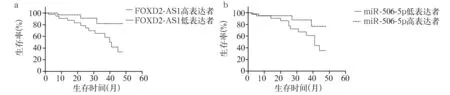
图1 宫颈癌组织不同lncRNA FOXD2-AS1、miR-506-5p表达者的生存曲线
3 讨论
我国每年宫颈癌新发病例约13.2万例,死亡达5.3万例,已成为当前严重威胁我国女性健康的重要疾病之一[10]。宫颈癌早期通过手术、放化疗等手段即可获得良好的治疗效果,但对于局部晚期或复发、转移患者,治疗效果较差。近年来,随着分子生物学技术不断发展,靶向治疗逐渐应用于临床并初见成效。但由于宫颈癌发病的分子机制目前还不清楚。因此,探索宫颈癌发病的分子机制,寻找新的诊断标志物和治疗靶点具有重要的临床价值。
lncRNA是由200~300个核苷酸组成的单链RNA分子,能够与蛋白质、非编码RNA等结合形成复合物,使特定的基因激活或失活,或通过分子支架结合细胞内其他分子,从而调控靶基因的表达,继而参与个体发育、衰老等生物学过程。有研究报道,lncRNA异常表达是肿瘤发生、发展的分子基础。lncRNA FOXD2-AS1的编码基因位于人染色体1p33。CHEN等[11]研究报道,lncRNA FOXD2-AS1在胃癌组织中表达上调,lncRNA FOXD2-AS1可通过影响下游癌基因表达,如β-钙黏素、Akt、E2F1等,促进肿瘤细胞的恶性增殖。本研究发现,宫颈癌组织lncRNA FOXD2-AS1表达明显上调,表明lncRNA FOXD2-AS1可能参与宫颈癌的发生、发展。目前lncRNA FOXD2-AS1的促癌机制尚不清楚,可能与促进lncRNA FOXD2-AS1表达的转录因子表达升高有关。有研究报道,lncRNA FOXD2-AS1表达受E2F1调控,E2F1能够结合到lncRNA FOXD2-AS1的启动子区域,并促进其表达[12]。进一步研究发现,宫颈癌组织lncRNA FOXD2-AS1表达与肿瘤FIGO分期、组织分化程度有关,表明lncRNA FOXD2-AS1异常表达能够参与宫颈癌的恶性进展,其机制可能是lncRNA FOXD2-AS1参与活化Notch信号通路,导致肿瘤细胞上皮间质转化,提高肿瘤细胞的增殖和迁移能力,而敲除lncRNA FOXD2-AS1后肿瘤细胞的增殖和迁移能力明显下降[13]。本研究还发现,lncRNA FOXD2-AS1高表达者3年总生存率低于lncRNA FOXD2-AS1低表达者。提示lncRNA FOXD2-AS1表达上调可导致宫颈癌患者预后不良,有希望成为预测患者预后的分子标志物。
miRNA是一类长度为19~23个核苷酸的非编码RNA分子,在结构上具有典型的短发夹结构,能够调控细胞发育、分化、凋亡等生物学过程。miRNA基因首先在RNA聚合酶的作用下转录为初始miRNA,进而在RNA聚合酶Ⅱ的作用下形成miRNA前体,然后在Dicer酶的作用下转化为成熟miRNA,通过形成RNA诱导沉默复合物与靶基因信使RNA特异性结合,在转录后水平调控靶基因的表达。近年研究发现,肿瘤组织中存在多种miRNA异常表达现象,并且相同的miRNA在不同肿瘤组织中发挥的生物学作用可能不同[5-7]。miR-506-5p的编码基因定位于人染色体Xq27.3。有研究表明,miR-506-5p在乳腺癌、肺癌组织中低表达;在体外基础研究中证实,上调miR-506-5p表达能够抑制肿瘤细胞增殖、侵袭、迁移等生物学行为[8]。因此,miR-506-5p可作为一种抑癌基因,其在肿瘤组织中低表达可促进乳腺癌和肺癌的发生、发展。本研究发现,宫颈癌组织miR-506-5p表达降低,表明miR-506-5p可能参与宫颈癌的发病,其机制与肿瘤发生时miR-506-5p基因的启动子区域甲基化沉默有关。有研究报道,miR-506-5p在肿瘤中发挥抑癌基因作用,其启动子区的表观遗传学修饰导致其表达显著降低,而其下游癌基因表达则显著升高[14]。进一步研究发现,FIGO分期高、组织分化程度低的宫颈癌患者肿瘤组织miR-506-5p表达较低。提示miR-506-5p异常低表达与宫颈癌的恶性进展有关,其机制可能是肿瘤发生时miR-506-5p表达降低,导致CDK4表达升高,促进肿瘤细胞周期G1期向S期转换,导致肿瘤细胞获得无限增殖的潜能[15]。本研究分析了miR-506-5p表达与宫颈癌患者预后的关系,结果发现miR-506-5p低表达的宫颈癌患者3年总生存率较低,提示miR-506-5p低表达与宫颈癌患者预后不良有关。早期检测宫颈癌组织miR-506-5p表达有助于判断患者预后。
王婷等[16]研究发现,lncRNA FOXD2-AS1能够作为分子支架结合miR-506-5p并抑制miR-506-5p表达和生物学功能,从而促进肿瘤细胞增殖并抑制其凋亡,继而促进肿瘤恶性进展。本研究还发现,在宫颈癌组织中lncRNA FOXD2-AS1表达与miR-506-5p表达呈负相关关系,提示在宫颈癌中lncRNA FOXD2-AS1可能通过负向调控miR-506-5p参与肿瘤的发生、发展。
综上所述,宫颈癌组织lncRNA FOXD2-AS1高表达、miR-506-5p低表达,二者表达呈负相关关系;宫颈癌组织lncRNA FOXD2-AS1、miR-506-5p表达与肿瘤FIGO分期、组织分化程度和患者预后有关,但二者能否成为宫颈癌早期诊断的生物标志物和治疗的潜在靶点仍需深入研究。

