慢病毒介导miR-222稳定沉默结肠癌细胞系的构建及其生物学作用
朱朝阳 赖冬萍 张涛 丁明健 卓少元 黄晓燕
1广西中医药大学附属瑞康医院(南宁530011);2广西中医药大学(南宁530000);3广西中医药大学第一附属医院(南宁530000)
微小RNA(miRNA,microRNA)是短的(20 ~24 nt)非编码核糖核酸,通过影响微小核糖核酸的稳定性和翻译,参与多细胞生物中基因表达的转录后调节。miRNAs表达异常与细胞自噬、蛋白质折叠等密切相关,可致靶基因活动异常,作为致癌或抑癌基因,在结肠癌中占据重要地位[1-2]。笔者前期通过收集6例病理证实结肠癌(炎症相关)患者的术后肠道标本,及6例健康志愿者肠道活检取材,利用基因芯片识别差异表达的miRNAs,筛选差异表达基因及相关通路。应用生物信息学,采用基因本体GO分析和途径富集分析发现大肠癌存在74个表达上调miRNA、26个表达下调miRNA,其中miR-222上调通过靶向调节TGF-β、MAPK信号通路,参与炎症相关结肠癌的发生、发展[3-4]。为证实miR-222在结肠癌中的致病地位及其生物学效应,本研究拟筛选、构建慢病毒miR-222稳定沉默的结肠癌细胞株,观察稳定沉默miR-222基因后,HCT-116结肠癌细胞增殖、凋亡、周期进程以及细胞迁移的变化,探讨miR-222与结肠癌发生、发展的关系。
1 材料与方法
1.1 材料
1.1.1 实验材料人结肠癌细胞CaCO2、HTC-15、HT-29、HCT-116、sw480、sw620。以上细胞由赛百慷(上海)生物技术股份有限公司提供,STR鉴定。293T细胞(人胚肾细胞)购自中国科学院细胞库。
1.1.2 主要试剂胎牛血清、DMEM-高糖培养基、RPMI-1640培养基、青链霉素、PBS磷酸钾缓冲液均购自Hyclone公司,胰酶Trypsin-EDTA Solution购自GIBCO公司,SYBR Green qPCR SuperMix购自Invitrogen公司;慢病毒载体(GenePharma提供的重组Lentivirus颗粒),重组穿梭质粒和包装质粒pGag/Pol、pRev、pVSV-G由广州铭善上生物公司构建制备,Puromycin Dihydrochloride(Thermo公司提供)。Hepes AMRESCO 7365-45-9,LipofectamineTM 2000转染试剂,Polybrene Sigma H9268,T4 DNA Ligase酶(购于TaKaRa公司),氨苄青霉素,DNA凝胶回收试剂盒(DONGSHENG BIOTECH),cellTiter96AQ单溶液细胞增殖检测试剂(Promega,Cat.No.G3582),Annexin V-FITC细胞凋亡检测试剂盒(keygen,货号KGA106),凯基细胞周期检测试剂盒(货号KGA511)。
1.2 方法
1.2.1 RT-PCR 检测不同结肠癌细胞miR-222 的mRNA表达分别收集已成功培养CaCO2、HTC-15、HT-29、HCT-116、sw480、sw620结肠癌细胞(1 ×106)。RT-PCR步骤如下:总RNA抽提去基因组总RNA纯度和完整性检测逆转录定量PCR。PCR反应条件为:95 ℃5 min;95 ℃15 s,60 ℃32 s读板,40 cycles;熔解曲线分析:温度60 ~95 ℃。委托上海生工技术有限公司合成miR-222、内参U6引物序列(表1)。
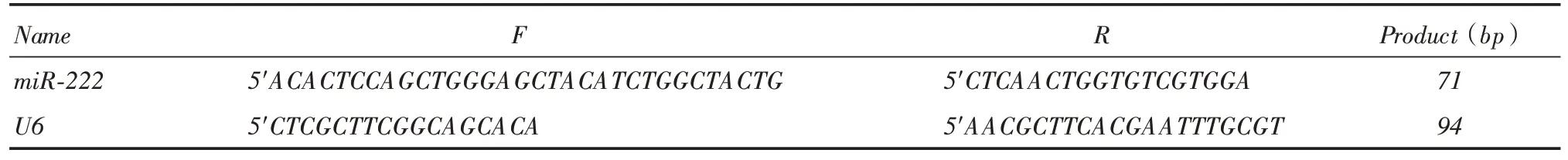
表1 miR-222、内参U6 引物序列及扩增片段Tab.1 miR-222,U6 primer sequence and amplified fragment
1.2.2 TUD-hsa-miR-222-3p Inhibitor 慢病毒载体构建应用TuD RNA(Tough Decoy RNA)的设计方法构建miRNA的抑制慢病毒载体。将稳定沉默miR-222有效序列合成、退火形成miR-222 DNA双链,将plvx-shRNAPuro载体XhoI与EcoRII双酶切载体,在T4 DNA Ligase连接酶的作用下与双链miR-222 DNA于16 ℃1 h进行连接反应制备克隆连接液,转化DH5α感受态细胞,挑取若干个阳性单克隆质粒菌落,由上海生工基因公司进行测序鉴定。
1.2.3 病毒包装制备编码慢病毒颗粒的重组病毒质粒及其三种辅助包装原件载体质粒(pGag/Pol、pRev、pVSV-G),运用质粒载体进行高纯度无内毒素抽提,用转染试剂LipofectamineTM 2000转染293T细胞,转染后更换为完全培养基,培养、收集富含慢病毒颗粒的细胞上清液,浓缩为高滴度的慢病毒浓缩液,感染293T细胞后用有限稀释法标定病毒滴度。慢病毒包装完成,将其存放于-80 ℃中备用。
1.2.4 稳定细胞株筛选及转染培养结肠癌细胞HCT-116,取对数生长期的细胞进行实验。接种(3 ~5)× 103个结肠癌HCT-116细胞于96孔培养板中,调整细胞融合度为30%~50%,用常规培养基稀释病毒作浓度梯度筛选,Polybrene(6 μg/mL)感染细胞后动态观察细胞活性。筛选感染细胞最佳MOI后,以接种密度为2×104个细胞,体积100 μL,接种于96孔板中,用慢病毒感染结肠癌HCT-116细胞,Puromycin压力筛选1周后,挑选阳性克隆细胞,进行细胞扩增、RT-PCR检测miR-222相对表达量,在倒置荧光显微镜下观察细胞GFP荧光表达情况,评价感染效率,以确定成功构建稳定沉默miR-222结肠癌HCT-116细胞系及阴性对照细胞(NC组)。收集同期未转染的细胞设为空白对照组(HCT-116组)。
1.2.5 MTS 法检测细胞存活率分别收集转染后24、48 h各组细胞1×104,加入10%cellTiter96AQ单溶液细胞增殖检测试剂,在孵育4 h后,酶标仪读板,MTS检测读取OD490数据。参照公式计算细胞存活率=(其他时间点OD值均值÷0 h OD值均值-1)×100%(同一样品)。
1.2.6 Annexin V-FITC 检测细胞凋亡分别收集各组细胞(1 × 106),胰酶消化细胞,将1.25 μLAnnexin V-FITC加入细胞悬液中,室温(18 ~24 ℃)避光反应15 min;去上清后,重悬细胞,加入10 μL Propidium Iodide,立即上机用流式细胞仪检测分析细胞凋亡率。
1.2.7 流式细胞仪检测细胞周期分别收集各组细胞(1 × 106),用乙醇进行细胞固定,加入溴化丙锭、100 μg/mL RNase A,0.2% Triton X-100,4 ℃避光孵育30 min,进行细胞染色。以标准程序用流式细胞仪检测,计数(2 ~3)×104个细胞,用ModFit分析细胞周期结果。
1.2.8 Transwell 小室模型检测细胞迁移分别收集各组细胞1 × 105,用100 μL无血清培养基重悬后,平铺至Transwell细胞培养板的小室上室,在下室加入600 μL完全培养基,放置37 ℃,5% CO2培养箱中常规培养,孵育48 h后,取出小室,用棉签轻轻拭掉上室的细胞,PBS漂洗,4%多聚甲醛固定,结晶紫染色,倒置显微镜选取5个视野,计数穿膜细胞,取均值,评价稳定沉默miR-222结肠癌HCT-116细胞的迁移能力。
1.3 统计学方法用Graphpad 8.0软件进行数据分析,数据以均数±标准差表示,两组间比较采用t检验,P <0.05为差异有统计学意义。
2 结果
2.1 miR-222 在结肠癌HCT-116 细胞中高表达RT-PCR显示HCT-116的miR-222 mRNA定量表达最高,CaCO2表达最低,因此选择HCT-116细胞为后续稳定沉默miR-222的实验细胞。
2.2 TUD-hsa-miR-222-3p Inhibitor 慢病毒高效转染HCT-116 细胞建立稳定转染细胞系测序分析证实TUD-hsa-miR-222-3p Inhibitor慢病毒载体构建成功。筛选最佳MOI为40,确定最佳杀伤浓度是0.2 μg/mL的Puromycin筛选细胞后,应用含有绿色荧光报告基因(GFP)标记观察稳定细胞株,与NC组对照,荧光转染效率达80%以上,慢病毒转染成功并稳定表达(图1)。RT-PCR结果显示miR-222基因的相对表达量降低了53.42%,miR-222在HCT-116细胞中稳定沉默。

图1 HCT-116-hsa-miR-222 Inhibitor 稳定细胞株10×10 拍照(与NC 组对照)Fig.1 HCT-116-hsa-miR-222 Inhibitor stable cell line(10×10)
2.3 稳定沉默miR-222 降低结肠癌HCT-116 细胞存活率MTS法检测稳定沉默miR-222后,HCT-116结肠癌细胞存活率变化。转染24 h后,与NC组和正常组比较,miR-222稳定沉默组细胞增殖率下降(P <0.05)。可见稳定沉默miR-222组细胞较NC组和正常组生长缓慢,并且该作用随着时间的增加而更为明显。转染48 h后,稳定沉默组细胞增殖率明显下降,差异有统计学意义(P <0.01)。根据MTS结果,绘制增值率差异和细胞生长曲线(图3)。采用Annexin V-FITC检测细胞凋亡,结果稳定沉默miR-222后,HCT-116结肠癌细胞早期凋亡率为17.7%;NC组为1.11%;正常组为6.92%(图4)。综合细胞活性下降和凋亡率升高,表明沉默miR-222后,抑制了HCH-116结肠癌细胞增殖力,诱导癌细胞凋亡,从而降低了结肠癌细胞的存活率。
2.4 稳定沉默miR-222 减缓结肠癌HCT-116 细胞周期进程流式细胞仪检测细胞周期变化,发现沉默miR-222后,miR-222稳定沉默组细胞处于S期的细胞比例明显降低,表明沉默miR-222阻滞癌细胞周期进程(图4)。
2.5 稳定沉默miR-222 抑制结肠癌HCT-116 细胞迁移能力应用Transwell小室模型检测各细胞组细胞的迁移能力,结果稳定沉默miR-222组细胞迁移数减少,与NC组和HCT-116组比较,迁移能力下降(P <0.05,图5)。
3 讨论
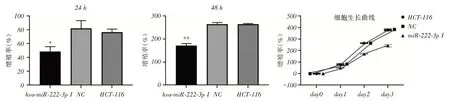
图2 稳定沉默miR-222 结肠癌HCT-116 细胞活性比较Fig.2 Comparison of Proliferation Rates of Stable Silenced MiR-222 Colon Cancer HCT-116 Cells

图3 稳定沉默miR-222 结肠癌HCT-116 细胞凋亡率比较Fig.3 Comparison of the apoptosis rate of stable and silent miR-222 colon cancer HCT-116 cells
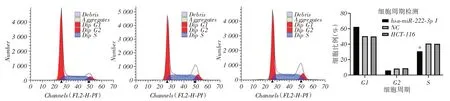
图4 各细胞组HCT-116 结肠癌细胞周期分布差异比较Fig.4 Comparison of cycle distribution of HCT-116 colon cancer cells in each cell group

图5 稳定沉默miR-222 结肠癌HCT-116 细胞迁移检测比较Fig.5 Stable and silent miR-222 colon cancer HCT-116 cell migration detection ratio
肿瘤是基因异常表达的结果,miRNAs通过与各种癌基因和抑癌基因mRNA的3′UTR区结合,影响靶基因的表达来实现对疾病的调控。microRNAs在癌间质中的异常表达与肿瘤的进展相关[5]。KHOSHINANI等[6]通过RT-PCR检测miR-222/PTEN的表达,表明miR-222通过靶向调节PTEN基因诱导大肠癌的放射抵抗。亦有研究发现,结肠癌患者粪便中miR-222定量检测与肿瘤的分期、治疗预后等关联密切[7]。miR-222在结直肠癌发生、发展过程中不同时期所发挥的作用不同,提示了miRNAs作用的复杂性[8-9],基因靶向调控是多网络、多靶点调节的结果[10]。LIU等[11]在人结直肠癌组织中发现miR-222的异常高表达,与RelA和STAT3 mRNAs水平的升高相关,miR-222抑制剂培养大肠癌细胞可降低其增殖率和集落形成,减少了结肠炎小鼠结肠肿瘤的生长。miR-222可能通过上调MST3表达,增加帕西林磷酸化,减少黏附,降低CRC细胞迁移和侵袭[12]。越来越多的证据表明miRNA的异常表达与细胞耐药性密切相关。细胞实验证实了miR-222-3p通过下调FOXP2可以改变结肠癌LoVo细胞对DOX的敏感性[13]。而miR-222高表达参与CRC细胞多重耐药形成[14],推测ADAM-17抑制剂与化疗药物联合应用可能对结直肠癌具有治疗潜力。
迁移和侵袭是恶性肿瘤普遍的生物学特性,也是影响肿瘤患者生存和预后的关键因素,成为治疗失败的主要原因[15],近年研究[16-17]发现,癌细胞对抗癌药物具有多重耐药性亦是引起CRC高病死率的又一原因。所以,寻找癌症的新型生物学标志物及治疗靶点,研发化疗药物增敏剂,成为防治结直肠癌的重要课题。本研究采用TuD RNA(Tough Decoy RNA)的设计方法构建miRNA的抑制慢病毒载体TUD-hsa-miR-222-3p Inhibitor。TuD RNA是含有颈环结构的双链RNA,能够抵抗胞内核酸酶的降解,并且TuD RNA的两条链都包含一个miRNA结合位点,能够更高效地隔离浓度较低的目标miRNA。因此TuD RNA能够更长效的抑制miRNA。病毒靶向特定组织和细胞是科研的挑战,慢病毒载体是当前癌症基因治疗中最有前途的基因传递系统之一[18]。本研究采用的慢病毒载体是以国际通用的第三代载体系统为基础,通过改建,构成四质粒体系。体外成功构建TUD-hsa-miR-222-3p Inhibitor慢病毒载体并转染HCT-116细胞得到了miR-222稳定沉默的结肠癌细胞系,明确了miR-222对HCT-16细胞的生物学影响。MICHIHISA等[5]通过ISH分析发现miR-222在癌间质中的高表达与结直肠癌的转移活性和恶性潜能正相关。这说明了miR-222的水平与肿瘤细胞的增殖有极大的关系,与肿瘤的早期形成相关。我们的MTS检测结果提示稳定沉默miR-222后的HCT-116细胞生长缓慢,各时间点的细胞生长活力均显著降低。同时稳定沉默miR-222组细胞早期凋亡率明显升高,细胞存活率下降,说明稳定沉默miR-222具有抗结肠癌HCT-116细胞生长并诱导早期凋亡的作用,这证实miR-222低表达在结肠癌细胞早期形成中发挥抑制作用。CDKN1B(p27)阻止细胞周期蛋白E-CDK2或细胞周期蛋白D-CDK4复合物的激活而控制细胞周期进程[19-20]。本研究发现稳定沉默miR-222组细胞,S期细胞所占比例明显减少。S期是细胞DNA复制的主要阶段,miR-222低表达通过上调G1/CDK阻断剂CDKN1B(p27),使更多的细胞阻滞在G0/G1期,减少肿瘤细胞合成和DNA修复。由此笔者推测,稳定沉默miR-222可能通过抑制癌基因表达,从而降低细胞生长活性,介导细胞周期阻滞并促进细胞凋亡,表现为抑癌基因的功能。GAO等[21]研究分析了miR-222介导的MIA3基因敲除及其结果证明下调MIA3可增强大肠癌细胞的迁移和侵袭。miR-141-3p过表达靶向TRAF5起肿瘤抑制作用[22]。与本研究结论类似。本研究通过Transwell小室模型检测细胞的迁移能力,结果提示稳定沉默miR-222后HCT-116细胞穿膜进入下室的细胞数明显减少,表明miR-222稳定沉默细胞株的迁移能力显著低于NC组和正常组,进一步说明miR-222在结肠癌晚期转移中发挥负向调控作用。
抑癌基因表达下调或失活被认为是肿瘤发生的早期事件。TGF-β激活后可诱导不同细胞类型的上皮间充质转化(EMT)和细胞迁移[23-24]。研究表明TGF-β通过蛋白质代谢参与炎症性肠病癌变[25]。下调miR-222-3p表达量,推测miR-222-3p可能通过靶基因TGF-β/MAPK通路负性调控结肠癌HCT-116细胞的恶性生物学行为,其下游信号传导途径中的作用尚未完全阐明。
综上,本研究高通量筛选癌基因,采用慢病毒感染技术,将TUD-hsa-miR-222-3p Inhibito慢病毒载体成功转染结肠癌HCT-116细胞,产生特异性的miR-222沉默效应,抑制了结肠癌HCT-116细胞的活性、周期进程和迁移能力,诱导癌细胞凋亡,下一步拟在体构建裸鼠结肠癌模型,探索miRNA-222下游靶基因表达的调控。

