乙肝耐药全基因测序分析研究
姜静,万浩,李徐图,谢文英,蒋丽琳,杨瑞生,张平,孟冬梅
(武汉康圣达医学检验所有限公司 营销感染市场部,湖北省 武汉市 430000)
乙型肝炎病毒(HBV)感染是一个全球性健康问题,它增加了患者肝硬化、肝癌的风险,需要终生治疗。世界卫生组织报道,每年约有88.7万人死于HBV 感染所致的肝衰竭、肝硬化或原发性肝癌。全世界约有2.57 亿人患有慢性乙型肝炎,其中非洲和亚洲的感染率最高[1]。在我国60%肝硬化和80%肝细胞癌患者由HBV 感染引起[2]。核苷(酸)类抗病毒药物是目前治疗慢性乙型肝炎的主流,但核苷类似物的长期使用导致患者体内不同程度出现病毒耐药突变。耐药变异是HBV 经过抗病毒药物的选择,逐渐对治疗药物失去敏感性,从而产生抗药性的过程。HBV 耐药性的出现是悄无声息的,难以无法在第一时间发现。只有当耐药的HBV 繁殖到一定数量,才能通过现有的HBV-DNA 检测技术发现[3]。HBV 在核苷(酸)类抗病毒药物的作用下会发生一个或多个耐药位点的突变。如何及时灵敏地预测耐药株的出现,为临床医生提供选择最佳替换治疗方案或重新选择治疗时机显得尤为必要。分析HBV 耐药突变位点对于临床抗病毒治疗方案的选择以及流行病学的研究意义重大。笔者采用全基因测序方法,随机选取分析了2019 年1 月至2019 年5 月126 例患者的耐药基因检测结果,为评价药物治疗效果和合理用药提供理论基础,现报道如下。
1 资料与方法
1.1 研究对象
本组126 例,男89 例,女37 例;年龄12~75 岁。所有患者均为接受核苷(酸)类药物抗病毒治疗的慢乙肝患者。核苷(酸)类药物包括拉米夫定(LAM),阿德福韦(ADV),恩替卡韦(ETV),替比夫定(LdT)和替诺福韦酯(TDF)
1.2 主要仪器和试剂
巢式聚合酶链式反应(PCR)所用仪器为BIO-RAD 基因扩增仪,测序所用仪器为ABI 3700。采集患者血清,按试剂盒要求的步骤从血清中提取HBV DNA,所用试剂盒购自达安基因股份有限公司。进行巢式PCR 引物进行扩增,扩增完毕后,产物进行基因测序,检测其耐药位点形式。所用试剂盒为BigDye Direct Sanger Sequencing Kit。
1.3 HBV 耐药位点分析
为确定所研究病毒群体中是否存在与所用药物有关的耐药突变位点,共分析25 个可能出现的耐药突变位点。与HBV 标准序列片段进行比对,对测序结果进行位点突变分析。见表1。
2 结果
2.1 耐药位点突变率统计结果
126 例患者中,74 例(58.7%)检测到耐药位点突变,主要发生在204 位点和180 位点,突变率占比分别为44%和33%。其次为181 位点,突变率占13%。主要是与LAM 耐药相关的位置。其他位点具体如图1 所示。其中L180M+M204V+A181G/C 的突变,已有报道[4]称可能对ETV 耐药,可以更好指导用药。

表1 检测位点及对应核苷酸和氨基酸

图1 耐药位点突变率
2.2 耐药突变位点连锁分析结果
在检测到的发生耐药突变的74 例患者中,发生耐药位点连锁突变的49 例,占66.2%。突变位点的连锁模式达36 种,最主要的连锁突变位点是M204V+L180M+S202G,占24.5%(12 例)。男性发生耐药的例数为58 例,204 位点突变率为62%(39/58),180 位点突变率为53.4%(31/58),181位点突变率为22.4%(13/58),236 位点突变率为6.8%(4/58);女性发生耐药的例数为16 例,其中204 位点突变率为50.0%(8/16),180 位点突变率为31.2%(5/16),181 位点突变率为6.25%(1/16);31~60 岁的患者中,180 位点变异率为61%(22/36),181 位点突变率为22.2%(8/36),204 位点变异率为83.3%(30/36),236 位点变异率为11.1%(4/36)。61 岁以上的患者中,180 位点变异率为45.5% (5/11),181 位点变异率为18.1%(2/11),204 位点变异率为45.5%(5/11),236 位点变异率为0。
HBV P 区位点突变主要集中在180、181、204和236 位点,其他位点也存在较低比例的变异。不同性别和不同年龄段的患者中,HBV P 区基因突变率尚不具有统计学意义上的显著差异。通过测序技术检测位点的突变,可以全面反映P 区位点的变异情况,为临床用药提供重要依据。应当指出的是,发生变异不一定耐药,只有当变异株成为优势株时才会发生耐药。
3 讨论
人们对HBV 感染的自然史和由此产生的疾病的治疗潜力的认识正在不断提高。目前,用于乙型肝炎抗病毒治疗的药物一般有两类,一类是干扰素(IFN),一类是核苷(酸)类似物,在我国准许临床治疗应用的核苷(酸)类似物主要有5种,包括LAM,ADV,ETV,LdT 和TDF[5]。核苷(酸)类似物在临床治疗应用中为抗病毒首选药物,其治疗目的是抑制HBV 复制并最终阻止或延缓慢性乙型肝炎并发症的发生[6]。现阶段的核苷类似物对病毒的抑制作用是通过影响反转录的启动及DNA 的延伸,使病毒的复制受到抑制而发挥效用[4]。
如图2 所示,核苷(酸)类似物间存在交叉耐药点的问题。对于已发生变异的患者,建议临床合理的选择用药,及时监测耐药突变位点的情况,避免出现多重耐药而增加治疗难度。若已出现多重耐药,则更应该监测其耐药突变位点,合理优化治疗方案,避免病情失去控制而进一步加重。
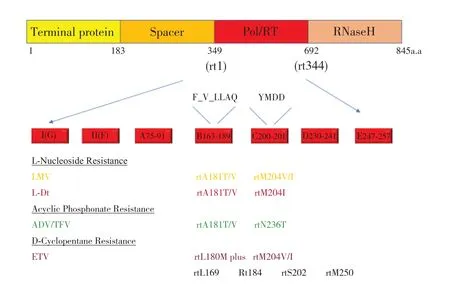
图2 HBV 对应核苷(酸)类似物耐药的基因突变位点
对研究对象进行分析得到的结果揭示耐药发生率最高的是LAM,这也与已有文献报道LAM 耐药发生率高达65%~70%吻合[7]。在耐药的处理方面最困难的是多重耐药的出现。随着临床用药,其他新的耐药突变模式陆续出现。本研究中,A181T/V+N236T 位点突变占3 例,其联合突变可导致LAM、LdT 和ADV 耐药,并可显著降低TDF的抗病毒活性。国内的研究及发现了2 例rt250V/L,rt20I,rtlS0M 和rt204V,rt202G,rt184I新的突变组合。这种新的突变模式是否也会引起ETV 耐药或其他耐药还需进一步验证。其中本次分析的患者中也发现了L180M+M204V+A181G/C的突变,已有文献报道可能对ETV 耐药[4]。总体分析表明,男性的耐药率比女性高。年龄上,61岁患者以上在236 位点的突变较少,可以指导临床用药。
当变异株最终推翻野生株的统治后,耐药发展到临床耐药阶段。患者血液中HBV DNA 水平会反弹,最终出现肝功能异常、肝脏组织学损伤。因此我们在病毒学耐药阶段及基因耐药阶段就应该尽早进行干预,及时阻止病毒学耐药向临床耐药的恶性方向发展。更有利于指导用药,减少多重耐药突变的发生。耐药变异位点的检测和用药期间的监测,可以指导临床选择和调整核苷酸类药物,具有非常重要的临床价值。

