不同浓度葡萄糖对红细胞能量代谢的影响
李旭妍,孙明玥,苏 燕,杨丽丽,王亚奇,宋 芳,闫巧梅,黄世琪,闫朝丽,萨如拉,李晶晶,梁 浩,王云霞,韩家鑫,聂欣雨,刘瑞刚
糖尿病是一类由于胰岛素分泌缺陷或胰岛素作用障碍所致的以慢性高血糖为特征的终身代谢性疾病,已成为继癌症和心血管病之后的又一严重威胁人类健康的全球性疾病[1-3]。它的诱发因素很多,目前公认的有遗传、环境、生活方式及个人体质等。红细胞随血液循环于全身,是最早感知血糖变化的细胞之一。近年,主要从血红蛋白糖基化[4]、红细胞分布宽度[5]、红细胞膜[6]等方面针对糖尿病患者的红细胞改变进行了较为深入的研究,而从红细胞能量代谢方面探索其在糖尿病及其微血管病变发生发展中作用的研究少之又少。该研究拟通过实时检测不同浓度葡萄糖37 ℃培养红细胞不同时间后,其ATP含量、己糖激酶(hexokinase,HK)活性、丙酮酸激酶(pyruvate kinase,PK)活性、活性氧(reactive oxygen species,ROS)含量及红细胞衰亡率的变化,阐明葡萄糖对体外红细胞能量代谢的影响方式及其分子机制,为糖尿病微血管病变的诊断和防治奠定理论基础。
1 材料与方法
1.1 实验材料正常成人新鲜抗凝血、ATP检测试剂盒(货号S0027)、ROS检测试剂盒(货号S0033)购自上海碧云天生物技术公司;Hexokinase Activity Assay试剂盒(货号ab136957)、Pyruvate Activity Assay试剂盒(货号ab83432)购自英国Abcam公司;APC Annexin V细胞凋亡检测试剂盒(货号550474)购自美国BD公司;葡萄糖(货号D810588)、PBS缓冲液(货号P854529-10EA)购自上海麦克林生化科技有限公司。
1.2 实验方法
1.2.1血样采集与红细胞制备 该项目由包头医学院伦理委员会审核批准,依据实验要求每批实验招募18~23岁的健康志愿献血者6例,并在献血前与志愿者签署知情同意书。分别采集5 ml 全血,2 000 r/min离心5 min后,去除血小板、白细胞和血浆。再用PBS清洗红细胞,2 000 r/min离心5 min,去除上清液及中间的血小板和白细胞,重复洗至上清液透明。然后于无菌操作台中将红细胞重悬于PBS,使红细胞压积达到45%左右。将制备好的悬浮红细胞轻轻混匀后分为4组(每组1 ml,重复3次),分别向其中加入D-葡萄糖,使其终浓度分别为0、6、20、30 mmol/L。轻轻混匀,37 ℃震荡水浴培养48 h。分别于培养期24和48 h, 轻轻混匀EP管中的悬液,无菌抽取200 μl 红细胞悬液,分别进行以下指标检测。
1.2.2ATP含量检测 取红细胞悬液60 μl,2 000 r/min,离心5 min,弃上清液。轻轻弹散红细胞,取5 μl 红细胞加入到200 μl Buffer中制成溶血液。取4 μl溶血液加入到100 μl检测液及16 μl裂解液中,利用多功能酶标仪的luminometer功能测定各孔的相对光单位(relative luminometer units,RLU)值并计算结果。
1.2.3HK活性检测 取红细胞悬液60 μl,2 000 r/min,离心5 min,弃上清液。轻轻弹散红细胞,取10 μl制成溶血液,再取20 μl溶血液加入到80 μl检测液,室温避光放置20 min后,利用多功能酶标仪检测450 nm波长处各孔的光密度(optical density,OD)值并计算结果。
1.2.4PK活性检测 取红细胞悬液40 μl,2 000 r/min,离心5 min,弃上清液。轻轻弹散红细胞,取10 μl制成溶血液,再取2 μl溶血液加入到98 μl检测液中,室温避光放置10 min后,利用多功能酶标仪检测570 nm波长处各孔的OD值并计算结果。
1.2.5ROS检测 取红细胞悬液20 μl,2 000 r/min,离心5 min,弃上清液。轻轻弹散红细胞,取1 μl 红细胞加入到按照1 ∶1 000用PBS缓冲液稀释的DCFH-DA(500 μl)中,室温避光孵育30 min,然后3 500 r/min,离心5 min,弃上清液。加500 μl PBS缓冲液洗红细胞,重复3次,加入300 μl PBS缓冲液重悬红细胞后,利用流式细胞仪检测ROS含量。
1.2.6红细胞衰亡检测 取红细胞悬液20 μl,2 000 r/min,离心5 min,弃上清液。轻轻弹散红细胞,取1 μl 红细胞加入到100 μl工作液中(100 μl的1×Binding buffer与0.5 μl Annexin V-FITC和APC的混合液),轻轻混匀,室温避光孵育15 min后用流式细胞仪进行检测。
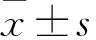
2 结果
2.1 不同浓度葡萄糖对红细胞内ATP含量的影响在不同浓度葡萄糖组,随着培养时间的延长,各不同浓度葡萄糖组红细胞内ATP含量呈波动式下降,其中0 mmol/L组红细胞内ATP含量下降最为显著,6 mmol/L组仅48 h变化明显,与对应浓度组的0 h比较,差异有统计学意义(0 mmol/L组:F=2 715.43,P<0.01;6 mmol/L组:F=22.05,P<0.01),而20、30 mmol/L组变化幅度较小,与对应组的0 h比较,差异无统计学意义(20 mmol/L组:F=9.34,P>0.05;30 mmol/L组:F=9.45,P>0.05)。从培养时间看,培养24、48 h后,红细胞内的ATP含量均随着葡萄糖浓度增加而不断升高,与对应时间点的0 mmol/L比较,差异有统计学意义(24 h:F=24.03,P<0.01;48 h:F=6.41,P<0.01),见图1。
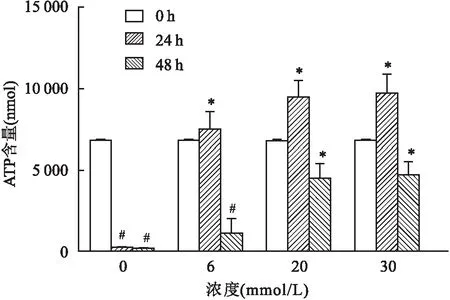
图1 不同浓度葡萄糖对红细胞内ATP含量的影响
2.2 不同浓度葡萄糖对红细胞内HK活性的影响在不同浓度葡萄糖组,随着孵育时间延长,各不同浓度葡萄糖组红细胞内HK活性不断下降,其中0和6 mmol/L组下降幅度较大,与对应浓度组的0 h比较,差异有统计学意义(0 mmol/L组:F=38.25,P<0.05;6 mmol/L组:F=13.66,P<0.05),而20和30 mmol/L组仅48 h与对应浓度组的0 h比较,差异有统计学意义(20 mmol/L组:F=6.93,P<0.05;30 mmol/L组:F=7.09,P<0.05);而在培养24、48 h后,红细胞内HK活性均随着葡萄糖浓度的增加而增高,与对应时间点的0 mmol/L组比较,差异有统计学意义(24 h:F=14.4,P<0.05;48 h:F=6.72,P<0.05),见图2。

图2 不同浓度葡萄糖对红细胞内HK活性的影响
2.3 不同浓度葡萄糖对红细胞内PK活性的影响在不同浓度葡萄糖组,随着培养时间的延长,各不同浓度葡萄糖组红细胞内PK活性不断下降,其中0和6 mmol/L组下降幅度比较大,与对应浓度组的0 h比较,差异有统计学意义(0 mmol/L组:F=125.21,P<0.05;6 mmol/L组:F=29.61,P<0.05),而20和30 mmol/L组下降趋势不明显,与对应浓度组的0 h比较,差异无统计学意义(20 mmol/L组:F=2.81,P>0.05;30 mmol/L组:F=2.07,P>0.05);而在培养24、48 h后,红细胞内的PK活性随着葡萄糖浓度的增加而稳步上升,30 mmol/L组与对应时间点的0 mmol/L组比较,差异有统计学意义(24 h:F=5.09,P<0.05;48 h:F=4.04,P<0.05),见图3。
图3 不同浓度葡萄糖对红细胞内PK活性的影响
2.4 不同浓度葡萄糖对红细胞内ROS含量的影响在不同浓度葡萄糖组,随着时间的延长,各不同浓度葡萄糖组红细胞内ROS含量呈上升趋势,其中0 mmol/L组变化最为明显,6 mmol/L组仅48 h与对应浓度组的0 h比较,差异有统计学意义(0 mmol/L组:F=10.79,P<0.05;6 mmol/L组:F=8.73,P<0.05);在培养24、48 h后,红细胞内ROS的含量随葡萄糖浓度增加而降低,与对应时间点的0 mmol/L组比较,差异有统计学意义(24 h:F=10.74,P<0.05;48 h:F=8.44,P<0.05),见图4。

图4 不同浓度葡萄糖对红细胞内ROS含量的影响
2.5 不同浓度葡萄糖对红细胞衰亡率的影响在不同浓度葡萄糖组,随着时间延长,各不同浓度葡萄糖组红细胞的衰亡率不断上升,但各不同浓度组仅48 h变化最为显著,与对应浓度组的0 h比较,差异有统计学意义(0 mmol/L组:F=28.5,P<0.05;6 mmol/L组:F=24.19,P<0.05;20 mmol/L组:F=22.19,P<0.05;30 mmol/L组:F=7.22,P<0.05),0 mmol/L组由于能量供应不充足,红细胞衰亡率上升尤其显著;在培养24、48 h后,红细胞衰亡率随葡萄糖浓度增加而下降,与对应时间点的0 mmol/L组比较,仅48 h的差异有统计学意义(F=17.66,P<0.05),见表1、图5。

表1 不同浓度葡萄糖对红细胞衰亡率的影响
3 讨论
糖尿病微血管病变是糖尿病特有的一种并发症,其主要表现为血管基底膜病变和微循环异常[7]。微循环异常除血流动力学改变外主要体现在红细胞方面。红细胞变形能力和生理功能的正常是保证微循环的必要条件。早在20世纪60年代就有文献提出维系红细胞形态需要ATP提供能量,红细胞变形能力与红细胞代谢活性密切相关[8]。葡萄糖在葡萄糖转运蛋白GLUT1的作用下易化扩散进入红细胞,在红细胞内,约90%的葡萄糖进行糖酵解,其余10%进入磷酸戊糖途径,因此糖酵解是红细胞获得ATP的唯一途径。HK和PK是糖酵解途径的关键酶,调控着ATP生成的速率和量,对维持红细胞形态和功能起到至关重要的作用。有研究[9-11]表明糖尿病患者红细胞内HK和PK活性高于正常人。本研究结果表明,短期葡萄糖体外孵育的条件下,随着葡萄糖浓度增加,红细胞内ATP含量逐渐增高,HK和PK活性也不断增高。据此推测,红细胞外葡萄糖浓度越高,易化扩散进入红细胞内的葡萄糖越多,关键酶活性越高,产生的ATP越多。然而HK和PK活性均随培养时间延长逐渐下降,可能与红细胞内葡萄糖的逐渐消耗减少及体外细胞培养状态有关。也有研究[12]报道葡萄糖经糖酵解代谢时产生的代谢中间物6-磷酸葡萄糖增加到一定量时会抑制HK活性,这也可能是引起红细胞内HK活性随时间延长下降的原因之一。此外,胞外葡萄糖浓度越高,进入胞内的糖量越多。与6 mmol/L组比较,胞内ATP含量明显增高,说明高浓度葡萄糖代谢产生的过量ATP,也可能反馈性抑制HK和PK活性。

图5 流式细胞仪检测不同浓度葡萄糖对红细胞衰亡的影响
在人体血液中,红细胞是数量最多的血细胞。红细胞运输氧气的功能使其不断与细胞内外的氧自由基接触,且其细胞膜上含有丰富的不饱和脂类,因此红细胞极易受到氧自由基的氧化损伤。已有研究证实[9],长期慢性高血糖会引起ROS过度产生或积累,进而引发严重的病理改变,例如微血管及大血管异常。其原因主要是由于高浓度葡萄糖使内源性ROS形成增加,激活Ca2+通道,导致红细胞内Ca2+浓度升高,并直接激活钙敏感的K+通道。这进一步导致红细胞膜发生超极化而使K+离子泄漏,从而提高了Cl-排出的电驱动力[13]。最后,KCl随胞液从细胞中渗出,使细胞体积减少以及膜完整性丧失,细胞膜表面磷脂酰丝氨酸外翻,继而引起红细胞衰亡的发生。Vitak et al[14]报道葡萄糖自氧化、脂质过氧化以及Amadori产物和晚期糖基化终末产物的形成是糖尿病患者红细胞内自由基产生的主要原因。本研究结果显示,与6 mmol/L组比较,高糖组红细胞内ROS及衰亡率均降低,说明短时间内高糖尚不能引起红细胞发生氧化应激进而引起细胞衰亡。短期高糖培养减少ROS的原因可能是由于进入红细胞内的葡萄糖增多会通过磷酸戊糖途径产生的更多的NADPH,进而增加抗氧化物质谷胱甘肽的生成,阻止了ROS的过度产生;亦或是稳定的糖基化终末产物还未形成,自由基形成少,不能引起红细胞氧化损伤。与此相反,0 mmol/L组红细胞内ROS和衰亡率均较其他组高,说明能量匮乏可以刺激红细胞发生氧化应激,导致红细胞衰亡。

