格列齐特调节InsR/PI3K/GSK-3β通路改善2型糖尿病小鼠肝脏胰岛素抵抗作用
赵天娇,黄 琼,魏 伟
2型糖尿病(type 2 diabetes mellitus,T2DM)的主要特征为胰岛素分泌不足或胰岛素抵抗[1]。胰岛素抵抗会导致肝脏、肌肉和脂肪组织对一定量的胰岛素产生的生物学效应低于正常水平,造成葡萄糖摄取和糖原合成受损等[2-3]。
胰岛素抵抗与胰岛素信号通路的密切相关,其中任何一个环节缺陷均可引起抵抗,如胰岛素受体(insulin receptor,InsR)、胰岛素受体底物(insulin receptor substrate,IRS1)、磷脂酰肌醇3-激酶(phosphatidylinositol 3-kinase, PI3K)、糖原合成激酶3β(glycogen synthase kinase 3 beta,GSK-3β)、葡萄糖转运蛋白4(glucose transporter 4,GLUT4)等蛋白缺陷均可导致胰岛素信号通路的失调[4-6]。
格列齐特是一种磺脲类降糖药[8],通过特异性的关闭胰岛β细胞膜上KATP通道促胰岛素分泌[8],也可通过增加InsR磷酸化改善C2C12肌肉细胞胰岛素抵抗[9];促进GLUT4膜转移改善过氧化氢诱导的3T3L1脂肪细胞胰岛素抵抗[10]。但是,格列齐特改善肝脏胰岛素抵抗的机制尚未完全阐明[8-11]。该研究旨在探讨格列齐特改善T2DM肝脏胰岛素抵抗的作用及其分子机制。
1 材料与方法
1.1 材料
1.1.1药物与试剂 链脲佐菌素(STZ)、胰岛素、格列齐特(美国Sigma公司);InsR抗体(美国Proteintech公司,货号:20433-1-AP,浓度:1 ∶1 000)、PI3K抗体(美国Proteintech公司,货号:4G3C11, 浓度:1 ∶1 000)、GSK3β抗体(美国Proteintech公司,货号:22104-1-AP,浓度:1 ∶1 000)、β-Actin抗体(美国Proteintech公司,货号:66009-1-lg,浓度:1 ∶1 000);IRS1抗体(美国Affinity Bioscience公司, 货号: AF3272浓度:1 ∶500)、GLUT4抗体(美国Affinity Bioscience公司,货号:AF5386, 浓度:1 ∶500);p-IRS1抗体(美国Abcam公司,货号:ab131487,浓度:1 ∶500)、p-GSK3β抗体(美国Abcam公司,货号:ab75745,浓度:1 ∶500);葡萄糖试剂盒(南京建成公司);糖原试剂盒(北京索莱宝公司);辣根过氧化物酶HRP标记亲和纯化山羊抗兔IgG二抗、辣氧过氧化物酶HRP标记亲和纯化山羊抗鼠IgG二抗(北京中杉金桥)。
1.1.3实验细胞株 HepG2细胞购自中科院上海细胞库。
1.2 方法
1.2.1T2DM动物模型的制备 C57BL/6小鼠适应性喂养1周后,随机分出8只作为正常组。其余小鼠喂以4周高脂饲料,自由进水;第5周末,连续3 d腹腔注射STZ(60 mg/kg)诱导T2DM模型。72 h后剪尾采血测量空腹血糖,以禁食12 h血糖≥11.1 mmol/L认为是成功[12],并随机分为T2DM组、格列齐特低剂量组(5 mg/kg)、中剂量组(10 mg/kg)、高剂量组(20 mg/kg),每组8只。格列齐特每日灌胃给药一次,共4周;正常组和T2DM组生理盐水灌胃。
1.2.2HepG2胰岛素抵抗细胞模型的建立与分组 HepG2细胞株用含10%胎牛血清、1%青霉素/链霉素的DMEM于37 ℃、5% CO2的培养箱中培养。参考文献[13]的基础上稍作改进,将HepG2细胞以1×104个/孔(100 μl)种于96孔培养板,80%融合后,对照组加正常培养液,胰岛素刺激组加1 μmol/L胰岛素的培养液,分别刺激24、36、48 h。孵育结束后,吸弃培养液,换上含2%血清的无酚红培养液培养24 h,用葡萄糖测定试剂盒测定培养液上清中的葡萄糖含量。葡萄糖消耗量=空白孔中葡萄糖含量-测定孔中葡萄糖含量。确定最佳作用时间。
确定胰岛素最佳时间后,用10、1 μmol/L,100、10 nmol/L胰岛素的培养液选择胰岛素最佳浓度。胰岛素抵抗细胞模型建立后,设置对照组、胰岛素刺激组、格列齐特组(2.5、5、10 mmol/L)。
1.2.3葡萄糖代谢指标的测定 给药期间每周测定小鼠空腹血糖1次。检测前小鼠禁食不禁水10 h,尾尖取血。给药前,正常组和T2DM组小鼠进行腹腔注射糖耐量试验(intraperitoneal glucose tolerance test,IPGTT);给药结束后,各组均行IPGTT。小鼠禁食不禁水10 h后,腹腔注射1g/kg葡萄糖;于注射后0、15、30、60、120 min尾尖血测血糖,计算血糖-时间曲线下面积(area under the curve,AUC)。
1.2.4血清生化指标的测定 给药结束后,动物禁食12 h后眼眶取血,分离血清,ELISA法检测血清中胰岛素水平,并计算胰岛素抵抗指数(homeostasis model assessment of insulin resistance,HOMA-IR)=(空腹血糖)×(空腹血清胰岛素)/22.5。
目前,有许多类型的在中国的混凝土搅拌机,但按照混合搅拌机的结构,不同材料的混合,混合机的要求是不一样的,搅拌质量好,结构设计合理,使用方便,地基稳定性,根据这些要求和混凝土搅拌机的要求进行设计。
1.2.5肝脏组织的处理与收集 颈部脱臼处死小鼠,迅速取出肝组织,用生理盐水洗净后,固定于4%多聚甲醛或保存于-80 ℃。
1.2.6胰岛素抵抗HepG2细胞葡萄糖消耗和糖原含量的测定 葡萄糖氧化酶法检测细胞葡萄糖消耗的变化。糖原测定试剂盒检测糖原含量,将HepG2细胞以1×104个/孔(100 μl)种于24孔培养板,1 μmol/L胰岛素处理48 h,SpectraMax M5分光光度计测定吸光度(620 nm)[14]。
1.2.7Western blot法 裂解液提蛋白,InsR、p-IRS1/IRS1、PI3K、p-GSK3β/GSK3β、GLUT4抗体检测蛋白表达。
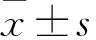
2 结果
2.1 格列齐特改善T2DM小鼠空腹血糖4周高脂联合3次小剂量腹腔注射STZ诱导的C57BL/6小鼠空腹血糖值均≥11.1 mmol/L,造模成功。格列齐特低、中、高剂量组给药4周后均降低T2DM小鼠的空腹血糖水平(F=114.9,P<0.01),提示格列齐特具有降血糖作用 (图1、表1、2)。
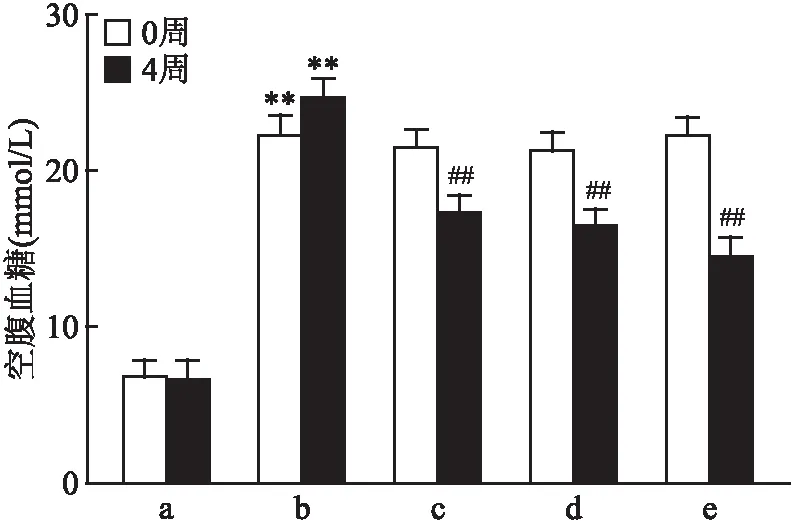
图1 格列齐特对T2DM小鼠空腹血糖的影响(n=8)
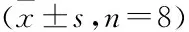
表1 格列齐特给药0和4周T2DM小鼠空腹血糖水平
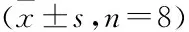
表2 格列齐特给药4周T2DM小鼠空腹血糖水平
2.2 格列齐特改善T2DM小鼠葡萄糖耐量给药前,T2DM组小鼠腹腔注射葡萄糖后2 h内的血糖水平一直居高不下,且2 h后无法恢复到初始水平;T2DM组小鼠AUC较正常组升高(F=185.052,P<0.01)(图2),提示T2DM组小鼠糖耐量异常。
给药结束后,T2DM组小鼠空腹血糖及腹腔注射葡萄糖后2 h内的血糖水平较同期正常组升高,且2 h后血糖无法恢复到初始水平,提示其葡萄糖耐量异常;格列齐特治疗组小鼠血糖水平较同期T2DM组均降低,2 h后血糖恢复到初始水平。 T2DM小鼠AUC较正常对照组升高,格列齐特治疗组AUC较T2DM组小鼠降低,提示格列齐特低、中、高剂量组均可改善T2DM小鼠糖耐量异常(F=26.185,P<0.01)(图2)。
2.3 格列齐特对T2DM小鼠血清胰岛素和胰岛素敏感性的影响与正常组比较,T2DM组小鼠血清胰岛素水平降低,格列齐特治疗组小鼠血清胰岛素水平较T2DM组小鼠升高,提示格列齐特可以促进胰岛素分泌(F=24.443,P<0.01)(图3A)。T2DM组小鼠HOMA-IR较正常组升高,格列齐特治疗组HOMA-IR较T2DM组降低(F=21.252,P<0.05),提示格列齐特可以改善T2DM小鼠胰岛素抵抗(图3B)。
2.4 格列齐特保护T2DM胰岛素抵抗小鼠肝损伤肝脏HE染色表明,正常组小鼠肝细胞排列整齐,细胞形态正常,胞质丰富,边界清晰;T2DM小鼠肝细胞形态不规则,伴有脂质空泡,核质破裂,结构不完整,肝细胞呈现不同程度的坏死;格列齐特各剂量组均可以改善肝脏的理变化,减少脂质空泡和肝细胞坏死,使肝细胞结构保持完整,且格列齐特10 mg/kg和格列齐特20 mg/kg较格列齐特5 mg/kg保护作用好。表明格列齐特可以保护T2DM小鼠肝脏损伤(图4)。
2.5 胰岛素抵抗HepG2细胞模型的最佳浓度和作用时间胰岛素作用24、36、48、60 h均可造成HepG2细胞葡萄糖消耗量下降(F=4.562,P<0.05),48 h葡萄糖消耗量最小,因此确定胰岛素最佳作用时间为48 h(图5A)。100 nmol/L、1 μmol/L和10 μmol/L浓度的胰岛素刺激48 h后(F=3.192,P<0.01),HepG2细胞葡萄糖消耗量下降,且1 μmol/L胰岛素刺激组的葡萄糖消耗量最小,故将此浓度作为胰岛素最佳浓度(图5B)。
2.6 格列齐特改善胰岛素抵抗HepG2细胞葡萄糖消耗和糖原含量与对照组比较,胰岛素刺激组葡萄糖消耗量下降;与胰岛素组比较,格列齐特组葡萄糖消耗增加(F=13.111,P<0.01)(图6A)。胰岛素刺激组糖原含量较对照组减少,格列齐特各浓度组较模型组糖原含量增多,提示格列齐特可以增加胰岛素抵抗HepG2细胞葡萄糖消耗和糖原含量,10 mmol/L效果最佳(F=38.968,P<0.05)(图6B)。
2.7 格列齐特上调T2DM小鼠和胰岛素抵抗HepG2细胞的胰岛素信号通路格列齐特可以增加T2DM小鼠肝组织和胰岛素抵抗HepG2细胞InsR(FInsR,肝=91.093,P<0.01;FInsR,HepG2=76.479,P<0.01)和PI3K(FPI3K,肝=96.319,P<0.01;FPI3K,HepG2=93.645,P<0.01)的表达,促进IRS1磷酸化(Fp-IRS1,肝=21.835,P<0.01;Fp-IRS1,HepG2=38.230,P<0.01),抑制p-GSK3β磷酸化(Fp-GSK3β,肝=41.575,P<0.01;Fp-GSK3β,HepG2=103.452,P<0.01)(图7、8)。此外,格列齐特可以增加胰岛素抵抗HepG2细胞GLUT4的膜表达(F=114.411,P<0.01)(图9)。
3 讨论
胰岛素抵抗是糖尿病、高血压和肥胖等疾病的共同发病机制之一。目前临床上用于治疗糖尿病的药物中,具有改善胰岛素抵抗的药物主要包括双胍类和噻唑烷二酮类。但这两类药物由于胃肠道不耐受或继发不良反应等原因,导致部分患者服用后胰岛素抵抗状态无法改善,甚至导致糖尿病并发症提早出现[15],故寻找更多的能够改善胰岛素抵抗的药物很有必要。格列齐特通过选择性作用于胰岛β细胞,促进胰岛素分泌的作用以降低血糖,但格列齐特对T2DM肝脏胰岛素抵抗的作用尚不清楚[8]。本研究拟通过构建T2DM小鼠模型和胰岛素抵抗HepG2细胞模型来探究格列齐特对肝脏胰岛素抵抗的作用及其可能的分子机制。
T2DM小鼠模型的给药结果显示,格列齐特可以降低T2DM小鼠空腹血糖,改善糖耐量,增强机体对血糖的调节能力;促进胰岛素分泌,改善T2DM小鼠对胰岛素敏感性。同时格列齐特可以改善T2DM小鼠的肝脏损伤,肝脏空泡化和肝细胞坏死程度明显减轻,肝细胞结构更加完整,排列整齐,核质清晰,边界清楚。此外,格列齐特还可以增加胰岛素抵抗HepG2细胞的葡萄糖消耗和糖原含量。这提示格列齐特能够改善T2DM小鼠肝脏胰岛素抵抗,促进葡萄糖代谢和糖原合成。
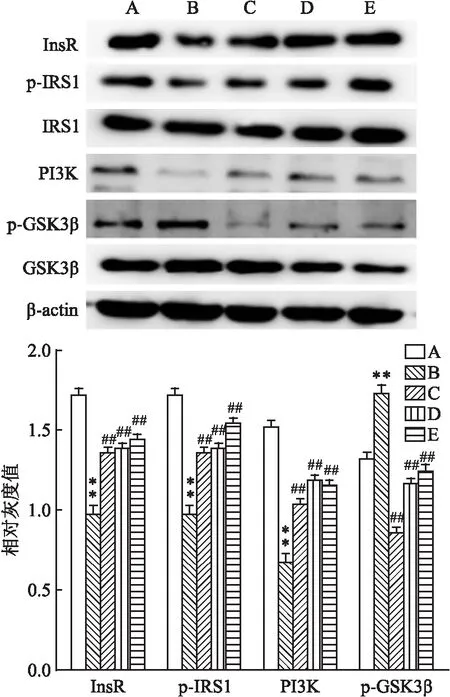
图8 格列齐特调节胰岛素抵抗HepG2细胞胰岛素信号通路(n=3)
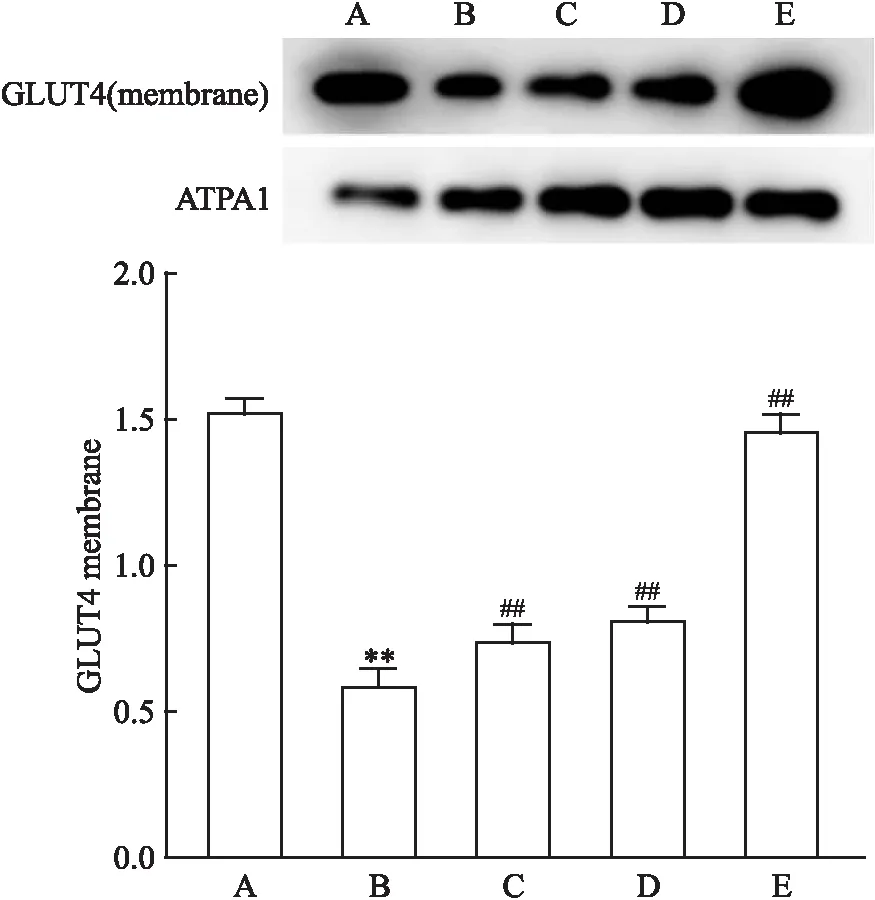
图9 格列齐特对胰岛素抵抗HepG2细胞GLUT4膜表达的影响(n=3)
前期研究发现,格列齐特可能通过促进InsR磷酸化提高胰岛素抵抗C2C12细胞的胰岛素敏感性;通过促进GLUT4膜易位改善过氧化氢诱导的胰岛素抵抗3T3L1脂肪细胞的葡萄糖摄取,这提示格列齐特可能通过恢复胰岛素信号通路的传导改善体内各组织胰岛素抵抗的水平[9-10]。但格列齐特对肝脏胰岛素信号通路的调控作用尚不清楚,故为了进一步探究格列齐特改善肝脏胰岛素抵抗的作用机制,我们检测了格列齐特对T2DM小鼠肝组织和胰岛素抵抗HepG2细胞中胰岛素信号通路相关蛋白的影响。结果表明,格列齐特可以增加T2DM小鼠肝脏和胰岛素抵抗HepG2细胞InsR和PI3K表达,促进IRS1磷酸化,抑制GSK3β磷酸化。同时,格列齐特还可以增加胰岛素抵抗HepG2细胞GLUT4膜表达。因此,格列齐特改善肝脏胰岛素抵抗的分子机制可能与上调胰岛素信号通路有关。
在本研究当中我们用高脂喂养C57BL/6小鼠4周后腹腔注射STZ诱导T2DM动物模型,该模型造模成功率高,重复性好,且成本较低,能够很好的满足我们对实验的要求。但该模型仍存在造模时间长,只能模仿糖尿病的某一方面或某些方面特点的局限性,故我们下一步将采用db/db小鼠观察格列齐特的治疗作用。此外,在本研究中,我们只探讨了格列齐特对胰岛素信号通路InsR、IRS1和PI3K的影响,胰岛素信号通路中其他关键组分有待进一步研究。
综上所述,格列齐特可以显著改善T2DM小鼠肝脏胰岛素抵抗的糖代谢和肝损伤,增加胰岛素抵抗HepG2细胞的葡萄糖消耗和糖原合成,其机制可能与上调胰岛素信号通路有关。

