普鲁卡因抑制人结肠癌细胞增殖与DNA甲基化
朱 波,解 爽,张思莹,陈 渊,胡漫辉,温聪娜,刘伟华,问 明,张 涛,刘经纬,李日恒
结肠癌是常见的消化道恶性肿瘤之一,其发病率和死亡率近年来均保持上升趋势,严重威胁人类健康[1-2]。DNA甲基化是表观遗传学分子机制之一,在结肠癌的发生、发展中发挥关键作用[3-4]。肿瘤抑制基因启动子区域CpG岛高甲基化导致其转录沉默已被认为是肿瘤发生的一个共同特征[5-6],由此通过去甲基化药物使抑癌基因重新表达为肿瘤治疗提供了新的思路和途径。普鲁卡因(procaine,PCA)作为一种新型去甲基化剂,在人乳腺癌细胞系MCF-7[7]、胃癌细胞系SGC-7901[8]中具有生长抑制的作用。然而,PCA对结肠癌细胞DNA甲基化调节以及生物学功能的影响鲜见报道,该研究以人结肠癌DLD-1、HCT116细胞作为研究对象,探讨 PCA对Septin9基因甲基化状态和表达水平的影响及其抑制细胞增殖的分子机制。
1 材料与方法
1.1 主要材料与试剂人结肠癌细胞株DLD-1购于武汉普诺赛生命科技有限公司;人结肠癌细胞株HCT116购于石家庄华沃科瑞生物科技有限公司;RPMI-1640、DMEM培养基购于美国Gibco公司;血清购于美国BI公司;MTS试剂盒购于美国Promega公司;重亚硫酸盐DNA甲基化试剂盒购于德国Qiagen公司;总RNA提取试剂盒购于美国Omega公司;逆转录、荧光定量PCR试剂盒购于日本TaKaRa公司;引物设计及合成由上海生物工程有限公司完成。
1.2 主要仪器与设备全波长酶标仪(型号:Epoch)购于美国Bio Tek公司;流式细胞仪(型号:CytoFLEX)购于美国BECKMAN公司;倒置相差显微镜(型号:ECLIPSE Ts2)购于日本Nicon公司;热循环仪(型号:Veriti)、荧光定量PCR仪(型号:7300)购于美国BioSystems公司。
1.3 实验方法
1.3.1细胞培养 结肠癌DLD-1细胞用含10%血清和1%双抗的RPMI-1640培养基于37 ℃、5% CO2的培养箱中培养。结肠癌HCT116细胞用含10%血清和1%双抗的DMEM培养基于37 ℃、5% CO2的培养箱中培养。
1.3.2MTS检测细胞增殖活力 取处于对数生长期的DLD-1、HCT116细胞,每孔按5×103个接种至96孔板,每孔体积约100 μl,培养箱内培养过夜;待细胞密度生长至70%以上,加处理因素;分别设对照组和PCA处理组,处理组药物浓度设为1.0、1.5、2.0、2.5 mmol/L 4个浓度,每组设4个复孔;在培养24、48、72 h时加入MTS液20 μl/孔,继续培养1~4 h,于酶标仪上读取490 nm吸光度值,计算细胞生长抑制率。
1.3.3形态学观察 胰蛋白酶消化并收集DLD-1、HCT116细胞,以2×105个/孔的密度接种于6孔板,培养箱内培养过夜;待细胞贴壁后分别设对照组和PCA处理组,处理组药物终浓度为2 mmol/L,继续培养48 h;倒置显微镜下观察DLD-1、HCT116细胞形态变化。
1.3.4流式细胞术检测细胞周期及凋亡 调整DLD-1、HCT116细胞密度至2×105个/孔接种于6孔板,每孔体积约4 ml,DLD-1、HCT116细胞PCA终浓度为2 mmol/L,每组设3个复孔,同时设不加药对照孔,置于培养箱内,培养48 h后收集细胞以进行染色,流式细胞仪上机检测。
1.3.5Transwell实验检测细胞迁移 无血清培养基重悬DLD-1、HCT116细胞浓度至2.5×105个/ml;在24孔板中预先加入800 μl含10%血清的培养基并放入Transwell小室,1 h后在上室分别接入200 μl细胞悬液,培养箱内培养24 h;取出小室,擦去上层细胞,PBS清洗后70%冰乙醇固定1 h;0.5%结晶紫染液染色20 min,倒置显微镜下观察拍照。
1.3.6BGS检测Septin9甲基化状态 甲基化Septin9上游引物为5’-GGATGAATAGTGGGGAATAGTATTG-3′,下游引物为5′-CAAAAAAAACCCTAAAAAATCACC-3′,扩增片段234 bp。根据制造商的说明书,用细胞DNA提取试剂盒从DLD-1、HCT116细胞中提取总DNA,用重亚硫酸盐DNA甲基化试剂盒进行DNA甲基化检测。
1.3.7qRT-PCR检测Septin9表达水平 Septin9上游引物为5′-ACTGCTGCCTCTACTTCA-3′,下游引物为5′-CTGGTGATGTCCTTGATGT-3′,扩增片段300 bp。β-actin上游引物为5′-CGGGAAATCGTGCGTGAC-3′,下游引物为5′-TGGAAGGTGGACAGCGA GG-3′,扩增片段550 bp。根据Omega试剂盒说明书,提取DLD-1、HCT116细胞总RNA,cDNA逆转录和目的片段扩增按照TaKaRa试剂盒说明书进行操作,记录Ct值进行分析。
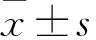
2 结果
2.1 PCA抑制DLD-1、HCT116细胞增殖MTS检测结果显示,不同时间点上,PCA处理后,DLD-1、HCT116细胞的抑制率随着PCA浓度的增加(1.0、1.5、2.0和2.5 mmol/L)呈上升趋势,高浓度(2.5 mmol/L)对细胞的增殖抑制最明显。见图1A、B。且PCA对DLD-1、HCT116细胞的生长抑制有浓度依赖性和时间依赖性。见表1、2。结果表明药物作用的最佳浓度为2.0 mmol/L,最佳时间为48 h。与此同时,倒置显微镜观察显示,DLD-1细胞生长密度下降,细胞体积缩小;HCT116细胞皱缩成团,出现空泡现象并从它们生长的表面回缩。见图1C。
图1 PCA抑制DLD-1、HCT116细胞的增殖
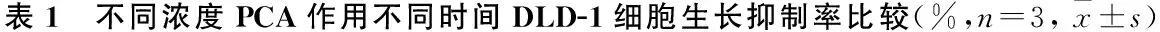
PCA浓度(mmol/L)24 h48 h72 hF/H值P值1.010.80±1.3216.27±1.19▼20.90±1.35▼▲45.978<0.0011.515.63±1.02*22.53±1.59▼30.97±1.46▼▲92.953<0.0012.021.03±2.34*#42.57±5.65▼*#52.13±9.31▼*#18.3930.0032.527.37±3.46*#&44.87±4.35▼*#60.67±7.34▼▲*#29.4620.001F/H值30.12744.72728.099P值<0.001 < 0.001 < 0.001
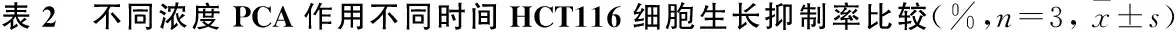
PCA浓度 (mmol/L)24 h48 h72 hF/H值P值1.08.73±0.8119.00±1.49▼25.90±1.35▼▲142.180<0.0011.514.63±1.12*20.97±1.81▼30.17±1.45▼▲82.689<0.0012.021.97±2.08*#41.53±4.01▼*#55.73±7.28▼▲*#35.2740.0012.528.50±1.75*#&47.83±1.29▼*#&60.90±9.59▼▲*#24.7270.001F/H值95.634108.80225.241P值<0.001<0.001<0.001
2.2 PCA阻滞DLD-1、HCT116细胞于G2/M期流式细胞仪检测结果显示,PCA处理后,DLD-1细胞S期细胞比例(37.81±3.36)%和G2/M期细胞比例(26.89±3.98)%高于对照组S期细胞比例(33.29±4.52)%和G2/M期细胞比例(17.94±3.00)%;HCT116细胞G2/M期细胞比例(43.64±7.53)%高于对照组G2/M期细胞比例(28.92±4.68)%;两者处理前后比较,G2/M期细胞比例差异均有统计学意义(P<0.05)。见图2。
2.3 PCA促进DLD-1、HCT116细胞凋亡流式细胞仪检测结果显示,PCA处理后,DLD-1细胞总凋亡率为(11.15±0.64)%,明显高于对照组(4.32±0.07)%;HCT116细胞总凋亡率为(11.93±1.16)%,明显高于对照组(4.65±1.30)%;两者处理前后比较,总凋亡率差异均有统计学意义(P<0.05)。见图3。
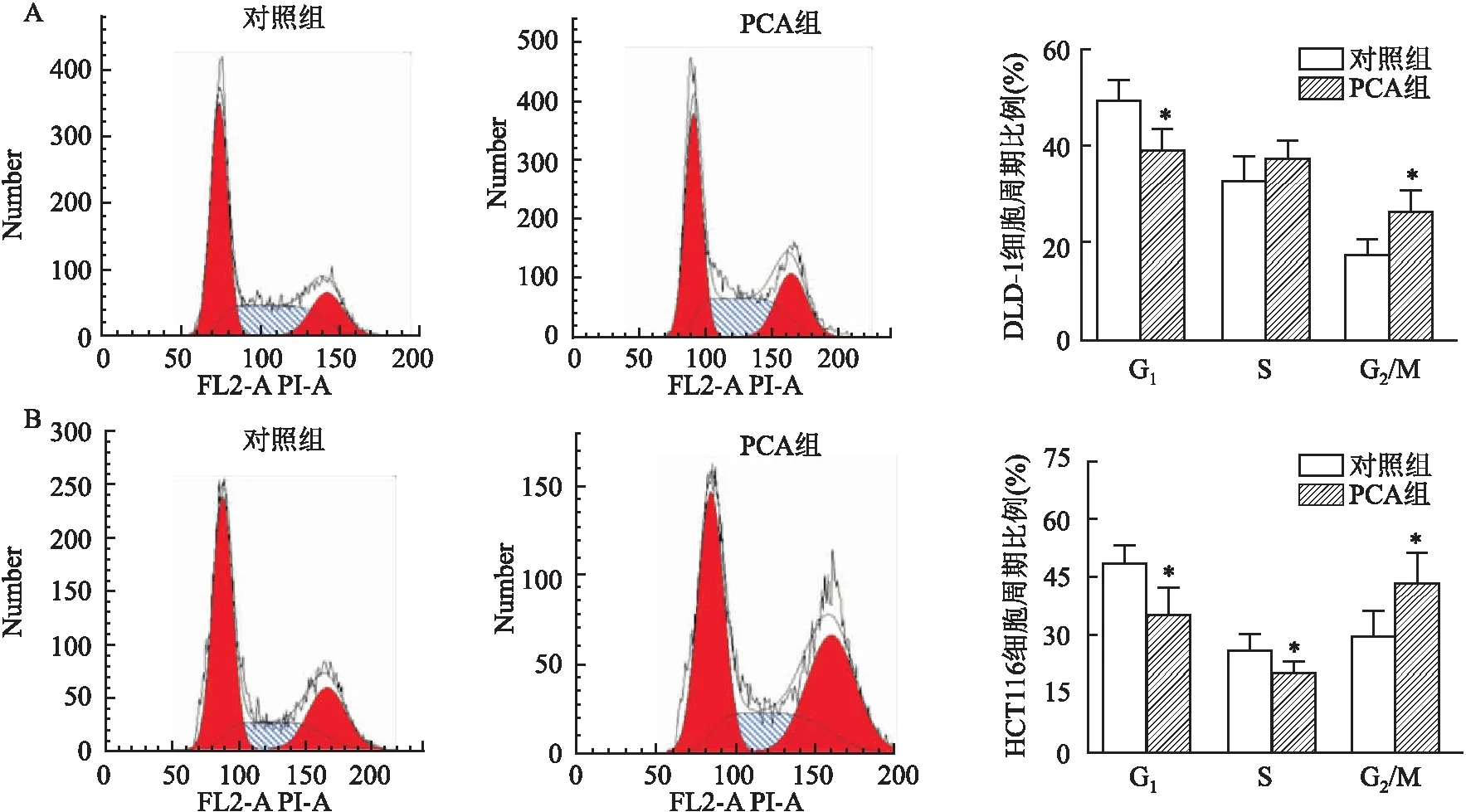
图2 PCA处理前后DLD-1、HCT116细胞周期A:DLD-1细胞;B:HCT116细胞;与对照组比较:*P<0.05
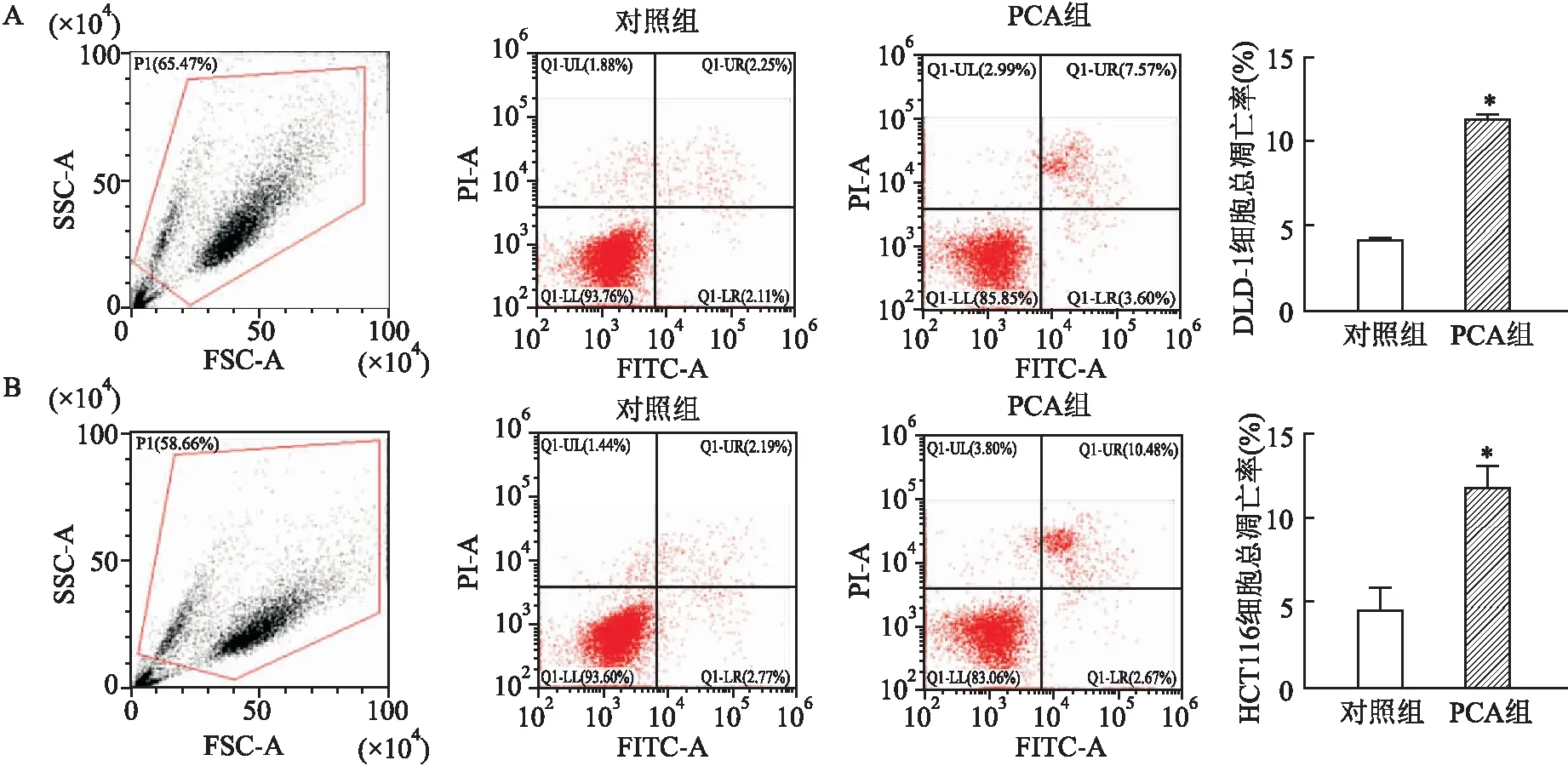
图3 PCA处理前后DLD-1、HCT116细胞凋亡率A:DLD-1细胞;B:HCT116细胞;与对照组比较:*P<0.05
2.4 PCA抑制DLD-1、HCT116细胞迁移结晶紫染色结果显示,PCA处理前后,DLD-1细胞跨膜数分别为(34.00±7.55)、(16.60±5.24)个;HCT116细胞跨膜数分别为(34.33±7.77)、(13.53±5.64)个;两者处理前后比较差异均有统计学意义(P<0.05)。见图4。
2.5 PCA逆转Septin9高甲基化状态亚硫酸氢钠测序结果显示,PCA作用于DLD-1、HCT116细胞后,Septin9启动子区域CpG位点甲基化平均水平分别为(45.20±2.48)%、(48.63±1.24)%,均低于对照组(63.50±2.76)%、(68.24±2.34)%,两者比较差异均有统计学意义(P<0.05)。见图5。
2.6 PCA上调Septin9表达水平qRT-PCR检测结果显示,PCA处理后,DLD-1细胞Septin9 mRNA相对表达量为(6.43±0.54),明显高于对照组(1.00±0.19);HCT116细胞Septin9 mRNA相对表达量为(8.60±1.00),明显高于对照组(1.00±0.17)。两者比较差异均有统计学意义(P<0.05)。见图6。
3 讨论
结肠癌的发生是一个多因素、多阶段的复杂过程,涉及一系列经典遗传学和表观遗传学事件的积累。根据KNUDSON提出经典的肿瘤发生的“二次打击理论”,表观遗传异常改变在结肠癌发生过程中发挥着更重要的作用。Septin9是抑癌基因家族成员之一,其高甲基化会导致自身表达异常,从而失去正常的抑癌作用。研究[9]表明Septin9基因高甲基化及转录缺失见于多种肿瘤。
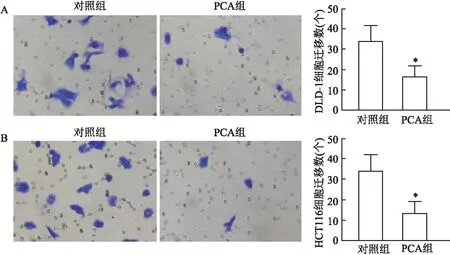
图4 PCA处理前后DLD-1、HCT116细胞迁移 × 200 A:DLD-1细胞;B:HCT116细胞;与对照组比较:*P<0.05
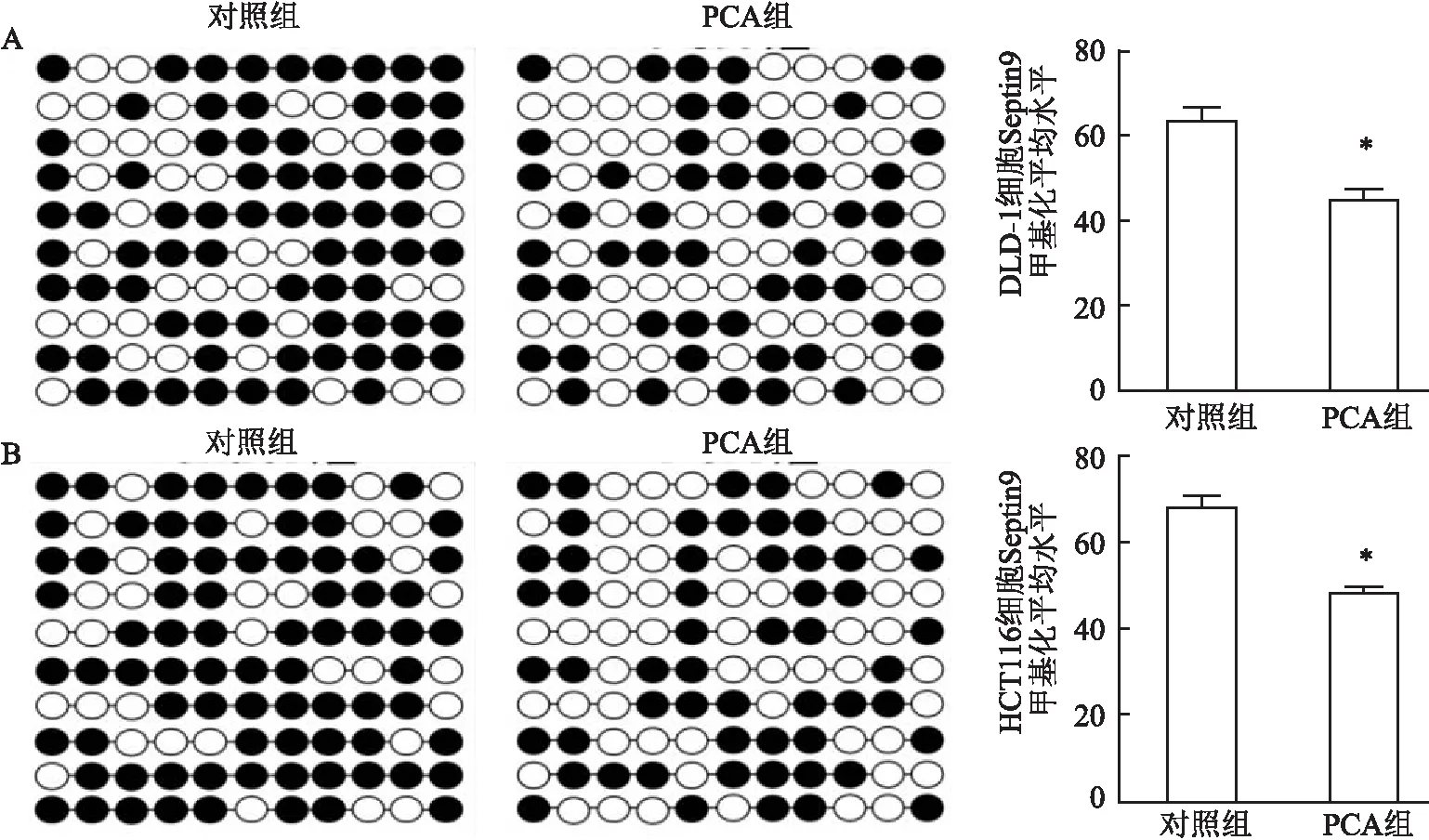
图5 PCA处理前后DLD-1、HCT116细胞Septin9甲基化状态
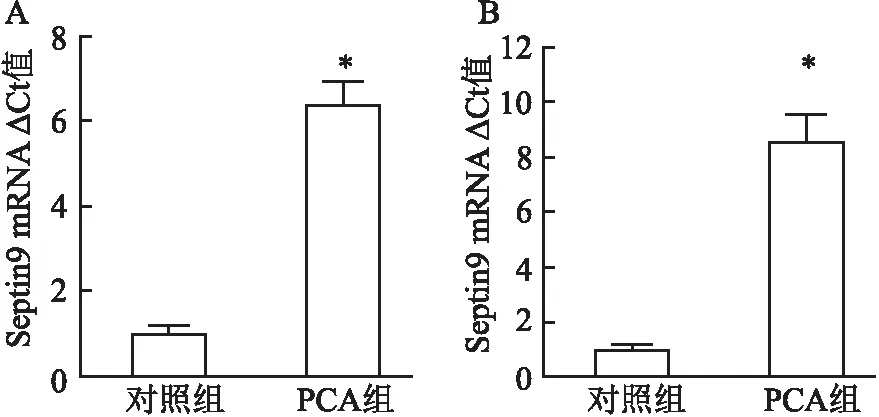
图6 PCA处理前后DLD-1、HCT116细胞Septin9 mRNA表达量
DNA甲基化是指在DNA甲基转移酶(DNA methyltransferases,DNMTs)催化下,以S-腺苷甲硫氨酸(SAM)为甲基供体,将甲基转移到胞嘧啶的5位碳原子上。由于DNA甲基化不同于经典遗传学改变,具有可逆性的特点,因此可以应用DNMTs抑制剂逆转DNA甲基化,使得抑癌基因重新被激活,发挥抑制肿瘤生长的作用,这对于肿瘤治疗来说是十分有意义的[10]。PCA是临床常用的局部麻醉药物,也是常见的非核苷类DNMTs抑制剂之一,能够逆转多种实体肿瘤的恶性生物学行为。Xuan et al[7]研究发现PCA对人乳腺癌细胞具有生长抑制作用,其对乳腺癌细胞DNA甲基化的抑制作用是通过抑癌基因的活化发挥的。Li et al[8]在对人胃癌SGC-7901细胞的研究中发现,PCA可以通过上调抑癌基因CDKN2A和RARβ的表达来抑制胃癌细胞的增殖并且促进其凋亡。方洁 等[11]通过对人膀胱癌T24细胞的研究发现,PCA可以抑制膀胱癌细胞的增殖,诱导其凋亡,将肿瘤细胞阻滞于G0/G1期。Ying et al[12]通过研究发现PCA能抑制人骨肉瘤MG63细胞增殖和迁移,同时通过上调肿瘤抑制基因MiR-133b促进骨肉瘤细胞的凋亡。在非小细胞肺癌A549、NCI-H1975细胞株和其他的一些肿瘤模型中,PCA也表现出了潜在的治疗作用[13]。本研究发现,PCA抑制结肠癌DLD-1、HCT116细胞的增殖和迁移能力,并且对其生长抑制有浓度依赖和时间依赖效应;PCA能显著诱导结肠癌DLD-1、HCT116细胞凋亡,并且主要将细胞阻滞在G2/M期。未经PCA处理的结肠癌DLD-1、HCT116细胞,其Septin9基因 5’端启动子区域CpG岛出现不同程度的甲基化,而使用去甲基化药物PCA处理后,Septin9基因的甲基化程度明显下降。进一步通过qRT-PCR检测Septin9基因的表达水平,结果显示,PCA处理后Septin9 mRNA的表达量明显增加。以上结果表明,PCA能够通过逆转Septin9甲基化,上调其表达水平,从而抑制结肠癌DLD-1、HCT116细胞的增殖。
目前已报道的DNMTs抑制剂主要分为核苷类抑制剂和非核苷类抑制剂。地西他滨在几种核苷类抑制剂中具有最强的去甲基化作用,并且被用于初治及难治复发MDS等恶性血液病患者的治疗[14],但由于常导致患者出现严重的胃肠道反应和表现出骨髓毒性而限制了其广泛的临床应用[15]。可能是由于核苷类抑制剂通过在DNA复制过程中掺入新合成的DNA分子发挥作用。而非核苷类抑制剂PCA由于其毒副作用小、价格便宜、特异性强等优点,具有更广阔的临床应用前景,未来有望成为基于表观遗传学结肠癌治疗的安全候选药物。

