直肠癌前切除术术后吻合口漏危险因素分析及列线图预测模型构建
周 波,鲁明典,邓跃华,曹先东,常家聪,刘 弋
吻合口漏是直肠癌前切除术术后常见的严重并发症,也是一直困扰胃肠外科医生的棘手难题[1-2]。尽管吻合器械和吻合技术取得了长足的进步,直肠癌患者手术后吻合口漏的发生比例并没有降低。相反,技术进步使得低位/超低位吻合成为可能,由此带来术后吻合口漏的发生风险也较前有所增加。吻合口漏不仅可引起腹腔感染需再次手术干预,甚至导致排便功能障碍和局部复发进而影响患者的远期生存效果[3]。因此构建一个简单有效的风险预测模型用于准确识别高风险人群和制定围手术期吻合口漏的预防与控制方案就显得尤为重要。该研究回顾性分析直肠癌前切除手术患者的临床病理资料,分析和探讨术后吻合口漏发生的独立危险因素,并以此构建术后吻合口漏的风险预测模型,为围手术期处理及手术方式的选择提供证据支持。
1 材料与方法
1.1 病例资料采用病例对照研究方法,回顾性收集2018年1月~2019年12月安徽医科大学第一附属医院普外科出院的所有直肠癌手术患者的临床、病理和手术资料。纳入标准: ① 术后病理确诊为直肠癌;② 接受直肠前切除术或保肛手术。排除标准:行经腹/腹腔镜会阴联合直肠癌根治术、经腹/腹腔镜直肠癌切除和结肠造口术、经肛直肠肿瘤局部切除术等无肠道吻合口患者。研究经安徽医科大学第一附属医院伦理委员会批准,患者均知情同意。
1.2 手术方式所有手术操作均按照全直肠系膜切除(total mesorectal excision,TME)原则,使用双吻合器法切断直肠和行直肠和近端结肠的端端吻合。常规进行充气实验,确认吻合口完整。留置盆腔或骶前引流管。依据术者经验和个人习惯、患者状况以及术中具体情况,决定是否行预防性造口、吻合口加强或留置肛管等。
1.3 研究方法收集直肠癌行前切除手术(AR或Dixon手术)患者的临床病理资料,包括年龄、性别、体质指数(body mass index,BMI)、术前新辅助治疗、高血压病史、糖尿病病史、吸烟史、麻醉风险评分表(ASA)、肿瘤大小、肿瘤距肛缘距离、TNM分期、手术方式、是否行预防性造口等指标。肿瘤的TNM分期根据美国癌症联合会(AJCC)制定的结直肠癌TNM分期(第8版)标准确定。主要研究终点为直肠癌术后30 d吻合口漏是否发生。直肠癌术后吻合口漏的诊断主要依据国际直肠癌研究小组(ISREC)的共识和中国直肠癌手术吻合口漏诊断、预防及处理专家共识(2019 版),包括:①引流管见到粪便样液体;②吻合口周围脓肿[4-5]。ISREC将直肠癌术后吻合口漏分为3级。A级:亚临床吻合口漏/影像学吻合口漏,不需特殊治疗;B级:有临床表现如腹痛、发热,引流管引流出粪便样液体,需要保守治疗的吻合口漏;C级:需要二次手术治疗的吻合口漏。
2 结果
2.1 术后吻合口漏危险因素的单因素和多因素分析符合纳入标准的患者共326例,其中男性193例,女性133例,年龄32~84(61.26±10.71)岁,术后30 d发生吻合口漏有41例,发生率为12.58%,发生于术后6(4.5~9)d,其中A级漏1例, B级漏28例, C级漏12例。
对纳入患者的临床病理特征进行单因素分析,结果显示不同性别、BMI、肿瘤大小、肿瘤距肛缘距离、肿瘤T分期和肿瘤M分期,患得术后发生吻合口漏的比例差异有统计学意义(P<0.05);而在年龄、糖尿病、高血压、吸烟、术前放化疗、ASA评分、肿瘤N分期、手术时间、手术方式(腔镜/开放)和预防性造口上的差异无统计学意义(P>0.05),见表1。多因素Logistic分析结果显示男性、超重或肥胖、肿瘤M1分期和肿瘤距肛缘距离≤7 cm是直肠癌前切除术术后发生吻合口漏的独立危险因素(P<0.05),表2。
2.2 列线图预测模型的构建根据多因素Logistic回归分析结果,构建了直肠癌前切除术术后吻合口漏发生风险的列线图预测模型,见图1。首先对每个独立危险因素分别进行评分,分别为86.6分(男性)、95.0分(BMI≥24 kg/m2)、75.4分(肿瘤距肛缘距离≤7 cm)、100.0分(肿瘤M1分期)。其次,将各个单项分数进行相加得到总分,总分所对应的吻合口漏发生风险的值即为模型预测该患者术后吻合口漏的发生概率。
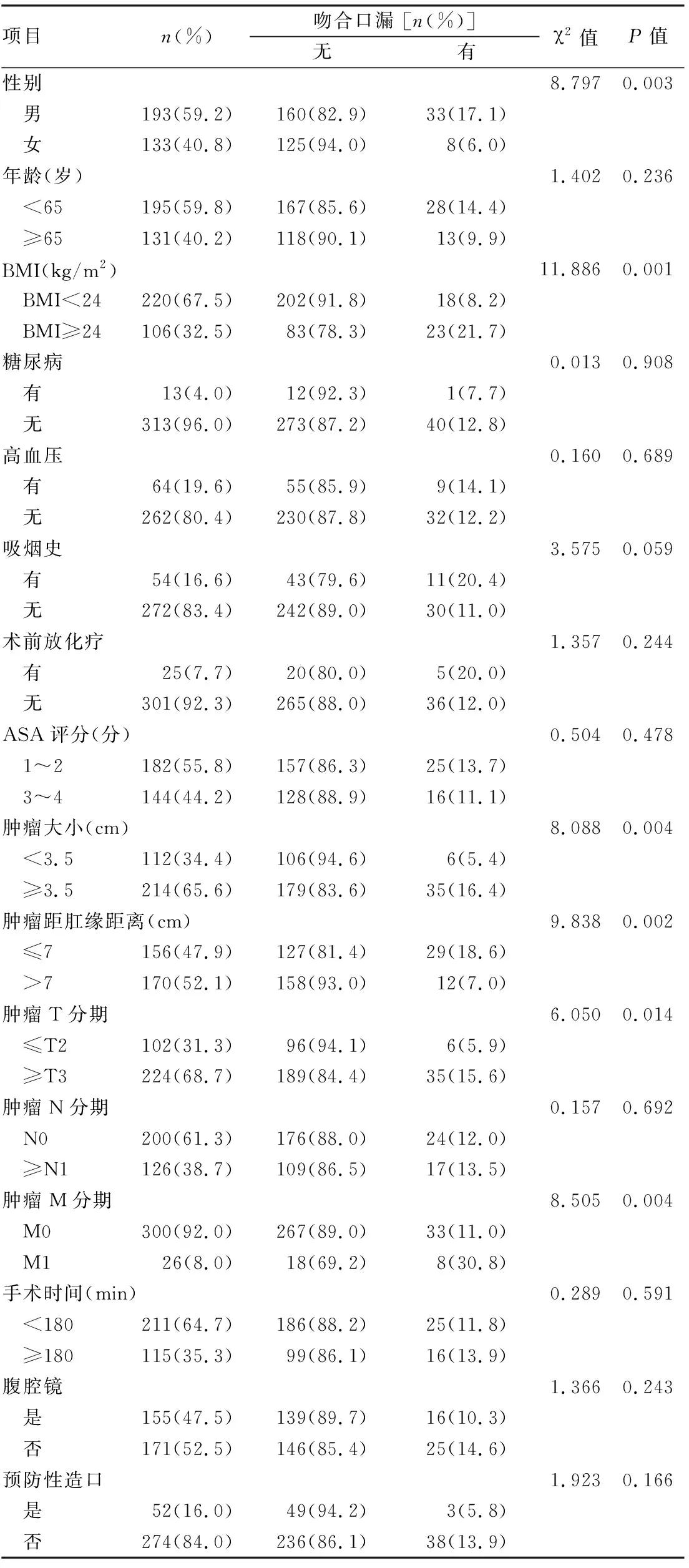
表1 326例直肠癌术后发生吻合口漏的单因素分析

表2 直肠癌术后吻合口瘘发生的多因素Logistic回归分析
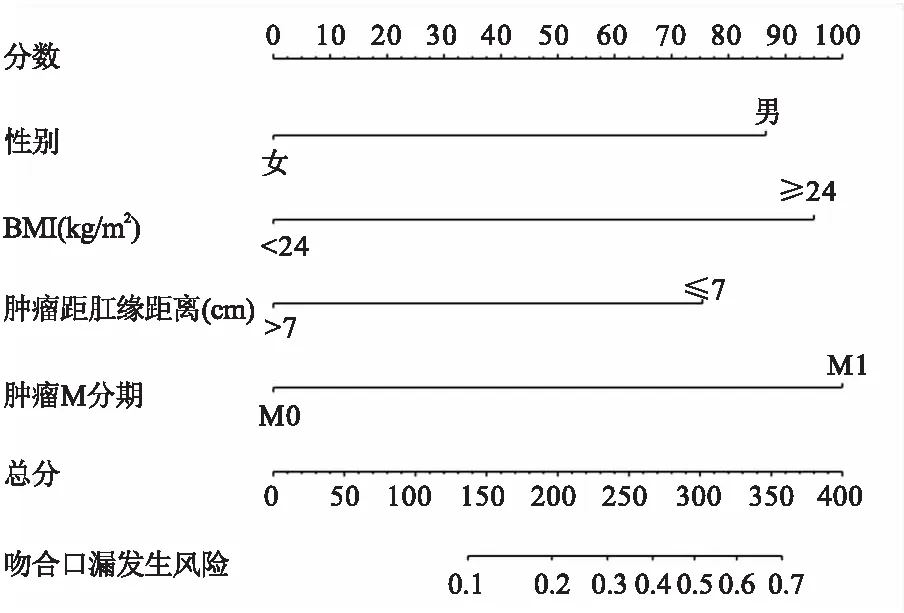
图1 直肠癌术后吻合口漏预测模型的列线图
2.3 列线图预测模型的评价应用Bootstrap自抽样法对上述模型进行内部验证,重复抽样1 000次,计算的C-index值为0.755,意味着该预测模型具有较好的区分度。该模型的校准曲线显示该列线图模型的直肠癌术后吻合口漏的预测发生概率和实际发生概率之间具有较好的一致性,见图2。用Hosmer-Lemeshow检验评价模型的拟合优度,结果显示P=0.468,说明该列线图模型对预测结果的拟合程度良好。通过绘制受试者ROC曲线,结果显示列线图预测模型ROC曲线下面积(AUC)为0.773(95%CI:0.712~0.844),具有较高的预测价值。见图3。
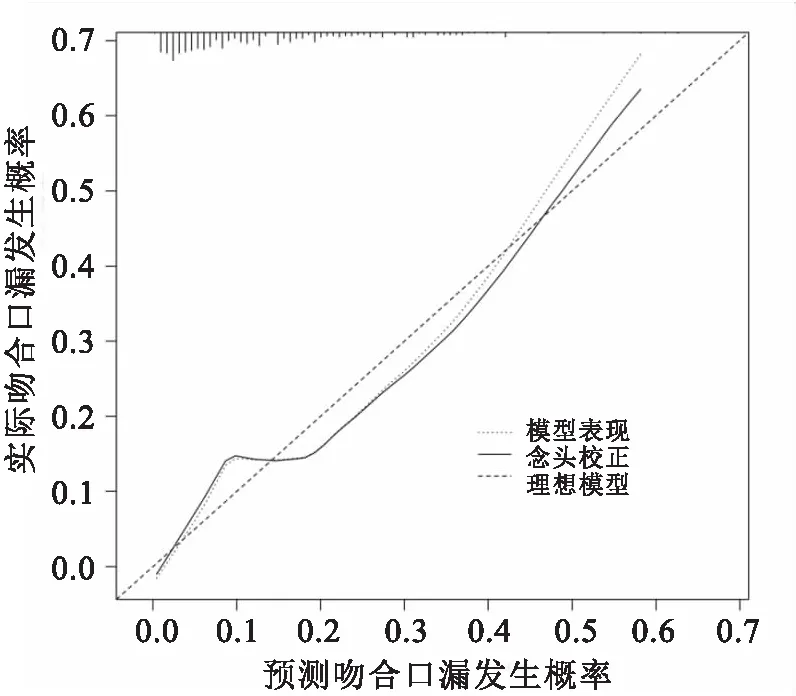
图2 列线图预测模型的校准曲线
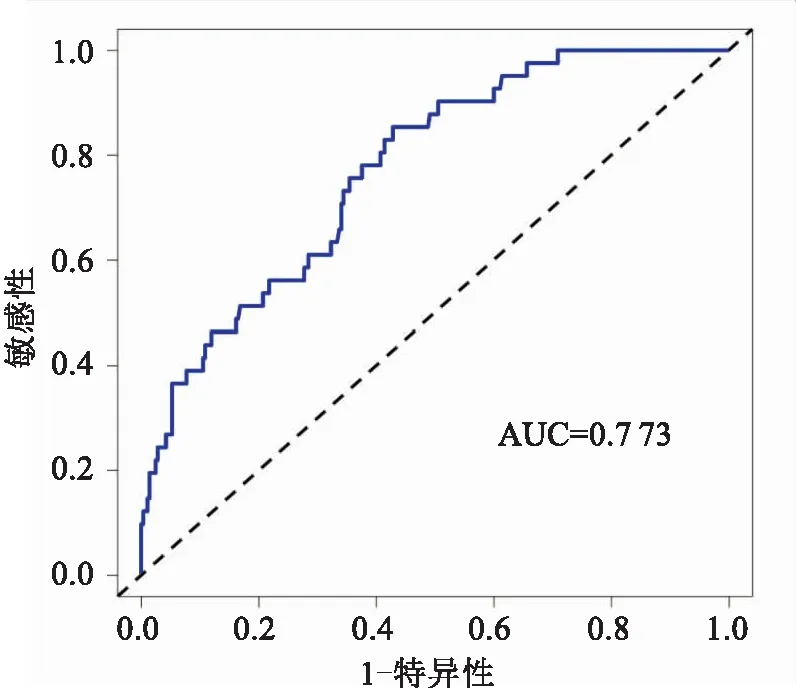
图3 列线图模型预测直肠癌术后吻合口漏的ROC曲线
3 讨论
近年来,随着TME手术的推广、术前新辅助治疗策略的实施和“双吻合技术”的出现,直肠癌行直肠前切除和低位或超低位吻合手术的患者越来越多。然而吻合口漏发生率并未随技术进步和发病机制的认识深化而显著降低,术后吻合口漏患者在增加。吻合口漏是直肠癌前切除术术后的严重并发症,一旦发生,会延长患者住院时间,增加非计划再次手术的可能性,推迟术后辅助治疗开始时间,甚至导致肿瘤局部复发而影响患者生存时间。因此,直肠癌术后吻合口漏仍然是胃肠外科领域的热点和难点[6]。2019年,中华医学会外科学分会结直肠外科学组制定专家共识以指导直肠癌术后吻合口漏的预防、诊断和治疗[5]。
该研究回顾性分析了近2年收治的直肠癌行前切除手术患者的临床病理资料,研究表明术后30 d吻合口漏发生率为12.58%,与文献报道基本一致,文献报道吻合口漏发生率波动在6%~30%之间,主要取决于吻合口漏的诊断标准和随访时间的长短[7]。ISREC对直肠吻合口漏定义为吻合口的缺损导致肠腔内外的异常交通,紧靠吻合口处的脓肿也应被认为是吻合口漏[4]。如果肠腔内容物通过引流管或切口与外界相通,亦或通过手术探查发现异常相通,一般均能确诊,病历资料也会准确记录。部分研究往往容易遗漏症状轻微、未与外界相通的吻合口漏,因为这类患者很可能未进一步通过影像学或内镜检查明确诊断。Olsen et al[8]回顾性分析341例直肠前切除手术患者,发现37例患者是直接吻合口漏,13例患者吻合口周围脓肿被确定为吻合口漏,占吻合口漏总人数的1/4。此外部分研究仅统计围手术期吻合口漏,没有关注再次入院情况,容易遗漏迟发性吻合口漏。Shogan et al[9]的研究显示42%的吻合口漏确诊于出院后。
如何预测和预防术后吻合口漏的发生仍然是目前亟待解决的临床难题[6],而准确识别吻合口漏的危险因素和构建个体化预测模型又是其中的关键[10]。目前已有多项研究分析不同术式患者的临床病理资料,总结得出常见的危险因素,包括男性、吸烟、肥胖、ASA评分高、肿瘤较大和分期较晚等。该研究表明直肠癌中男性患者相较于女性患者术后更易发生吻合口漏。Katsuno et al[11]总结了1 014 例直肠癌行前切除手术患者的临床病理资料,回顾性分析发现男性为术后吻合口漏的独立危险因素。Penna et al[10]回顾性分析了1 594例经肛TME手术病例资料,结果显示男性也是经肛TME手术后吻合口漏发生的独立危险因素。原因可能是相较于女性,男性骨盆相对更狭小,从而使手术操作难度较大;其次,可能与男性患者雄激素水平高有关。超重和肥胖均使盆腔操作空间变小,手术难度增大,增加术后吻合口漏的发生[5]。本研究表明肿瘤距肛缘之间的距离是直肠癌前切除术后吻合口瘘的独立危险因素,与文献[12]报道一致。肿瘤位置越低,吻合的难度愈大,需要游离更多的肠管才能保证无张力吻合;吻合口越低,术后肠腔内压力越大,越容易发生吻合口漏。有研究[13]报道肿瘤距肛缘<5 cm的术后吻合口漏的发生风险增加8倍。此外肿瘤分期也是吻合口漏发生率增加的危险因素[14],该研究提示肿瘤M分期是直肠癌术后吻合口漏的独立危险因素。
直肠癌术后吻合口漏一旦发生,轻者延长住院时间、增加住院费用,重者需非计划再次手术或增加肿瘤复发而影响近期和远期生存。因此,建立一个直观有效的列线图模型用于预测吻合口漏发生的风险,对直肠癌手术患者围手术期的管理和术式选择具有重要的指导意义。本研究基于单因素分析和多因素Logistic回归分析结果,建立了预测直肠癌术后吻合口漏发生风险的列线图模型。经过内部验证,该模型得出的预测值与实际观察值符合度良好。通过ROC曲线证明模型具有较高的诊断价值。本研究所构建的列线图预测模型将复杂抽象的回归方程进行可视化处理,使得在临床工作中对患者进行个体化评估更直观方便,并且可以在术前量化患者术后吻合口漏的发生概率,为围手术期治疗或手术方案的制定(如需不需要行预防性造口或留置肛管等)提供帮助。需要注意的是本模型是建立在单中心病例资料基础上的回顾性分析,病例数有限,可能会影响列线图的预测准确性,有待进一步的多中心、大样本前瞻性临床研究对该模型进行证实和完善。
综上所述,本研究对近2年本中心所有直肠癌患者临床病理资料的进行回顾性分析表明男性、BMI≥24 kg/m2、肿瘤M1分期和肿瘤距肛缘距离≤7 cm是直肠癌术后吻合口漏发生的独立危险因素,并以此构建的列线图模型可以较准确地预测直肠癌前切除术术后吻合口漏的发生概率,这可为外科医生手术方式的选择和围手术期吻合口漏的预防和治疗提供参考。

