男性脂肪性肝病患者肠道机械屏障功能变化的研究
费欢欢,张 宝,管石侠,侯丽丽,程 靖,杨 乐,蒋建华
脂肪性肝病(fatty liver disease,FLD)在临床上根据有无长期过量饮酒分为非酒精性脂肪性肝病(nonalcoholic fatty liver disease,NAFLD)和酒精性脂肪性肝病(alcoholic fatty liver disease, AFLD)。肠黏膜机械屏障可以防止二胺氧化酶(diamine oxidase,DAO)和D-乳酸(D-lactic acid,D-LA)渗入门管区,血中DAO与D-LA升高,是肠壁通透性增加的指标[1]。因此我们推测检测DAO和D-LA能够反映FLD肠道机械屏障的完整性和损伤程度。同时肠道通透性增加可触发免疫反应,产生白细胞介素1(interleukin-1,IL-1)、白细胞介素6(interleukin-6,IL-6)、肿瘤坏死因子-α(tumor necrosis factor-α,TNF-α)等促炎细胞因子,引起肝损伤[2]。
延华 等[3]研究发现男性饮酒率高于女性。为排除性别因素,选取研究对象均为男性,该研究通过检测男性FLD患者血清DAO、D-LA水平以及炎症状况指标,探讨男性FLD患者肠道机械屏障功能变化。
1 材料与方法
1.1 病例资料选择2019年3~8月在安徽医科大学第一附属医院体检中心体检的男性213例,符合NAFLD诊断标准的91例男性NAFLD患者为NAFLD组,40例男性AFLD患者为AFLD组,以同一时期体检正常者82例男性作为对照组。NAFLD人群均符合中华医学会肝脏病学分会2010年修订的《非酒精性脂肪性肝病诊断标准》。入院对象需排除病毒性肝炎、肝硬化、严重心脑肾疾病、急性炎症、肿瘤、长期服药史及不愿意接受随访者。其中对照组82例,年龄22~62岁,中位年龄37岁;NAFLD组91例,年龄21~77岁,中位年龄38岁;AFLD组40例,年龄22~56岁,中位年龄41岁。各组均为男性,且在年龄比例方面差异无统计学意义,各组间均衡性好,具有可比性。
1.2 方法
1.2.1问卷调查 采用自行设计的健康状况调查表对研究对象进行面对面调查,内容包括一般信息、饮酒情况、既往史等,由调查员填写问卷。
1.2.2一般指标检测 研究对象在清晨空腹进行体格检查,由经过培训的工作人员测量身高、体质量、体质指数(body mass index,BMI)。
1.2.3血液指标检测 所有研究对象采集清晨空腹外周静脉血,分离出血清。① 血液生化检查:采用Roche公司日立7600型生化仪测定谷氨酸氨基转移酶(alanine transaminase,ALT)、天冬氨酸氨基转移酶(aspartate aminotransferase,AST)、总胆固醇(total cholesterol,TC)、三酰甘油(triglycerides,TG)、高密度脂蛋白胆固醇(high density lipoprotein cholesterol,HDL-C)、极低密度脂蛋白胆固醇(very low density lipoprotein cholesterol,VLDL-C)、C-反应蛋白(C-reactive protein,CRP)。②使用ELISA试剂盒(武汉伊莱瑞特生物科技股份有限公司)测定血清DAO、D-LA、TNF-α、白细胞介素1β(interleukin-1β,IL-1β)、IL-6,严格按照说明书操作,用酶标仪在450 nm波长下读取各孔吸光度值(OD值),并根据绘制的标准曲线计算出相应的浓度。
1.3 统计学处理采用SPSS16.0统计软件进行分析,计量资料不符合正态分布采用中位数(四分位数间距)表示;多组间计量资料比较采用Kruskal-Wallis H法,组间两两比较采用Bonferroni法;相关分析采用Spearman秩相关分析;以P<0.05为差异有统计学意义。
2 结果
2.1 3组人群基本指标比较各组在年龄比例方面差异无统计学意义,比较3组人群BMI有差异,3组间两两比较,NAFLD组、AFLD组BMI均高于对照组,差异有统计学意义(P<0.05)。见表1。
2.2 3组人群肝功能及血脂比较3组人群中ALT、AST、TC、TG、HDL-C、VLDL-C有差别,3组间两两比较,NAFLD组和AFLD组ALT、AST、TG、VLDL-C均高于对照组,其中AFLD组TC高于对照组,NAFLD组和AFLD组HDL-C低于对照组,差异有统计学意义(P<0.05)。见表2。
2.3 肠道通透性指标的比较血清DAO和D-LA浓度在3组人群中有差别,3组间两两比较,NAFLD组和AFLD组血清DAO浓度均高于对照组,NAFLD组血清D-LA浓度高于对照组,差异有统计学意义(P<0.05),NAFLD组与AFLD组差异无统计学意义。见表3。
2.4 炎症指标的比较血清TNF-α、IL-6、CRP浓度在3组人群中有差别,3组间两两比较,NAFLD组和AFLD组血清TNF-α、IL-6、CRP水平均高于对照组,且AFLD组中TNF-α、CRP水平高于NAFLD组,差异有统计学意义(P<0.05),血清IL-1β浓度在3组人群中差异无统计学意义。见表4。

表1 3组研究对象基本指标比较[M(P25,P75)]
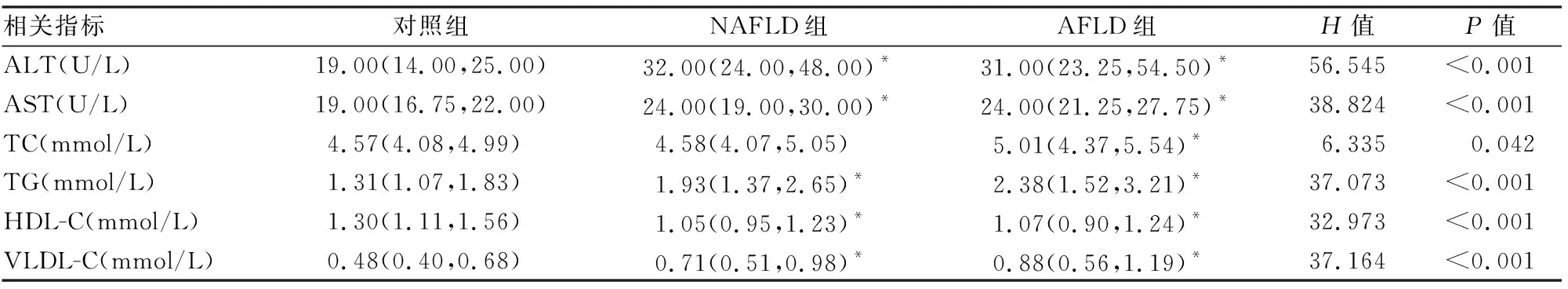
表2 3组研究对象肝功能及血脂比较[M(P25,P75)]

表3 3组研究对象血清DAO、D-LA浓度比较[M(P25,P75)]

表4 3组研究对象血清TNF-α、IL-6、CRP、IL-1β水平比较[M(P25,P75)]
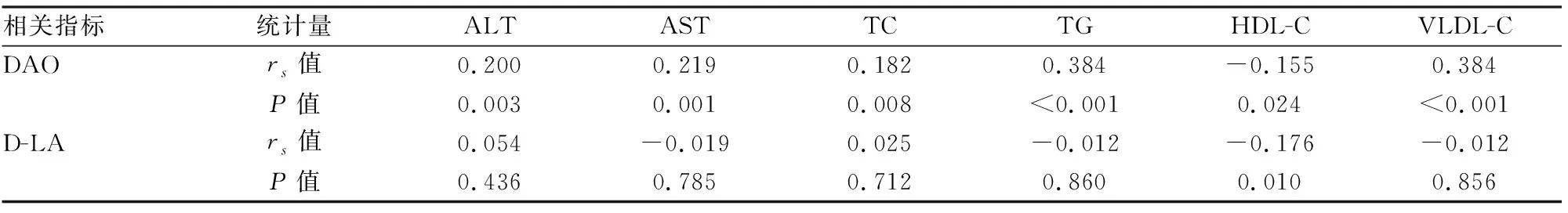
表5 肠道通透性指标与肝功酶学及血脂的相关性分析
2.5 相关性分析
2.5.1肠道通透性指标与肝功酶学及血脂的相关性分析 结果提示血清DAO与ALT、AST、TC、TG、VLDL-C呈正相关(rs>0,P<0.05),血清DAO及D-LA与HDL-C呈负相关(rs<0,P<0.05)。见表5。
2.5.2炎症指标与血清DAO的相关性分析 血清TNF-α、IL-1β、IL-6与DAO呈正相关(rs=0.182 0、rs=0.140 1、rs=0.229 8,P=0.007 9、P=0.041 5、P=0.000 7), CRP与血清DAO无相关性(rs=0.043,P=0.531)。
3 讨论
本研究结果显示NAFLD组和AFLD组BMI、TG、VLDL-C、ALT、AST水平高于对照组,HDL-C水平低于对照组,提示FLD患者肥胖程度、转氨酶及血脂水平高于对照组,与临床研究[4]结果一致。同样有研究[5]表明肥胖及血脂代谢紊乱为FLD发病的主要危险因素。VLDL-C主要由肝脏合成,可以运输内源合成的TG。当肝内TG合成总量超过了自身合成VLDL-C的能力,便出现TG的堆积[6],进而导致肝功能异常。当患者脂质水平较高时,脂肪在肝内淤积,诱发FLD,肝功能损伤后则会进一步影响脂质代谢,进而升高血脂水平[6-7]。胰岛素抵抗、氧化应激、炎症反应是导致NAFLD的因素,其炎症反应激活非特异性免疫系统、脂肪细胞和内皮细胞,然后产生大量的细胞因子,主要包括IL-1、IL-6、TNF-α[8]。同时肝细胞会产生CRP加重促炎环境,并进一步驱动肝脏损伤[9]。此次研究结果显示NAFLD与AFLD患者血清TNF-α、IL-6、CRP水平升高,且AFLD组中TNF-α、CRP浓度高于NAFLD组,提示FLD患者体内炎症水平较高,且AFLD患者体内炎症水平可能更高,此与肠道屏障功能损伤有关。但血清IL-1β水平在三组人群中差异无统计学意义,推测可能在早期脂肪变性中IL-1β水平变化不明显,且IL-1β分泌是发生在分离的肝细胞中,而本研究对象为人群,并没有分离出肝细胞,故而差异无统计学意义。
Damms-Machado et al[10]证实了脂肪变性和肠道通透性之间的联系,提示脂肪变性患者肠道通透性增加。张媛媛 等[11]在非酒精性脂肪性肝炎小鼠模型肠黏膜屏障变化研究结果显示,从非酒精性单纯性脂肪肝(nonalcoholic simple fatty liver,NAFL)到非酒精性脂肪性肝炎(nonalcoholic steatohepatitis,NASH),肠道上皮黏膜屏障功能逐渐受损,并且其受损程度与肝脏炎症程度呈正相关。本研究中NAFLD组与AFLD组患者血清DAO水平均高于对照组,但AFLD组与对照组的血清D-LA水平差异无统计学意义,推测原因为AFLD组样本量较少,而D-LA作为肠道缺血时的生物标志物,可能收集的样本中尚未出现明显的肠道缺血,故而差异无统计学意义,但血清DAO水平高于对照组,仍提示AFLD患者肠道通透性增加。在相关性分析中,血清DAO与ALT、AST、TC、TG、VLDL-C呈正相关,血清DAO及D-LA与HDL-C呈负相关,提示肝脏损伤程度越重、血脂越高,肠道通透性越高,且血清TNF-α、IL-6、IL-1β与DAO呈正相关,此与上述文献报道一致,提示FLD患者肠道通透性增加,而肠道通透性增加后导致体内炎症因子升高,且肠道屏障损伤程度与炎症因子水平呈正比例,进一步提示我们在临床中需重视肠道功能变化。同时相关性分析中显示CRP与DAO无相关性,考虑可能CRP在急性炎症或感染时,与疾病有很好的相关性,但在慢性疾病中,相关性可能不足。
综上所述,FLD患者可引发肠道屏障功能障碍,导致肠道通透性增高,继发炎症反应,且因“肠-肝轴”作用,肠黏膜通透性增加后肠道内毒素入血增多而诱发肝脏炎症。通过血清DAO与D-LA浓度及炎症指标水平的变化,可以从侧面反映FLD患者肝损伤的程度,对判断FLD患者进展有一定价值,FLD患者可通过检测肠道屏障功能反映肠道情况,转氨酶升高时可适当予以改善肠道功能治疗,且HDL-C值与肠道屏障检测值呈负相关,提示HDL-C水平可能间接反映肠道通透性情况,但具体机制不明,有待进一步研究明确。

