MTAN对种植体周围炎致病菌及生物膜抑制作用的体外研究
周 琳,杨 慧,吴梦楠,蔡文静,郑营雪
种植技术现已广泛应用于牙列缺损和牙列缺失的修复,由于其不伤邻牙、支持固位作用好、异物感小的优点,逐步替代了固定桥修复及活动修复技术。种植体周围炎可引起种植体周围软组织的炎症反应及结合骨丧失一系列病变,严重时可导致种植体脱落,甚至治疗失败[1]。种植体周围炎是一种菌斑生物膜介导的疾病,现阶段有众多学者研究其治疗方法[2-3],如刮治、药物、激光、手术治疗等,但存在治疗操作的局限性、致病菌耐药性、手术创伤大、花费高等不足。近来有学者发现了一种新型抗菌制剂——抗菌肽。乳酸链球菌素(Nisin)是乳酸链球菌亚种分泌的细菌素,无毒性,具有良好的稳定性,不易产生耐药性[4],且现阶段研究证据支持Nisin抗菌肽对龋齿和牙周疾病相关致病菌的抗菌特性[4]。MTAN(a mixture of nisin, acid, and detergent)是将MTAD(a mixture of tetracycline isomer, acid, and detergent)中的多西霉素用Nisin抗菌肽替换,由Nisin粉、吐温-80、柠檬酸、无菌水配制而成,其具有良好的抗菌作用[5-6],但对种植体周围炎致病菌的作用国内尚未有研究。该研究拟探讨MTAN对种植体周围炎致病菌及生物膜的抑制作用,为临床治疗提供新思路。
1 材料与方法
1.1 主要材料牙龈卟啉单胞菌(P.gingivalisBNCC 337441)、具核梭杆菌(F.nucleatumBNCC337608)、血链球菌(S.sanguinisBNCC134927)、Nisin(上海北诺生物科技有限公司);柠檬酸(天津市瑞金特化学品有限公司);EDTA粉(济宁百川化工有限公司)。
1.2 主要仪器DG3022A型酶联免疫检测仪(南京国营华东电子管厂);DRAGONLABD2012型离心机(大龙兴创实验仪器(北京)有限公司);扫描电子显微镜(美国FEI公司,型号Quanta 250FEG)。
1.3 方法
1.3.1MTAN、MTAN+EDTA溶液的配制 MTAN溶液每100 ml溶液中含Nisin粉3.0 g、柠檬酸粉4.5 g、0.5 ml吐温-80、99.5 ml无菌水。MTAN+EDTA溶液每100 ml中含Nisin粉3.0 g、EDTA粉1.52 g、柠檬酸粉4.5 g、0.5 ml吐温-80、99.5 ml无菌水。将两种溶液Nisin的浓度稀释为2 mg/ml,-20 ℃ 保存备用。
1.3.2菌悬液的制备 牙龈卟啉单胞菌和具核梭杆菌复苏后,分别接种在BHI血琼脂培养基上,80% N2、20% CO2,37 ℃专性厌氧培养48 h。血链球菌复苏后接种在BHI血琼脂培养基上,37 ℃兼性厌氧培养48 h。生化鉴定及革兰染色证实为纯菌后增菌培养,BHI血清培养液稀释配置菌悬液浓度为2×108CFU/ml备用。
1.3.3最小抑菌浓度(minimum inhibitory concentration,MIC)、最小杀菌浓度(minimum bactericidal concentration,MBC)的测定 实验组:MTAN组及MTAN+EDTA组Nisin浓度均为1.95、3.9、7.8、15.6、31.3、62.5、125、250、500、1 000 μg/ml。阳性对照组:100 μl 0.12%氯己定溶液。阴性对照组:100 μl无菌水;各组均加入100 μl菌悬液。测量记录各孔混合液原始OD值,在光学显微镜下记阴性对照组细菌生存数,取平均值。将各组37 ℃厌氧下培养24 h,测量并记录各孔OD值,其中MIC为OD值变化小于0.05的浓度。MBC为大于MIC的各浓度中细菌的生存数降低大于99.9%的最小浓度。
1.3.4牙骨质片的制备 选用郑州大学第一附属医院大学路门诊(河南省口腔医院)口腔颌面外科新鲜拔除的健康前磨牙,经患者知情同意后,清除牙齿表面附着物,用高速涡轮手机磨取牙体邻面牙根部牙骨质片40片,大小约为4 mm×4 mm,超声荡洗、消毒后置于-20 ℃冰箱储存备用。
1.3.5MTAN、MTAN+EDTA对具核梭杆菌生物膜的影响 选取40个牙骨质片试样,随机分为8组,A组为阴性对照组:无菌水处理组;B组为阳性对照组:含0.12%氯己定的处理组;C、D、E组是Nisin浓度依次为125、250、500 μg/ml的MTAN处理组;F、G、H组是Nisin浓度依次为125、250、500 μg/ml的MTAN+EDTA处理组。取牙骨质片及无菌唾液于试管内,形成获得性膜,冲洗后放于24孔板中,每孔中置入1 000 μl菌液和1 000 μl BHI培养液,调整每孔中菌液浓度为1×108CFU/ml,专性厌氧培养48 h,取出试样并冲洗游离菌,每孔中按分组加入不同浓度试剂1 000 μl,培养24 h后,将牙骨质片清洗、固定、脱水、干燥,喷金,扫描电镜下观察生物膜情况。
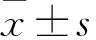
2 结果
2.1 OD值法测得的MIC和MBC值OD值变化小于0.05的记为MIC,细菌生存数降低大于99.9%的最小浓度记为MBC,从而得出MTAN、MTAN+EDTA的MIC和MBC值。实验结果得MTAN组,血链球菌的MIC和MBC值为31.3 μg/ml和125 μg/ml;具核梭杆菌的MIC和MBC值为62.5 μg/ml和250 μg/ml;牙龈卟啉单胞菌的MIC和MBC值为125 μg/ml和500 μg/ml。MTAN+EDTA组,血链球菌的MIC和MBC值为31.3 μg/ml和125 μg/ml;具核梭杆菌的MIC和MBC值为31.3 μg/ml和62.5 μg/ml;牙龈卟啉单胞菌的MIC和MBC值为62.5 μg/ml和250 μg/ml。
2.2 统计学分析根据实验结果,统计分析实验数据MTAN组:①S.sanguinis组Nisin浓度大于15.6 μg/ml的各组与阴性对照组之间差异有统计学意义(P<0.05);②F.nucleatum组Nisin浓度大于31.3 μg/ml的各组与阴性对照组之间差异有统计学意义(P<0.05);③P.gingivalis组Nisin浓度大于62.5 μg/ml的各组与阴性对照组之间差异有统计学意义(P<0.05)。MTAN+EDTA组:①S.sanguinis组Nisin浓度大于15.6 μg/ml的各组与阴性对照组之间差异有统计学意义(P<0.05);②F.nucleatum组Nisin浓度大于15.6 μg/ml的各组同阴性对照组之间差异有统计学意义(P<0.05);③P.gingivalis组Nisin浓度大于31.3 μg/ml的各组与阴性对照组之间差异有统计学意义(P<0.05)。
用绘图软件绘制同一药液不同Nisin浓度作用不同细菌的OD值(生长浊度)对应关系的柱状图,由图可见当Nisin的浓度大于一定值后各实验组同阴性对照组之间差异有统计学意义(P<0.05)。见图1、2。
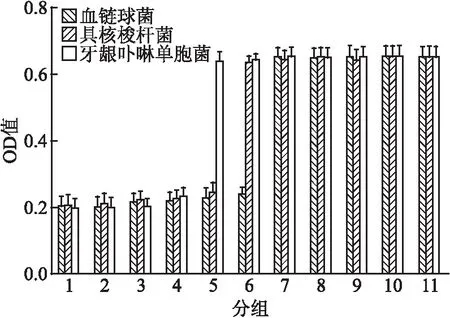
图1 MTAN组不同nisin浓度与三种菌OD值的对应关系
2.3 电镜扫描结果阴性对照组在5 000倍下可见牙骨质片表面形成了具核梭杆菌生物膜,生物膜连续致密,表面粗糙,未见裂隙;20 000倍下生物膜内具核梭杆菌相互交织呈网状生长,菌体粗壮饱满呈杆状,数目密集。阳性对照组5 000倍下见生物膜连续,有散在孔隙,与阴性对照组比较,表面平坦略光滑;20 000倍下见细菌菌体短小,散在分布生长,数目明显变少,见图3。

图2 MTAN+EDTA组不同nisin浓度与三种菌OD值的对应关系

图3 无菌水及氯己定作用下的具核梭杆菌生物膜
MTAN组中Nisin 浓度为125 μg/ml时,生物膜连续性有轻度破坏,表面有裂隙出现,与阳性对照组比较,表面粗糙,菌体干瘪但仍交织呈网状,数目有减少;250 μg/ml时,生物膜的完整性明显破坏,出现大的裂隙,细菌散在,数目明显减少,可见明显的不规则的球形或线形的死亡具核梭杆菌细胞;500 μg/ml时,生物膜表面大量的空洞、裂隙,偶有菌体细胞完整,见图4。MTAN+EDTA组浓度为125 μg/ml时,生物膜可见明显的破坏,出现孔洞和裂隙,与MTAN组比较,细菌数目减少,可见死亡的细菌细胞,250 μg/ml时,生物膜表面破坏严重,基本无细菌存活;500 μg/ml时生物膜的完整性不存在,可见到菌体裂解、消融,见图5、6。
3 讨论
口腔中多种微生物共存组成一个复杂的生态系统,正常口腔中微生物与宿主之间为共生关系,但某些特定时候这个平衡会被打破,微生物定性或者定量的变化会导致某些疾病的发生发展。通常情况下它们主要以非致病性生物膜的形式附着于种植体或者牙齿表面,当机体防御机制紊乱时,菌斑中某些细菌就转变成了致病菌,可引起牙周组织的感染[7-8]。起初牙体或种植体表面形成获得性膜,链球菌属通过与表面的唾液蛋白相互作用附着于其上,改变局部生存环境,后具核梭杆菌定植,该菌充当“连接者”作用,并进一步改变局部环境,连接晚期定植者如牙龈卟啉单胞菌,使该生物膜转变为具有致病性侵袭性的菌斑生物膜。该菌斑生物膜内细菌交互协同生存,明显提高了细菌对口腔环境的适应能力以及对宿主的致病性,且相关研究表明临床上牙菌斑对抗生素的耐药能力及致病性更强[9]。

图4 MTAN作用下具核梭杆菌生物膜情况

图5 MTAN+EDTA作用下具核梭杆菌生物膜情况

图6 Nisin浓度为500 μg/ml的MTAN+EDTA组具核梭杆菌菌体消融及裂解 ×40 000H3:消融;H4:裂解
本实验研究了MTAN及MTAN+EDTA对种植体周围炎致病菌:血链球菌、具核梭杆菌、牙龈卟啉单胞菌及生物膜的体外抑制效果。实验研究采用了美国国立临床实验室标准化委员会推荐的药物敏感实验,标准肉汤稀释法测定MTAN及MTAN+EDTA对3种致病菌的MIC及MBC值。结果显示二者对3种致病菌均有较强的抑制作用,此二者对血链球菌的抑菌效果最强,具核梭杆菌居中,牙龈卟啉单胞菌最差。这个结果可能由于Nisin是一种两亲性的小分子生物抗菌肽,它可以通过与G+膜表面的阴离子脂质结合或者特异性识别膜中脂质Ⅱ并与其结合作用形成孔洞,这一成孔特性可以破坏多种G+菌细胞膜而产生抑菌作用,能有效抑杀多种G+菌,但其不能破坏G-表面的保护性外膜。血链球菌为G+菌,因此Nisin能直接破坏细胞膜,抑制其生物活性。由于MTAN中的柠檬酸为一种螯合剂,可以破坏G-菌表面的保护性外膜,故提高了具核梭杆菌、牙龈卟啉单胞菌对Nisin的敏感度;且EDTA可以破坏保护性外膜并增加细胞膜通透性,从而促进Nisin进入细胞内,提高其抗菌性。但添加EDTA后并没有改变MTAN对血链球菌的抑菌效果,不过降低了MBC,可能与血链球菌本身是G+菌有关。根据研究结果提示MTAN、MTAN+EDTA可能会阻止早期致病性细菌生物膜的形成,进而降低种植体周围炎的发生可能。且在众多研究细菌的药敏实验中,细菌多为悬浮或者浮游状态,然而在口腔内细菌通常存在于牙菌斑中,并以多种细菌生存的生物膜形式存在。据相关研究表明,细菌在不同生存状态下时交流方式是不同的,生物膜中细菌通过信号分子相互交流,且它们可通过某种阈值感应系统增强自身的毒力和存活能力。此外,与浮游状态的细菌相比,生物膜状态下的细菌更可能发生基因突变,可能增强其对药物的耐药性[10]。因此研究评估药物对生物膜状态下细菌的作用是十分必要的。
具核梭杆菌介导早期和晚期细菌的共聚,且有助于形成专性厌氧菌如牙龈卟啉单胞菌的生存条件,同时它还能增强牙龈卟啉单胞菌致病性。因此有必要研究Nisin对具核梭杆菌生物膜的抑制作用。本实验集中研究了MTAN、MTAN+EDTA对具核梭杆菌生物膜的作用。根据实验结果显示,当MTAN和MTAN+EDTA中Nisin浓度为125 μg/ml时均对具核梭杆菌生物膜的生长有抑制作用,相比于阴性对照组,生物膜的连续性明显破坏,菌体干瘪短小,数目减少;与阳性对照组相似。随着Nisin浓度的增加,生物膜的完整性破坏加重,细菌数目减少甚至无法存活,细菌菌体结构破坏,内容物外溢、消融。以上结果表明,含有低浓度Nisin的MTAN及MTAN+EDTA对具核梭杆菌生物膜有较好的破坏作用,且能有效地抑制生物膜中的细菌。
综上所述,在本实验条件下,MTAN及MTAN+EDTA均能抑制种植体周围炎三种致病菌的体外生长繁殖及对具核梭杆菌生物膜结构有破坏作用,且加EDTA后增加了牙龈卟啉单胞菌及具核梭杆菌对Nisin的敏感性。该研究为种植体周围炎治疗方法提供了理论依据。

