HOTAIR在急性髓细胞性白血病中的表达及其对柔红霉素耐药的作用机制
陈玲琳,熊术道,高申孟
急性髓细胞白血病(acute myeloid leukemia, AML)是一组由染色体易位和(或)体细胞突变等多种遗传异常引起的造血系统恶性肿瘤[1]。长链非编码RNA (long noncoding RNA,LncRNAs)是非编码RNA的一种,是转录本长度大于200个核苷酸的非编码RNAs[2]。HOX 转录反义RNA(HOX transcript antisense RNA,HOTAIR)是第1个被发现具有反式作用的LncRNAs基因[3]。研究表明,HOTAIR表达水平上调不但与多种肿瘤包括乳腺癌[4]、宫颈癌[5]、AML[6]等的发生相关,还与肿瘤细胞的耐药密切相关[7]。与柔红霉素(daunorubicin,DNR)联合用药是AML化疗的重要方案,研究[8]表明临床上DNR耐药情况递增。因此,了解AML对DNR耐药机制有助于改善疾病的治疗。而有关HOTAIR与AML耐药的相关研究未见报道。该研究选取U937和TPH1耐药细胞株为研究对象,以shRNA作为病毒载体下调细胞中的HOTAIR表达,同时检测AML细胞对DNR的耐药,探讨相关的机制。
1 材料与方法
1.1 主要材料与试剂AML细胞株(HL60、THP1、U937、KG1、Kasumi-1、NB4、HEL、Kasumi-3、U937、THP1)及293T细胞株为温州医科大学附属第一医院内科实验室保种。AML患者来源的骨髓单个核细胞50例(AML原代细胞)、正常捐献者骨髓单个核细胞10例均来源于2017年5月~2018年10月温州医科大学附属第一医院血液科,标本采集前通过温州医科大学附属第一医院医学伦理委员会批准及患者知情同意。分型标准参照French-America-British(FAB)标准,明确诊断为AML。RPMI 1640培养液、DMEM培养液、青霉素链霉素溶液购自美国Gibco公司;PCR引物购自上海尼桑生物科技有限公司;Actin抗体与P-糖蛋白抗体购自美国Bio-Rad公司;qRT-PCR仪、RT-PCR试剂盒购自美国ThermoFisher公司;DNR购自美国MedChemExpress公司;流式AnnexinV/PI试剂购自美国Becton-Dickinson公司;流式细胞仪购自美国贝克曼库尔特公司;optiMEN、X-gene 9 购自瑞士罗氏公司;sh-NC载体、sh-HOTAIR载体购自美国Promega公司。
1.2 细胞培养293T细胞培养使用含10%胎牛血清DMEM培养基;U937细胞、THP1细胞使用含10%胎牛血清1640培养基;37 ℃、5% CO2条件下培养,每48 h换液、传代1次。
1.3 病毒包被取470 μl optiMEN、30 μl X-gene 9、sh-NC载体、sh-HOTAIR载体以及辅助质粒Gap-pol和VSVG,共同转入293T细胞,培养6 h后弃上清液,加入新鲜完全培养液。收集培养后48、72 h上清液。两次上清液以2 000 r/min离心10 min,0.45 μm过滤器过滤,-80 ℃保存待用。
1.4 载体转染U937与THP1细胞以5×105/ml浓度,0.5 ml铺6孔板,分别加入 sh-NC、sh-HOTAIR病毒上清液3 ml,1 500 r/min离心2 h,37 ℃、5% CO2孵育48 h后,加入嘌呤霉素筛选7 d。
1.5 Western blot检测P-糖蛋白载体转染后细胞经计数取等量活细胞,离心弃上清加含蛋白酶抑制剂的RIPA裂解液提蛋白,用BAC试剂盒进行蛋白定量,加5×蛋白上样缓冲液混匀变性。10% SDS-PAGE凝胶分离蛋白质140 V×40 min,电泳后转移到聚偏二氟乙烯膜220 mA×1.5 h,5%脱脂奶粉封闭2 h,TBST清洗后各自孵育P-糖蛋白(1 ∶2 000)与Actin(1 ∶5 000)抗体4 ℃过夜。弃一抗,TBST清洗3次,室温孵相应HRP-标记的相应二抗1 h,TBST清洗3次,加ECL试剂并上机显影。
1.6 qRT-PCR检测HOTAIR的表达标本用TRIzol提取总RNA,经过逆转录得到相应cDNA,以GAPDH(上游引物:5’-GGTCGGAGTCAACGGATTTG-3’,下游引物:5’-ATGAGCCCCAGCCTTCTCCAT-3’)为内参,40个循环qRT-PCR对其中的HOTAIR(上游引物:5’-AAAAGAGAGGGGTGGGAAGG-3’,下游引物:5’-CCGGAAATCAGGGCAGAATG-3’)的表达进行检测,上述引物由上海尼桑生物科技有限公司设计合成。计算2-ΔΔCt值分析结果。
1.7 细胞增殖抑制实验将转染后细胞接种于96孔板,密度为104个/孔,体积为100 μl。每孔的DNR终浓度为0.1 μmol/L,重复3孔,37 ℃、5% CO2培养24 h后,每孔加10 μl CCK-8试剂,避光孵育2 h,450 nm检测各组吸光度。
1.8 流式细胞术检测细胞凋亡将转染后的细胞接种于6孔板中,加DNR终浓度为0.1 μmol/L为实验组,不加药组对照组,每株细胞重复3孔。37 ℃、5% CO2培养24 h后,加试剂避光孵育后检测。
2 结果
2.1 HOTAIR在AML标本及细胞株中表达选取AML细胞系、AML患者骨髓单个核细胞、正常捐献者骨髓。提RNA,逆转录,qRT-PCR检测HOTAIR的表达。实验结果表明,与对照组(10.70±2.85)比较,AML细胞系HOTAIR(30.50±8.39)表达上调,差异有统计学意义;与对照组(10.77±3.20)比较,AML原代细胞HOTAIR的表达(43.60±6.39)上调,差异有统计学意义。见图1。

图1 HOTAIR在不同细胞中的表达
2.2 DNR对AML细胞增殖影响终浓度为0.1 μmol/L的DNR处理24 h后,sh-HOTAIR+THP1组比sh-NC+THP1组增殖显著下降(t=37.25,P<0.001),sh-HOTAIR+U937组比sh-NC+U937组增殖显著下降(t=29.47,P<0.001)(图2),提示在相同的药物浓度下,sh-HOTAIR组增殖低,HOTAIR表达与药物敏感相关。

图2 DNR对不同细胞增殖的影响
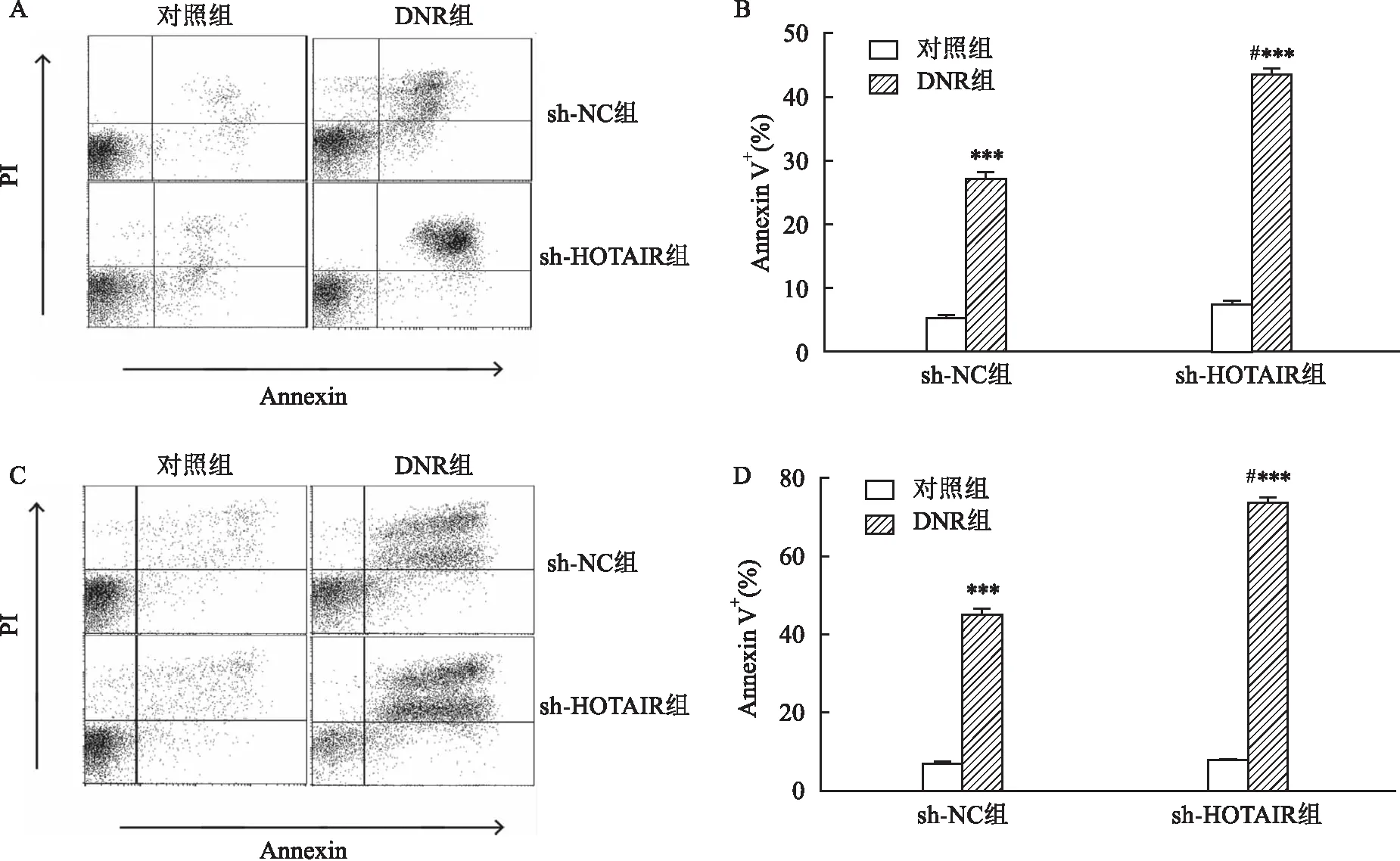
图3 沉默HOTAIR促进DNR对AML细胞凋亡
2.3 DNR对AML细胞凋亡影响转染好的细胞分两组,不加药为对照组,另一组加终浓度0.1 μmol/L DNR组。 THP1细胞,DNR+sh-NC组细胞凋亡率高于对照sh-NC组(t=18.77,P<0.001),DNR+sh-HOTAIR组细胞凋亡率高于对照sh-HOTAIR组(t=30.77,P<0.001),DNR+sh-HOTAIR组细胞凋亡率高于DNR+sh-NC组(t=10.75,P<0.05);U937细胞,DNR+sh-NC组细胞凋亡率高于对照 sh-NC组(t=28.60,P<0.001),DNR+sh-HOTAIR组细胞凋亡率高于对照sh-HOTAIR组(t=40.49,P<0.001),DNR+sh-HOTAIR组细胞凋亡率高于DNR+sh-NC组(t=15.33,P<0.05)。见图3。
2.4 干扰HOTAIR影响P-糖蛋白的表达HOTAIR在AML中表达上调,为研究其是否参与耐药,本研究进一步沉默HOTAIR的表达(图4),与sh-NC+THP1组(56.30±0.15)比较,sh-HOTAIR+THP1组(23.88±0.34)HOTAIR表达显著下调;与sh-NC+U937组(49.99±0.76)比较,sh-HOTAIR+U937组(25.81±0.25)HOTAIR表达显著下调;观察HOTAIR对耐药蛋白P-糖蛋白表达的影响,Western blot结果表明,THP1细胞,与sh-NC组比较,sh-HOTAIR组P-糖蛋白表达明显下降(t=87.21,P<0.001);U937细胞,与sh-NC组比较,sh-HOTAIR组P-糖蛋白表达明显下降(t=81.39,P<0.001)。提示P-糖蛋白表达与HOTAIR表达水平相关(图5)。
3 讨论
AML是常见的血液系统肿瘤,除了早幼粒细胞白血病(M3)外,其他类型的AML目前仍无法治愈[9],其中复发、耐药是AML重要死亡原因之一。DNR是AML化疗方案中的重要药物,然而,关于AML对DNR的耐药机制,尚未完全阐明。本研究显示HOTAIR在AML细胞表达明显上调,沉默HOTAIR表达及联合DNR不仅有利于抑制细胞增殖、促进细胞凋亡,而且可明显下调P-糖蛋白的表达。表明HOTAIR可能参与了AML的发生发展及耐药形成。本研究结果可能为AML的发生发展机制及药物靶向治疗提供新的研究基础及思路。
研究表明 HOTAIR在AML中异常表达且与肿瘤耐药相关。本研究对原代AML细胞及其相关细胞株的研究显示HOTAIR在AML细胞表达明显上调,与Wu et al[10]研究相似。
HOTAIR参与肿瘤耐药研究得到越来越多的关注。Cheng et al[11]研究表明沉默HOTAIR胃癌细胞对顺铂的半数抑制浓度显著下降。Yang et al[12]研究表明HOTAIR在非小细胞肺癌中表达上调并促进细胞对克唑替尼的耐药。抑制HOTAIR的表达促进慢性粒细胞白血病细胞对伊马替尼的敏感[7],上述研究表明HOTAIR可能对细胞耐药起着关键作用。本研究显示,在终浓度为0.1 μmol/L的DNR作用下,敲低HOTAIR表达,可以抑制细胞增殖,促进细胞凋亡。表明敲低LncRNAs HOTAIR可有效提高THP1与U937细胞对DNR的药物敏感性,提示HOTAIR可能参与了AML耐药。
人P-糖蛋白存在于正常组织胃肠道、肝脏和肾脏上皮细胞以及大脑的毛细血管、睾丸和卵巢中,P-糖蛋白充当了大脑、睾丸和卵巢的屏障,促进各器官排泄功能。P-糖蛋白由耐药基因MDR1编码,定位于细胞膜上,是ATP结合盒式(ATP bindingcassette,ABC)膜转运蛋白超家族的成员,通过ATP释放能量将细胞内的药物泵出,降低胞内的药物浓度[13]。Kong et al[14]研究表明,上调肝癌细胞中HOTAIR表达,细胞的P-糖蛋白表达上升,诱导了肝癌细胞对药物耐药。本研究结果表明,沉默THP1与U937细胞中HOTAIR表达,细胞P-糖蛋白表达也相应下降;P-糖蛋白对DNR外排作用降低,致使细胞增殖下降。同样,在终浓度为0.1 μmol/L的DNR作用下,敲低HOTAIR的表达,P-糖蛋白表达下降,DNR被泵出细胞的量减少,滞留细胞内的时间延长,对白血病细胞的作用增强,可以促进白血病细胞凋亡[15]。因此,下调HOTAIR表达并协同DNR作用,进而促进细胞凋亡、抑制细胞增殖。
综上所述,本研究表明HOTAIR在AML中表达上调,抑制HOTAIR表达,可以下调P-糖蛋白的表达,促进AML耐药细胞株对DNR的敏感性,进而抑制AML细胞增殖,促进其发生凋亡。HOTAIR表达异常,参与了AML对DNR耐药作用及其机制,研究结果为AML对DNR耐药干预提供了新的潜在靶点。

