天冬酰胺内肽酶敲除协同阿可拉定有效抑制乳腺癌骨转移
包佳煜,陈峻崧,郭 方
在中国,癌症的发生发展率正在不断增加,每年被诊断出超过 1 600 万人,并且有 1 200 万人死于该疾病。与其他大多数国家一样,乳腺癌现在是我国女性中最常见的癌症。我国占全球所有新诊断乳腺癌的12.2%,占所有乳腺癌死亡人数的9.6%[1]。晚期乳腺癌易发生肋骨、胸骨、胸椎及腰椎等部位骨转移,其发生率为65%~75%[2]。
天冬酰胺内肽酶(legumain,LGMN)是一种酸性半胱氨酸内肽酶,具有良好的保守性,在植物、无脊椎动物寄生虫以及哺乳动物中均存在。它在肿瘤微环境中过表达,同时通过促进细胞迁徙和组织入侵等方式,促进癌细胞的转移[3]。
阿可拉定是异戊二烯类黄酮衍生物,具有化学稳定性、易于获得等特点。此外,阿可拉定在不同的癌细胞中表现出抗癌活性,包括肝癌[4]、乳腺癌[5]、结肠癌[6]等。近几年,研究表明阿可拉定不仅具有抗癌活性,还可以抑制破骨细胞的体外活性,通过抑制骨吸收来发挥骨保护功能[7]。该研究旨在从动物水平探究LGMN的敲除和联合用药阿可拉定对乳腺癌骨转移的疗效,为未来肿瘤转移等研究和治疗提供新思路。
1 材料与方法
1.1 材料
1.1.1动物与细胞株 SPF级Balb/C雌鼠,6周龄,由上海交通大学动物房饲养, 其中Balb/C背景的LGMN敲除鼠是由日本Masahide Asano课题组的C57背景敲除鼠与Balb/C小鼠回交约10代得到。细胞株:4T1.2细胞株为可定向骨转移细胞株。
1.1.2主要的仪器与试剂 二氧化碳细胞培养箱、-80 ℃超低温冰箱(美国Thermo公司);高速超低温离心机(德国Beckman公司);DMEM培养基(美国Gibco公司);GAPDH、β-actin(美国Proteintech公司); p-STAT3、STAT3(武汉博士德公司);legumain(美国Abcam公司);p-GSK3α/β、GSK3β、 β-catenin(美国CST公司);Sodium Pyruvate、MEM NEAA(美国Sigma公司);阿可拉定(上海融禾医药科技发展有限公司)。
1.2 方法
1.2.1细胞培养 乳腺癌细胞株4T1.2用含10%胎牛血清的DMEM培养基(加入1%的Sodium Pyruvate和1%的MEM NEAA), 置37 ℃、5% CO2的培养箱中培养, 取对数生长期细胞用于后续实验。
1.2.2模型制备 应用左心室注射4T1.2细胞法进行造模 (活细胞悬液浓度为106个/ml, 每只注射0.1 ml) ,具体操作为将小鼠四肢用胶带固定在加热垫, 小鼠身体完全伸展开,保持在实验过程中小鼠体温相对恒定,用1 ml的胰岛素注射器吸取细胞悬液,注射进小鼠的左心室,其位置是:距离中轴约3 mm,第二类间隙,进针角度与腹正中线夹角约为45°,进针长度约为7 mm,扎针成功的标志是鲜红色的血液不断往外蹦,保持扎针角度和位置不变,缓慢将细胞悬液缓慢推进左心室,当注射器拔出后,用棉球按压左心室片刻,以防细胞漏于胸腔,造模约3周时间取材检测,实验分为空白对照组、模型组、用药组,其中用0.5%羧甲基纤维素钠作为空白对照组的灌胃剂,实验组阿可拉定的浓度是5 mmol/L,每组15只,根据小鼠体质量灌胃(0.01 ml/g),相关实验均在SPF级动物房完成,并且符合动物伦理。
1.2.3模型检测 Micro-CT是专用于小动物的计算机体层成像系统,反映骨标本的三维数据, 其中图像和数据的处理软件包括CTAn、CTvol等。将固定好的骨标本进行检测,在分析之前使用DataViewer将分析区域骨骼的长轴作调整,使其与冠状位及矢状位的轴线保持平行。用CTAn软件对骨的微观结构进行相应参数分析,具体包括骨体积分数(percent bone volume,BV/TV)、骨小梁数量(trabecular number,Tb.N)、骨表面密度(bone surface density,BS/TV)、骨小梁分离度(trabecular separation,TB.sp)等。用CTvol进行CT扫描图像三维演示。
1.2.4蛋白免疫印迹实验 液氮研磨法将新鲜骨组织碾碎,将研磨好的组织用蛋白裂解液裂解(含PMSF 1 mmol/L和磷酸酶抑制剂),13 200 r/min离心5 min, 取上清液,测定蛋白浓度,加入蛋白loading,100 ℃、煮10 min,使蛋白变性。Bio-Rad湿法电泳,10%聚丙烯酰胺凝胶进行分离蛋白,再100 V转膜2 h。5%脱脂牛奶室温封闭1 h;分别加入对应的一抗,其中β-actin稀释比为1 ∶10 000;其余抗体均为1 ∶1 000,4 ℃孵育过夜。次日用TBST缓冲液漂洗3次,每次5 min;加入对应二抗1 ∶5 000,1 h,室温TBST缓冲液漂洗3次,每次5 min;加入曝光液显影,拍摄成像。
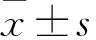
2 结果
2.1 小鼠鉴定与生存分析根据正常野生型小鼠和LGMN敲除型小鼠骨髓中蛋白表达条带显示,在野生型中存在蛋白表达,在敲除型小鼠中没有蛋白表达,见图1A。每组15只小鼠进行动物实验,20 d为时间节点统一处理实验小鼠,根据生存周期,绘制生存曲线。野生型的小鼠中位生存期低于LGMN敲除型的小鼠,同时敲除型联合用药组的小鼠生存周期长于单独LGMN敲除型的小鼠,采用Log-rank (Mantel-Cox) 方法分析得出差异有统计学意义P<0.05。见图1B。
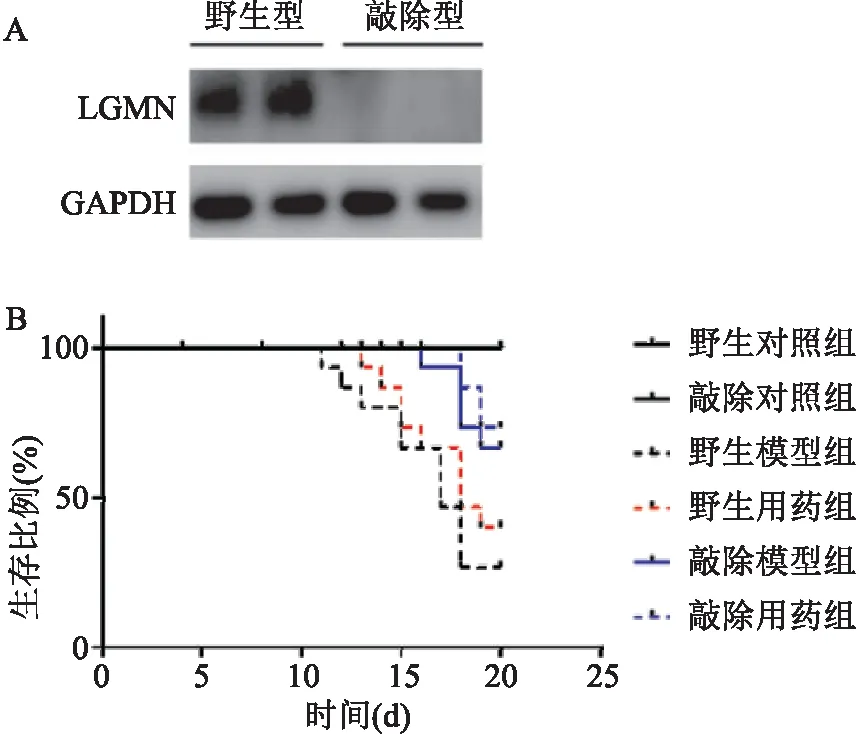
图1 小鼠LGMN表达与生存曲线图
2.2 骨腐蚀情况检测经Micro-CT的检测结果显示LGMN缺失的小鼠在造模后腐蚀情况较野生型的差异体现在松质骨,BV/TV数值上升(F=7.90,P<0.05)、TB.sp下降(F=9.59,P<0.05);而在LGMN敲除的小鼠同时用阿可拉定进行治疗,骨腐蚀的情况得到改善,Tb.N为(F=117.16,P<0.001)、BV/TV为(F=326.96,P<0.001)、TB.sp为(F=37.84,P<0.01)、BS/TV为(F=115.90,P<0.001)。见表1、图2。
2.3 骨组织相关蛋白检测蛋白免疫印迹实验表明在造模组,β-catenin(F=15.79,P<0.05)、p-STAT3(F=16.72,P<0.05)、p-GSK3β(F=9.68,P<0.05)的表达量上升而在LGMN敲除的小鼠中对应蛋白的表达量下降,具有显著性差异;在LGMN敲除和联合用药的情况下,蛋白的表达量进一步降低,β-catenin(F=28.10,P<0.01)、p-STAT3(F=107.56,P<0.001)、p-GSK3β(F=26.77,P<0.01)。见图3。
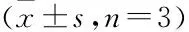
表1 骨小梁结构参数
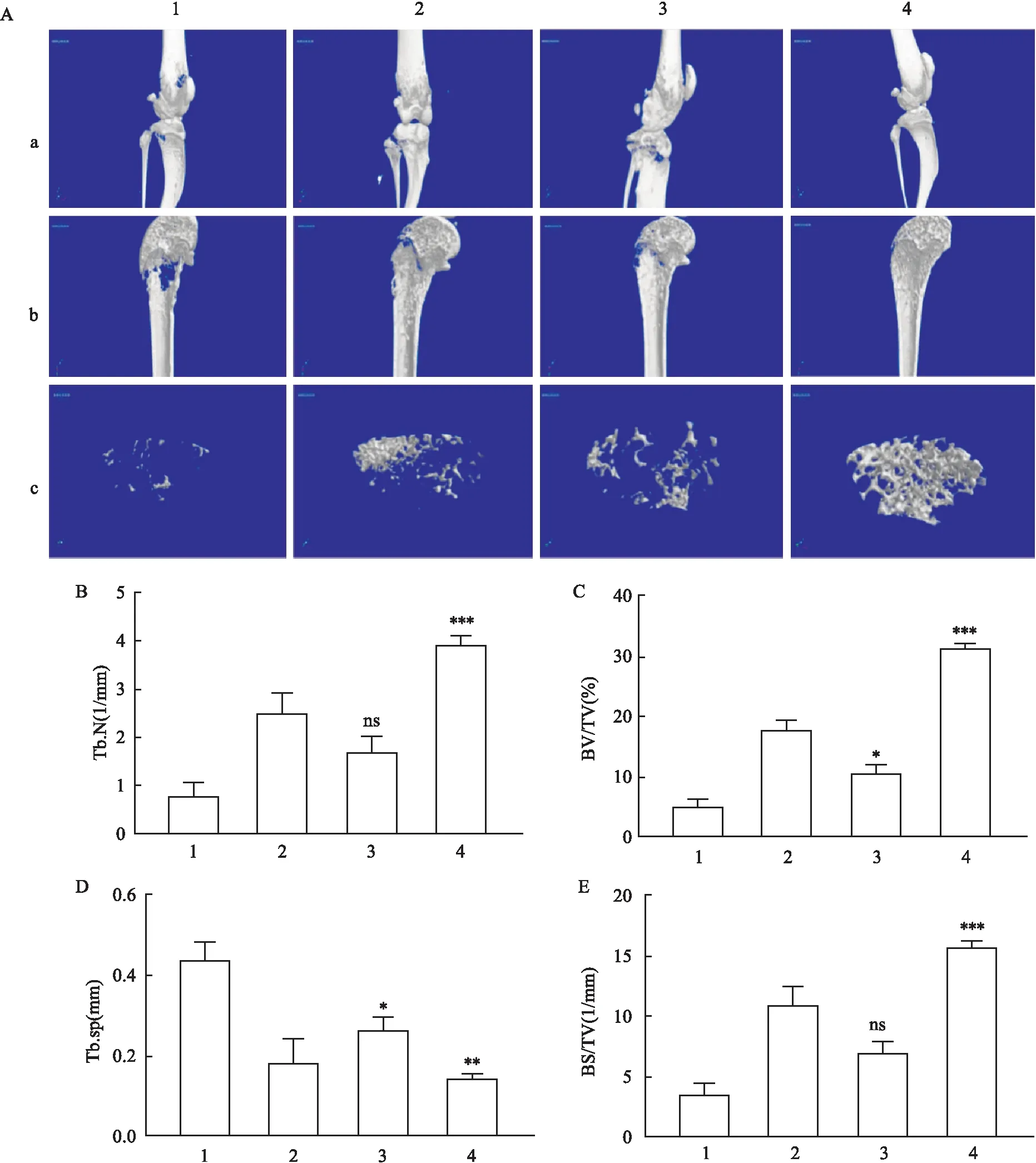
图2 骨组织三维重构与分析图
2.4 模型组和用药组的脏器观察通过对小鼠的脾脏观察,模型组野生型和LGMN敲除型小鼠的脾脏不存在显著性差异,但在LGMN敲除联合用药的情况下脾脏减小,差异有统计意义(F=73.50,P<0.01)。见图4。
3 讨论
众所周知,转移包括多重步骤,具体为肿瘤细胞首先从原发肿瘤部位脱落并迁移,侵入邻近组织并穿透基底膜,进入血液或淋巴管,从而经过循环系统传播至远处的器官,形成微转移性结节,然后在周围的基质定植并且重塑,并形成转移[8]。骨骼是实体瘤转移的第3部位,在晚期乳腺癌中,骨转移的发生率高,同时首发症状为骨转移者占27%~50%[2]。其中转移通常存在于富含红骨髓和骨小梁的骨骼中,例如椎骨、肋骨、骨盆和长骨的末端,在手或脚的骨骼中很少。同时,骨痛、骨损伤、骨痛加剧等是乳腺癌骨转移常见的并发症,同时一旦发生骨转移,预后相对较差。目前临床上乳腺癌的治疗方法,有通过FDA批准的单克隆抗体药物地诺单抗、阿法替尼等[9]。但是疗效仍然不尽人意,更有效的靶点和治疗仍需要被探究。
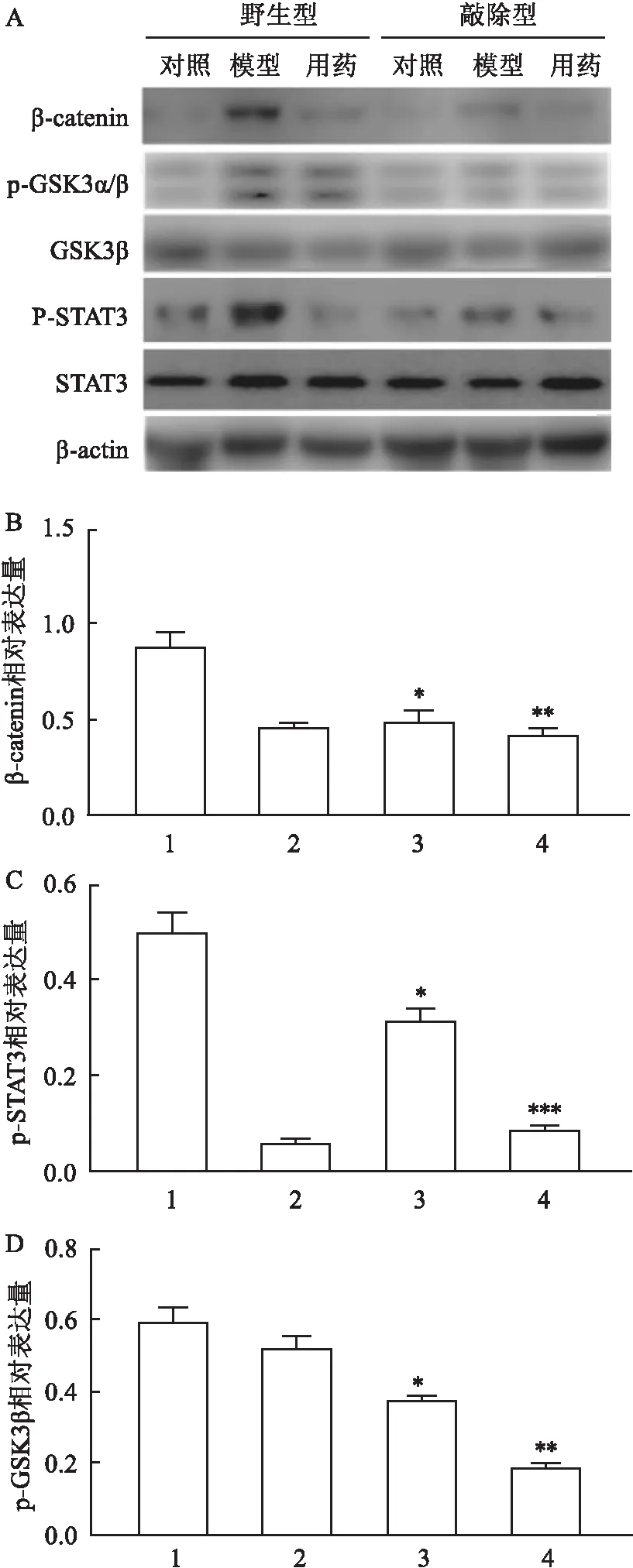
图3 小鼠骨组织的蛋白检测与丰度统计
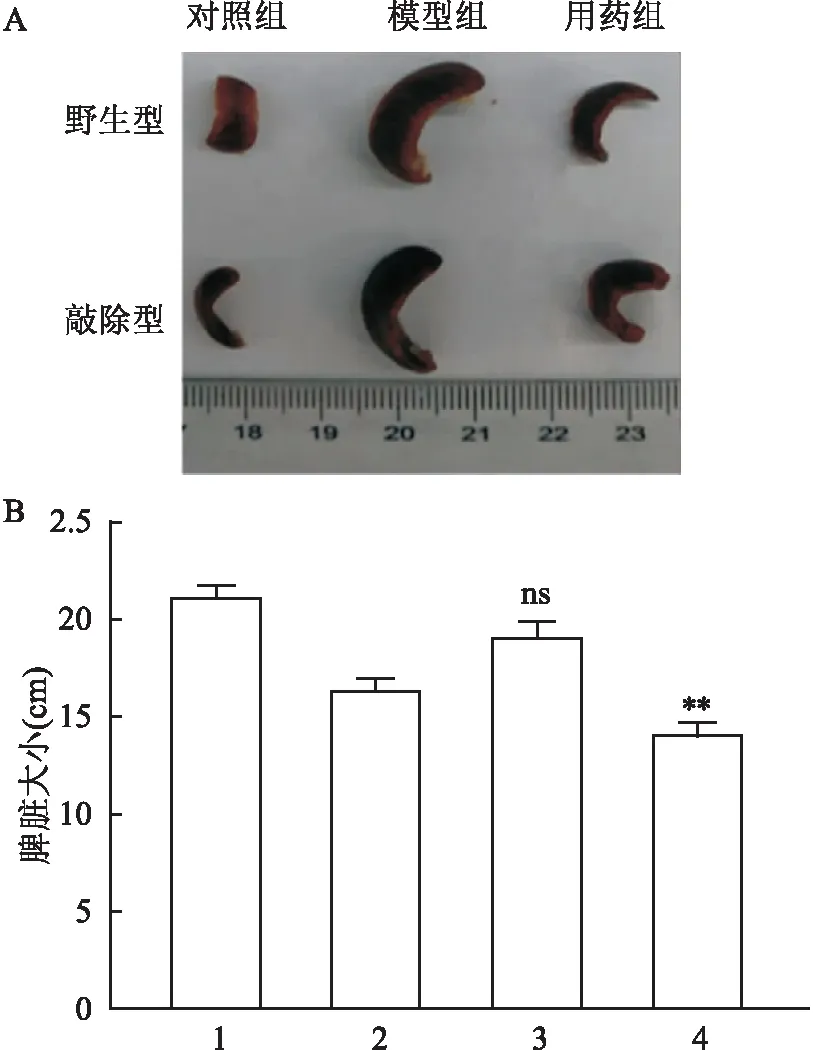
图4 小鼠脾脏大小统计
研究[10-11]表明STAT3激活发生于40%以上的乳腺癌中,STAT3的抑制可以改善乳腺癌的进程,并且减少转移,最终提高患者的整体生存率。在肿瘤炎症微环境中,GSK3β磷酸化可影响WNT信号通路的下游因子是β-catenin[12]。相关研究[13]发现,与不发生骨转移的TM40D乳腺癌细胞比较,高骨转移的TM40D-MB乳腺癌细胞表现出更高的β-catenin的信号活性。
本研究表明,在LGMN敲除的小鼠中,骨腐蚀程度明显减小;联合用药后显示乳腺癌骨转移的情况得到进一步改善。根据蛋白免疫印迹图,联合用药后,改变了STAT3、GSK3β、β-catenin相关信号通路,治疗组p-GSK3β和β-catenin均发生了下调,说明敲除LGMN联合用药降低了机体的促炎反应,从而缓解了乳腺癌的骨转移。同时由于阿可拉定的骨保护作用,其遏制破骨细胞的形成,这可能也将对已经发生骨转移的小鼠,在转移灶处起一定的保护作用,进一步的减少骨的破坏[13]。
LGMN在肿瘤微环境中高度表达,具有作为生物标记物和治疗靶标的潜力。研究[3]表明使用基于LGMN的DNA疫苗可以特异性靶向肿瘤微环境中的肿瘤相关巨噬细胞,该疫苗通过控制LGMN阳性的肿瘤相关巨噬细胞,参与调控CD8+的T细胞应答,有效地保护宿主免受肿瘤细胞的攻击。本研究选择用LGMN野生型和敲除型的小鼠进行实验,观察LGMN敲除的情况下可缓解小鼠乳腺癌骨转移。
阿可拉定在药理学中的研究表明,它具有广泛的治疗能力,存在巨大的医用价值,它有效靶向癌症干细胞和耐药性癌细胞,以抗增殖、抗血管生成等方式参与调节[14]。阿可拉定在相关的研究中被发现可以有效抑制三阴性乳腺癌,同时通过影响相关信号通路诱导细胞凋亡,同时减少乳腺癌细胞中干样细胞比例[5]。本研究表明使用药物后可以略微缓解乳腺癌骨转移。

