射血分数保留或减低心力衰竭患者肺动脉压及右心结构变化的研究
苟春丽,刘永铭,薛丽丽,马苏美,杨京港,杨琳,杜颖石
随着人口老龄化和人类疾病谱的演化,心力衰竭患病人数逐年上升,严重危害人类健康。长期以来心力衰竭的研究焦点在左心,而右心成为被忽视的“旁观者”[1-2]。近年来一些研究显示,右心结构功能异常不仅是心力衰竭的常见现象,而且是心力衰竭致残、致死以及生活质量的重要决定因素[3-4],甚至某些右心功能参数的预后价值优于左心功能参数,引发了人们对右心作用的重新思考。本研究对射血分数保留心力衰竭(HFpEF)与射血分数减低心力衰竭(HFrEF)患者右心结构异常和肺动脉高压的发生情况进行了比较分析,旨在揭示心力衰竭右心改变的规律,为探讨心力衰竭新的干预靶点提供依据。
1 资料与方法
研究对象:连续入选2013 年9 月至2018 年12月兰州大学第一医院老年心血管科收住的新诊断心力衰竭患者935 例。排除合并瓣膜病、肾病、甲状腺功能减退症或亢进症、先天性心脏病、心包疾病、慢性阻塞性肺疾病、中重度贫血、晚期肿瘤的患者,最终纳入619 例。依据2008 年欧洲心脏病学会心力衰竭诊断标准[5-6],将纳入患者分为HFpEF 组(n=461)和HFrEF 组(n=158),观察其临床特征及右心结构改变。另选同期年龄、性别相匹配的正常健康人196 例作为正常对照组,以确定右心结构指标参考范围。为观察肺动脉高压与右心结构的关系,将HFpEF 组及HFrEF 组分别分为肺动脉高压与非肺动脉高压两个亚组。
一般临床资料:对所有患者详细询问病史并行体格检查和血液常规、生化检查及N 末端B 型利钠肽原(NT-ProBNP)等的测定。
超声心动图检查:采用美国GE 公司LOGIQ9超声诊断仪进行检查,每个指标测定3~5 个连续心动周期,取平均值。(1)右心结构测定:参考2010 年美国和欧洲超声心动图定量指南[7]:采用肋弓下切面测定收缩期末期和舒张期末期右心室游离壁厚度(RV-FWs、RV-FWd);于心尖部四腔切面测定舒张末期右心室基底部内径(RVD1)、中部内径(RV-D2)以及基底部至心尖部长度(RV-D3);于胸骨旁短轴切面心底部水平测定右心室流出道内径[RVOT1(主动脉瓣上)、RVOT2(肺动脉瓣环水平)];于心尖部四腔切面测定右心房短径(RA-D1)和长径(RA-D2)以及右心房面积(RAA)。(2)肺动脉收缩压(PASP)的检测:采用三尖瓣反流法评估。在无肺动脉狭窄和流出道梗阻的情况下,PASP 等于右心室收缩压,通过多普勒超声心动图测量,采用简化Bernoulli方程结合右心房压计算PASP(即4V2+右心房压),右心房压力按照美国超声心动图协会推荐的方法[8],通过下腔静脉(IVC)内径及吸气末塌陷率评估。肺动脉高压被定义为 PASP>35 mmHg(1 mmHg=0.133 kPa)。
统计学方法:采用SPSS 21.0 软件进行统计学分析。计量资料以均数±标准差或中位数(P25,P75)表示,两组间均数比较采用独立样本t检验,非正态分布资料比用Mann-Whitney U 检验。多组间均数比较采用方差分析,两两比较采用LSD 法(方差齐性时)或Dunnett T3 法(方差不齐时),非正态分布资料比较用Kruska-Wallis 检验。正常对照组右心结构指标测定参考范围中位数(P5,P95)表示,测定值大于正常上限(P95)为异常。计数资料以率表示,组间比较采用卡方检验。因素间关系分析采用Pearson(正态分布数值型变量)或Spearman(非正态分布数值型变量)相关分析及多元线性回归分析。P<0.05 为差异具有统计学意义。
2 结果
两组心力衰竭患者一般临床资料比较(表1):HFpEF 组年龄、女性比例、高血压患病率、体重指数、收缩压均大于HFrEF 组,而NYHA 心功能分级Ⅲ~Ⅳ级比例、冠心病比例、心率低于HFrEF 组,P均<0.05;两组心房颤动及糖尿病的患病率差异均无统计学意义(P均>0.05)。此外,HFrEF 组血红蛋白、门冬氨酸氨基转移酶、丙氨酸氨基转移酶、直接胆红素、间接胆红素、血尿素氮、血肌酐、低密度脂蛋白胆固醇及NT-ProBNP 高于HFpEF 组,而甘油三酯、高密度脂蛋白胆固醇低于HFpEF 组,P均<0.05。
表1 两组心力衰竭患者一般临床资料比较[例(%),]
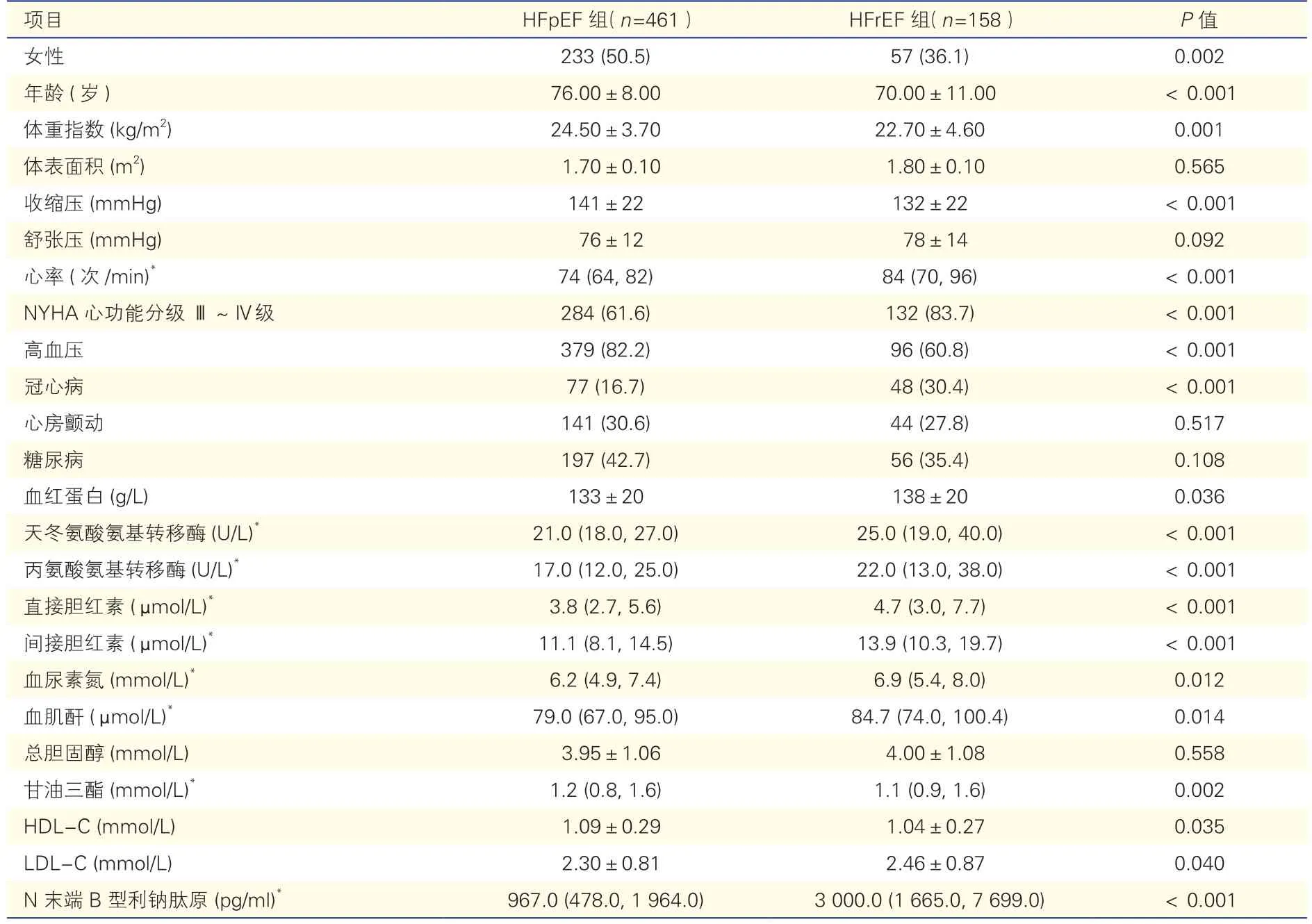
表1 两组心力衰竭患者一般临床资料比较[例(%),]
注:HFpEF:射血分数保留心力衰竭;HFrEF:射血分数减低心力衰竭;HDL-C :高密度脂蛋白胆固醇;LDL-C:低密度脂蛋白胆固醇。*:以中位数(P25,P75)表示。1 mmHg=0.133 kPa
两组患者肺动脉高压及右心结构异常变化的比较及定量分析(表2、3):HFrEF 组肺动脉高压患病率及PASP 平均值均高于HFpEF 组,且中度与重度肺动脉高压患病率高于HFpEF 组,P均<0.05。健康对照组RV-FWd、RV-D1、RV-D2、RV-D3、RVOT1、RVOT2、RA-D1、RA-D2、RAA的95%CI 上限分别为6.0 mm、39.0 mm、33.1 mm、64.5 mm、31.7 mm、30.0 mm、42.0 mm、53.8 mm 及19.0 cm2,与欧美指南[7]正常参考范围上限十分接近,以此为切点,右心结构参数异常率HFpEF 组为5.7%~46.5%,HFrEF 组为10.9%~51.5%,两组RV-FWd 异常率最低,右心房内径和右心房面积异常率最高。HFpEF 组右心房及右心室结构参数至少一项异常的比例为71.6%,而HFrEF 组为81.6%(P<0.05)。HFrEF 组右心室结构参数至少两项异常的比例高于HFpEF 组(P<0.01),而两组间右心房结构参数至少两项异常的比例差异无统计学意义。另外,HFrEF 组RV-D3、RVOT1、RVOT2及RA-D1 异常率及平均值均大于HFpEF 组,P均<0.05。
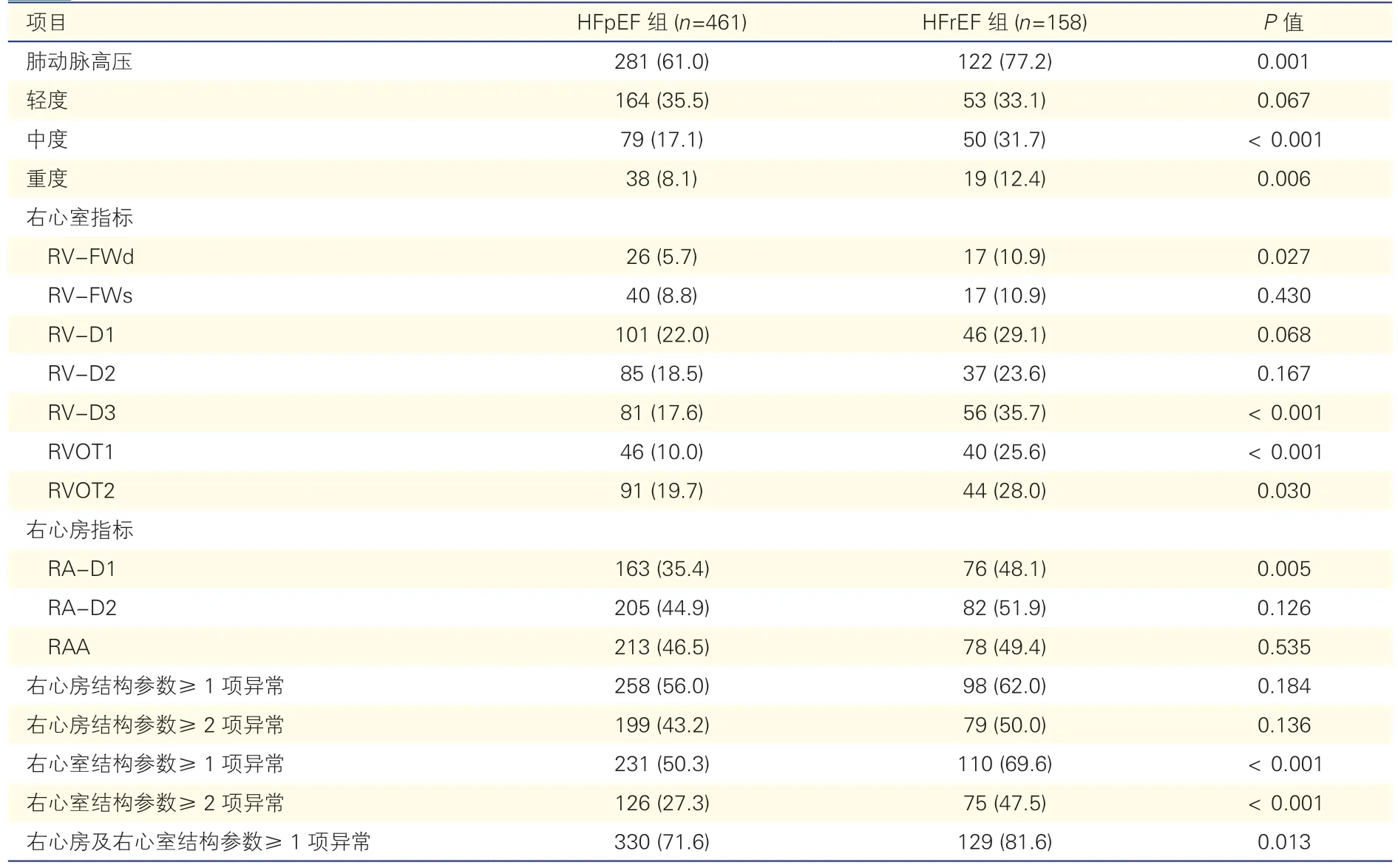
表2 两组患者肺动脉高压及右心结构异常变化的比较[例(%)]
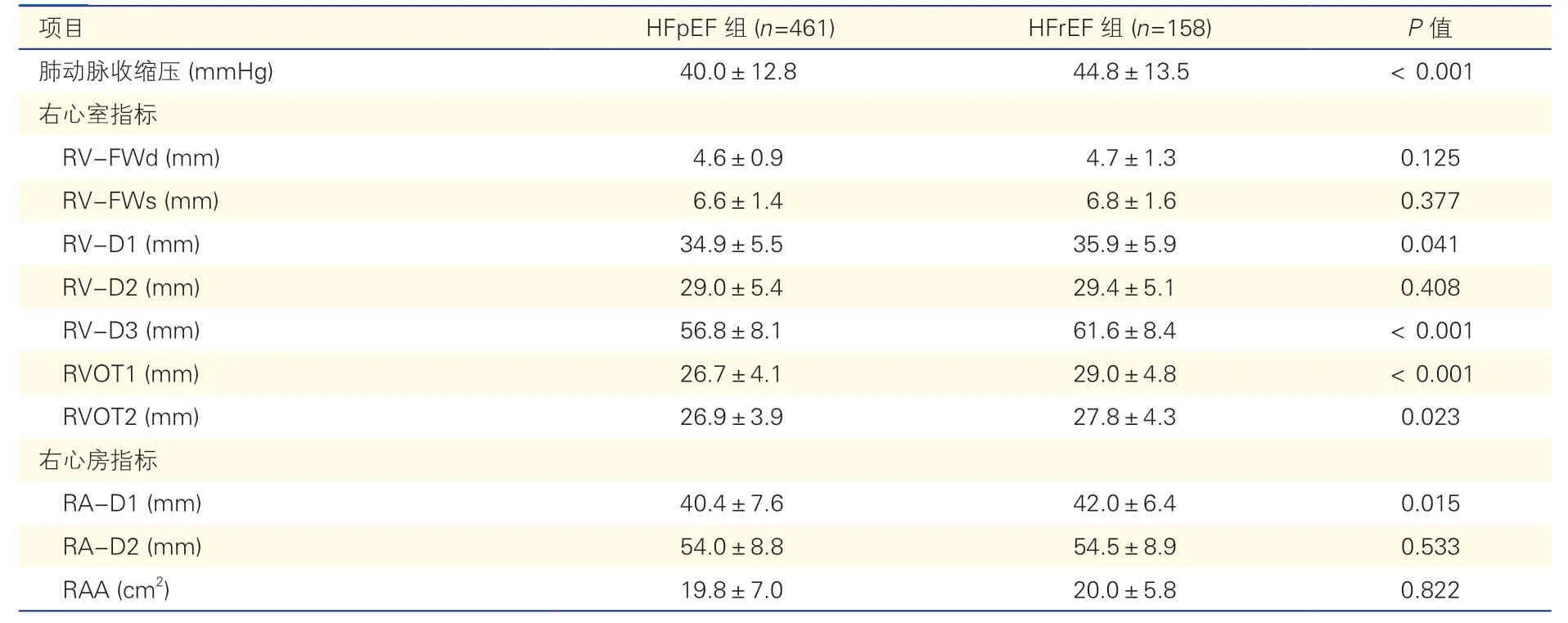
表3 HFpEF 及HFrEF 肺动脉压和右心结构定量分析
右心结构改变与肺动脉压的关系(表4、5):HFrEF 组合并肺动脉高压者右心室及右心房结构指标RV-D1、RV-D2、RA-D1、RA-D2、RAA 大于不合并肺动脉高压者(P均<0.05),而HFpEF 组合并肺动脉高压者仅有右心房结构指标RA-D1、RAD2、RAA 大于不合并肺动脉高压者(P均<0.05),右心室结构参数差异无统计学意义。以右心结构指标为因变量,性别、年龄、体重指数、血压、心率、NYHA 心功能分级Ⅲ~Ⅳ级、高血压、冠心病、心房颤动、糖尿病以及PASP 为自变量做简单相关和多元线性回归分析显示,无论HFrEF 还是HFpEF,RV-D2、RA-D1、RA-D2 及RAA 与PASP 独立相关,右心室游离壁厚度与PASP 不相关。此外,HFpEF组RA-D1、RA-D2、RAA 与心房颤动病史独立相关(β 值分别为0.341、0.423、0.371,P均<0.001),而HFrEF 组无上述相关性。
表4 两组患者合并与不合并肺动脉高压与右心结构改变的亚组分析()
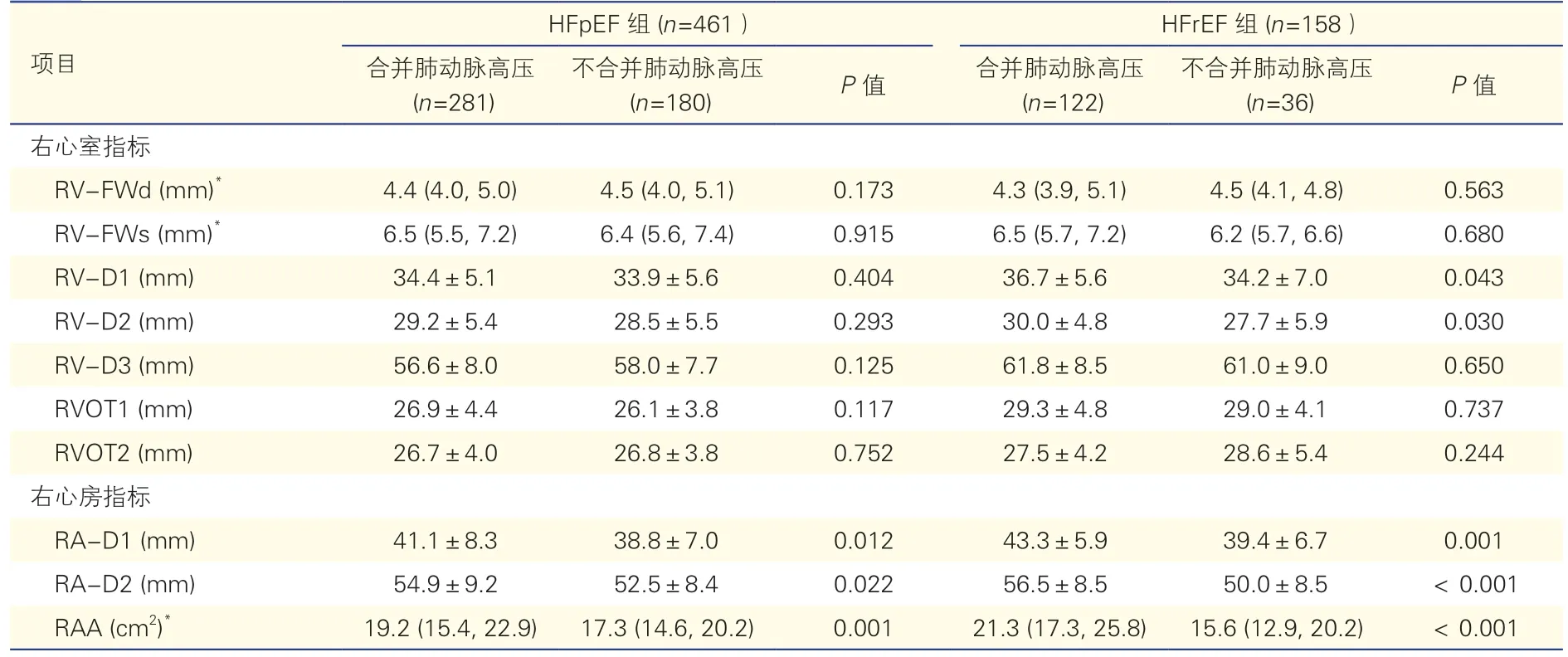
表4 两组患者合并与不合并肺动脉高压与右心结构改变的亚组分析()
注:HFpEF:射血分数保留心力衰竭;HFrEF:射血分数减低心力衰竭;RV-FWd:右心室游离壁厚度(舒张末期);RV-FWs:右心室游离壁厚度(收缩期末);RV-D1:右心室基底部内径;RV-D2:右心室中部内径;RV-D3:右心室基底部至心尖部长度;RVOT1:右心室流出道内径(主动脉瓣上);RVOT2:右心室流出道内径(肺动脉瓣环水平);RA-D1:右心房短轴内径;RA-D2:右心房长轴内径;RAA:右心房面积。*以中位数(P25,P75)表示

表5 HFpEF 及HFrEF 右心结构与肺动脉压多元线性回归分析
3 讨论
1910 年法国生理学家Bernheim 最早描述了左右心室间的相互作用,他推测左右心室之间可能相互联系并相互影响,左心室肥厚、扩张和功能障碍会导致右心室结构功能异常。然而,由于右心室解剖形态的特殊性[9],准确评价其结构功能受到了极大的限制。近二十年来,大量研究发现左心衰竭引起肺静脉压升高,进一步导致肺动脉高压,最后造成右心结构功能损害[2,10],但上述结论主要来源于HFrEF 的研究。虽然国际上逐渐出现HFpEF 右心功能损害的报道[11],但有关右心结构的研究国内外均少见。
本研究发现,不论HFrEF 还是HFpEF,右心房、右心室结构均发生了明显改变,而且不同结构的损害程度并不一致。
由于右心室组织结构对压力负荷的敏感度较高,肺动脉高压是HFrEF 右心功能损害的主要原因[1],本研究发现,HFrEF 及HFpEF 患者肺动脉高压发生率分别为77.2%和61.0%,HFrEF 患者中、重度肺动脉高压患病率高于HFpEF,与国外大多数研究相近。HFrEF 组合并肺动脉高压者右心室内径、右心房内径和面积大于不合并肺动脉高压者,与白洋等[12]研究结果一致,HFpEF 合并肺动脉高压者右心房内径和面积亦大于不合并肺动脉高压者,而右心室大小差异无统计学意义,同时,无论HFrEF还是HFpEF,右心房及右心室部分参数与肺动脉压独立相关,支持肺动脉高压是导致右心房和右心室结构改变的重要因素[13],但也表明肺动脉压对HFpEF 右心室的影响强度相对较弱。本研究还发现,HFpEF 与HFrEF 右心房损害程度相似,多元线性回归分析显示,心房颤动病史与HFpEF 右心房内径和面积独立相关,与有关报道一致[14],但与HFrEF 右心房无相关性,提示HFpEF 与HFrEF 右心房扩大的机制存在差异。
除肺动脉高压及右心房改变外,两类心力衰竭患者右心室损害亦存在显著差异。HFrEF 患者RVD3、右心室流出道内径平均值及增大者比例、右心室结构至少一项及两项异常的比例均高于HFpEF 患者,表明HFrEF 右心室扩大更为普遍和严重,究其原因,首先可能是血流动力学因素,左心室容积扩大是HFrEF 特征之一,左心室扩大在长轴方向对右心室的被动牵拉作用决定了HFrEF 右心室扩大更为明显;其次是心肌病变本身的因素。HFrEF 心肌缺血、变性坏死不但发生在左心室,也可出现在右心室,心肌收缩力下降、心室重塑导致右心室扩大,而HFpEF 主要表现为左心室向心性肥厚、间质纤维增生,右心室心肌收缩功能损害较轻,与此相关的右心室重塑也轻于HFrEF[11];最后还表现在左、右心室相互作用的不同。左、右心室通过共同的室间隔相连,因此,左心室可以通过室间隔而影响右心。右心室游离壁向室间隔横向收缩射血约占右心室射血分数的30%,而室间隔和左心室游离壁的作用可占60%[15],HFrEF 左心室扩大,心肌收缩力严重下降,而HFpEF 整体收缩功能正常或接近正常,因此,HFrEF 较HFpEF 室间隔收缩能力下降更严重,对右心室射血影响更大。Melenovsky等[16]及Parrinello等[3]发现,HFrEF 比HFpEF 左心房容积更大,压力更高,表明左心室充盈压更高[17-20],HFpEF 和HFrEF舒张期室间隔受到的压力不同,根据Laplace 定律,HFrEF 室壁负荷更大,引起的室壁和室间隔移位也可能更严重,因此,对右心室产生的影响更大。
本研究发现,HFrEF 及HFpEF 患者右心室游离壁厚度增加,在合并与不合并肺动脉高压患者中差异并无统计学意义,多元线性回归分析进一步表明与肺动脉压无相关性,提示肺动脉高压不是右心室游离壁增厚的决定性因素。研究发现高血压、肥胖或超重等因素可导致右心室室壁增厚[21-22],而上述因素是心力衰竭的危险因素,提示心力衰竭的基础疾病是右心室游离壁厚度增加的重要原因。
综上所述,心力衰竭患者右心结构改变不同部位差异很大,HFrEF 患者右心室改变及损害程度较HFpEF 患者更加严重。一半以上的HFrEF 及HFpEF 患者合并肺动脉高压,肺动脉高压与HFrEF右心房、右心室损害相关,而与HFpEF 右心室损害关联性较弱。心房颤动病史亦与HFpEF 右心房损害相关。HFrEF 与HFpEF 右心结构改变有明显不同,发生机制也可能存在差异,值得进一步深入研究。
利益冲突:所有作者均声明不存在利益冲突

