重组人白细胞介素15蛋白的制备和鉴定方法研究①
郑燕平,黄 晶
(1.厦门大学附属第一医院肿瘤中心实验室,福建 厦门 361001; 2.厦门特宝生物工程有限公司 ,福建 厦门361001)
白细胞介素15(interleukin 15,IL-15)可经活化的成纤维细胞、表皮细胞和单核巨噬细胞等多种细胞产生,与白细胞介素2具有相似的功能和结构,可以利用其受体的β链和γ链与靶细胞结合,是一种重要的多功能细胞因子。1994年,Grabstein K. H.等在检测猿肾上皮细胞培养上清液时发现了这种细胞因子[1]。最初这种细胞因子被发现对T细胞具有化学趋化作用而促进T 细胞的活化增殖,之后该细胞因子具有调节B细胞、自然杀伤(NK)细胞、细胞毒性T淋巴细胞(CTL)、中性粒细胞和树突状细胞的功能也逐渐被人们发现,其通过与其它细胞因子相互作用在人体免疫调节和保护方面发挥了巨大的作用[2]。1995年这种细胞因子被正式命名为白细胞介素15。
近年来的研究表明,IL-15与许多自身免疫性疾病、变态反应性疾病及血液性疾病紧密相关[3]。IL-15广泛参与人体免疫过程,在炎症性疾病治疗及抗肿瘤治疗中具有独特作用而备受人们关注[4,5]。
本文报道了制备和鉴定rhIL-15蛋白的方法,建立的HPLC和MALDI串联质谱测定所制备的rhIL-15蛋白的方法能准确反映蛋白的纯度和质量,为蛋白分析提供了重要的参考依据,具有较强的临床研究价值。
1 材料和方法
1.1 材料
E.coli BL21(DE3)菌株,E. coli DH5α、pET-22b质粒购自Novagen公司。蛋白分子量标准购自Amersham 公司。DNA 分子量标准从Fermentas 公司购买。30%聚丙烯酰胺胶浓缩液购自Bio-Rad 公司。β-巯基乙醇(2-ME),过硫酸铵,SDS,Tris,EDTA,TEMED 购自Sangon 公司。限制性内切酶,T4连接酶,异丙基-β-硫代半乳糖苷(IPTG)购自Thermo Fisher公司;、氨苄青霉素、咪唑、还原型谷胱甘肽(GSH) 、氧化型谷胱甘肽(GSSG) 、二硫苏糖醇( dithiothreitol,DTT)、 LB 培养基购自厦门泰京生物技术有限公司,尿素和盐酸胍购自广州金华大化学试剂公司;质粒提取试剂盒,核酸回收试剂盒购自Omega公司;纯化填料购自GE公司;色谱柱Agilent Bio SEC-5和Agilent ZORBAX 300SB-C18购自Agilent公司;其它试剂均为分析纯。凝胶成像分析系统购自(UVP 7300) UVP 公司;超纯水制备装置(HPLC/UF) 购自PALL 公司;微型台式高速离心机(mini spin) 购自 Eppendorf 公司;台式高速冷冻离心机(Allegra 64R) 购自Beckman 公司;电子分析天平 (METTLER AE 240) 购自Mettler 公司;SDS-PAGE 系统购自 Bio-Rad公司;酶标仪(Model 680) 购自Bio-Rad 公司;-80℃超低温冰箱(Scientific Bio-freezer) 购自Forma 公司;紫外/可见分光光度计(ND-1000) 购自NanoDrop 公司;多用电泳仪(Power Pac 300) 购自Bio-Rad 公司;生物反应器为GE公司产品;蛋白纯化系统为GE公司产品;MALDI串联质谱仪为ABI公司产品;高效液相色谱仪(HPLC)1200 Series为Agilent公司产品。
1.2 人IL-15 蛋白分子结构的分析
在NCBI数据库中找到人IL-15蛋白的氨基酸序列。同时可以从网站中找到IL-15 蛋白质三维结构和四级结构。
1.3 表达载体的构建
基于人IL-15蛋白氨基酸序列,根据大肠杆菌偏好密码子和核酸二级结构特点,我们设计了rhIL-15的cDNA序列,再在它们的5’端和3’端分别加入 BamHI和EcolI酶切位点。合成的基因片段插入pGH质粒中,使用BamHI和EcolI双酶切,回收酶切产物并纯化,使用T4连接酶将基因片段和同样双酶切的pET-15b质粒连接。将10μL连接产物转化进入100μL DH5α感受态细胞,涂布于LB/Amp+平板,37℃培养过夜。挑取单菌落培养过夜,使用质粒提取试剂盒提取质粒,BamHI和EcolI双酶切鉴定,筛选阳性克隆,对阳性克隆进行DNA测序验证。
1.4 rhIL-15蛋白的发酵表达
经过测序验证的质粒1μL转化进入100μL BL21(DE3)感受态细胞,涂布于LB/Amp+平板,37℃培养过夜。挑取单菌落培养过夜,放大体积至250mL。将250mL菌液接入含2.5L LB/Amp+液体培养基的生物反应器中,37℃ 450rpm培养至对数生长早中期(OD600约为2),加入1mM IPTG诱导6h,8000rpm离心收集菌体。
1.5 包涵体制备
菌体用6M尿素溶解,8000rpm离心收集上清,用亲和填料Chelating Sepharose FF纯化。用30mM Tris Cl 10mM β-ME 6M尿素pH 7.8平衡和上样,用350mM咪唑洗脱目的蛋白。
1.6 蛋白复性
在洗脱目的蛋白中加入GSH/GSSG,10℃缓慢搅拌复性48h。把复性蛋白液用20mM TrisCl 20mM NaCl pH 7.8稀释复性48h。(复性缓冲液A: 1mmol /L EDTA、20mmol /L Tris-HCl、0.2mmol /L GSSG、2.0mmol /L GSH、150mmol /L L-精氨酸、2.0mmol/L DTT、0.02mol/L NaCl、80mL/L甘油、1 mol /L盐酸胍,pH7.8; 复性缓冲液B : 1mmol /L EDTA、20mmol /L Tris-HCl、0.2mmol /L GSSG、2.0mmol /L GSH、0.2mol /L L-精氨酸、2.0mmol /L DTT、0.02mol /L NaCl、80mL/L甘油、0.2g/L NaN3,pH7.8)。
1.7 复性蛋白捕获
透析蛋白液用亲和填料Chelating Sepharose FF纯化。用20mM Tris Cl 20mM NaCl pH7.8平衡和上样,用350mM咪唑洗脱目的蛋白。
1.8 蛋白纯化
蛋白液用离子交换填料Q Fast Flow纯化,用20mM Tris Cl 20mM NaCl pH 7.8平衡和上样,用0.8M NaCl洗脱目的蛋白。洗脱蛋白液用凝胶过滤填料Superdex 75纯化,在相应出峰位置收集目的蛋白。
1.9 蛋白电泳鉴定
电泳纯度测定使用SDS-PAGE,配制15%分离胶和5%浓缩胶,20mA恒流电泳,考染检测。
1.10 HPLC纯度检测
使用排阻色谱柱: Agilent Bio SEC-5,流动相: 0.15M 磷酸钠0.15M NaCl pH7.0,柱温28℃,检测波长220nm,流速1mL/min。使用反向色谱柱: Agilent ZORBAX 300SB-C18,流动相: A 0.1% TFA/H2O B 0.1% TFA/90%ACN/H2O,柱温28℃,检测波长260nm,流速1ml/min。
1.11 质谱检测
采用MALDI串联质谱仪,点样靶为质谱普通靶,检验用水为超纯水(电阻率不低于18.2MΩcm,制备当天使用),基质为芥子酸(4-羟基-3,5-二甲氧基肉桂酸),样品中盐含量低于50mM,待测成分浓度高于0.01mg/mL。
1.12 生物学活性测定
将标准品和样品稀释至预稀释浓度,做16个浓度梯度检测,每个浓度做3个重复实验,同时做阴性对照和空白对照,阴性对照为稀释培养液+细胞,空白对照为稀释培养液+细胞重悬培养液。取生长状态好的CTLL-2细胞,吹打分散,1500rpm离心弃培养液,采用细胞重悬培养液重悬细胞,计数并调整适当的细胞悬液浓度,取出加入到加有标准品和样品的96孔板中,37℃ 5% CO2培养18~24h。标准品/样品/空白各孔加入MTT溶液,置于37℃ 5% CO2培养4~6h,再加入甲瓒裂解液吹打,酶标仪比色,检测波长570 nm,参考波长630nm。
2 结果
2.1 重组表达载体的构建和鉴定
BamHI和EcolI双酶切的rhIL-15基因片段回收纯化,和同样双酶切的pET-15b质粒连接并转化。挑取单菌落抽提质粒双酶切鉴定,琼脂糖凝胶电泳结果显示在350 bp处出现酶切片段,结果与预期一致,DNA测序也显示序列正确。
2.2 rhIL-15合蛋白在大肠杆菌中的表达
含重组质粒pET-22b-rhIL-15的菌株经IPTG诱导表达后进行SDS-PAGE,结果显示在分子量约16kD处出现蛋白表达条带。
2.3 rhIL-15蛋白的纯化
取2mL预培养的的培养液到200mL新鲜的LB 培养基中,37℃培养3~4h至A600为0.4~0.6时,加入浓度为0.5mmol/L 的诱导剂IPTG,37℃继续培养4~8h,收集诱导后的菌体。重悬,超声破碎后离心得到重组IL-15蛋白包涵体。包涵体经洗涤缓冲液洗涤后,用6mol/L盐酸胍和6mol/L尿素溶解。我们发现,重组IL-15蛋白包涵体不溶于6mol/L的尿素而溶于6mol/L的盐酸胍,因此我们选择6mol/L 的盐酸胍溶解IL-15包涵体,进一步使用亲和层析、离子交换层析和凝胶过滤进行精纯,我们最终获得rhIL-15目的蛋白。
2.4 rhIL-15蛋白的纯度测定
使用排阻色谱柱和反向色谱柱检测蛋白的纯度,检测结果显示,rhIL-15蛋白排阻柱出峰时间为11.206min,纯度为98%(图1A),反向柱出峰时间为13.093min,纯度为96%(图1B)。

图1 rhIL-15蛋白HPLC色谱柱检测A 排阻柱检测 B 反向柱检测
2.5 rhIL-15蛋白的分子量测定
使用MALDI串联质谱仪测定rhIL-15蛋白的分子量。rhIL-15蛋白的分子量测定结果为12768.605Da(图2),与理论分子量基本一致。
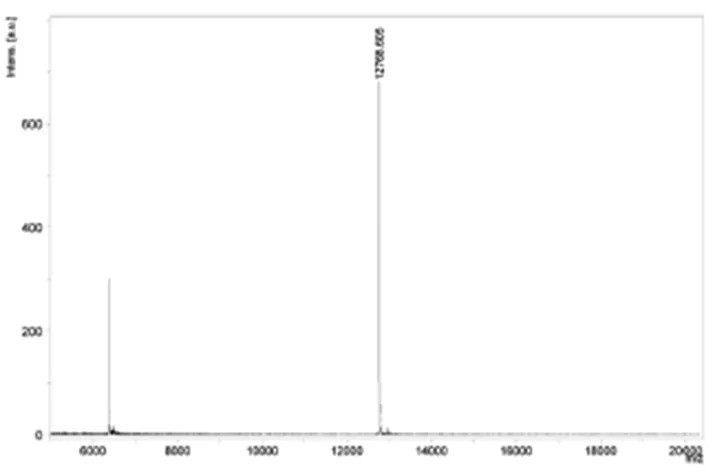
图2 rhIL-15蛋白质谱的分子量分析
2.6 rhIL-15蛋白的生物学活性
采用CTLL-2/MTT比色的方法测定rhIL-15蛋白的生物学活性。通过参数回归计算测得,蛋白的比活性为5.86×108IU/mg。
3 讨论
IL-15是新近发现的一种因子,在人体多种组织和细胞中广泛分布,在天然免疫系统中发挥着重要的作用。IL-15可诱导B细胞,T细胞和NK细胞增殖;IL-15能够刺激,诱导LAK细胞活性,还能与IL-12协同刺激NK细胞产生IFN-γ。IL-15不仅在自身免疫系统平衡中扮演重要角色,促进各种免疫细胞的活性及增殖,还在抗病毒感染、免疫治疗、肿瘤基因治疗、DNA疫苗等方面表现出巨大的临床应用潜力[6~8]。
然而IL-15在人体组织中含量甚微,难以满足日益增加的科研与临床需求。因此简单高效地获得高纯度高生物学活性的rhIL-15成为十分关键的步骤。迄今国内外有大量文献阐述了rhIL-15蛋白的表达和纯化[9,10],但是却很少出现有获得与天然的人IL-15蛋白氨基酸序列完全一致的rhIL-15蛋白的报道,本文报道的制备rhIL-15蛋白的方法,采用大肠杆菌表达系统,通过基因工程手段简单高效地获得rhIL-15,并且让复性后的蛋白获得高生物活性。众所周知,蛋白的功能与活性取决与其正确折叠的程度。研究表明人IL-15蛋白含有2对二硫键[11],rhIL-15包涵体蛋白的复性因此显得尤其重要。我们通过摸索复性过程中的不同盐浓度、GSH/GSSG比例、表面活性剂添加条件和稀释条件,得到了一个合适的蛋白复性条件。最终的生物学活性分析表明,制备的rhIL-15蛋白比活性较高,为蛋白的规模化生产和进一步应用研究提供了坚实的基础。
本实验中利用高效液相色谱法和质谱法来检测rhIL-15的纯度和分子量。在摸索最佳条件中得出以下经验:色谱柱类型及流动相的设置要根据待检测样品的理化特性,流动相的浓度要适当,如果浓度不足或过量,可能影响峰形,峰面积和分离度。 另外, 流动相pH值,柱温,检测波长,流速的选择要注意结合实验条件,遵循相应的标准,以确保检测结果的精确性。而质谱仪测定时,样品盐浓度不宜过高,待测成分浓度不能过低,如有盐浓度过高或是待测成分过低的情况可以采用超滤、使用相应萃取小柱等方法达到脱盐和浓缩待测成分的目的。

