实时荧光定量聚合酶链式反应快速鉴定三种鳕鱼
汪 艺 冯俊丽,2,* 戴志远,2 田小兰
(1 浙江工商大学海洋食品研究院,浙江 杭州 310012;2 浙江省水产品加工技术研究联合重点实验室,浙江 杭州 310012)
鳕鱼属脊椎动物门(Vertebrata)硬骨鱼纲(Osteichthyes)鳕形目(Gadiformes)。鳕鱼营养丰富、肉味鲜美,是全世界年捕捞量最大的鱼类之一,具有重要的经济价值[1-2]。目前,我国市售鳕鱼主要分为三类:第一类为鳕科鳕鱼类,包括大西洋鳕鱼(Gadusmorhua)、太平洋鳕鱼(G.macrocephalus)、狭鳕(Theragrachalcogramma)、黑线鳕(Melanogrammusaeglefinus)、青鳕(Theragrachalcogramma)等;第二类被称为“银鳕鱼”的裸盖鱼(Anoplopomafimbria)和南极犬牙鱼(Dissostichuseleginoides),其分别属鲉形目和鲈形目,但营养价值高于鳕科鳕鱼类[3];第三类为鱼目混珠的假鳕鱼类,俗称油鱼,主要为棘鳞蛇鲭(Ruvettuspretiosus)和异鳞蛇鲭(Lepidocybiumflavobrunneum),均属于鲈形目。异鳞蛇鲭含有40%以上的蜡脂(蛇鲭毒素),主要用于提炼工业润滑剂,不可食用[4]。
为规范鳕鱼类商品的标示,香港食品安全中心于2007年推出了《有关识别及标签: 油鱼/鳕鱼的指引》[5],指出鳕鱼只代表鳕形目鱼类,南极犬牙鱼和裸盖鱼仍可使用俗名“银鳕鱼”。然而,鳕形目鱼类品种繁多,形态学差异较小,不同的鳕鱼品种市场价格差异悬殊,常出现以次充好、伪造掺假的现象[6-8]。近年,多个城市出现不法商贩将异鳞蛇鲭冒充鳕鱼卖,引起消费者腹泻、肠胃痉挛等不适[8]。此外,约六成市售鳕鱼是去头去内脏的冷冻形式,其余四成是去皮去骨的鱼切片,消费者难以通过形态特征判断鱼的种类。因此,为了更加有效地确保鳕鱼产品质量,防止以次充好,需要一种快速有效的鳕鱼物种鉴定方法。
与传统的形态特征鉴别相比,基于DNA技术的分子生物学检测法[9-13]更适合各种鳕鱼产品(冷冻切片及深加工制品)的鉴别。DNA遗传序列能精确的鉴定物种,尤其线粒体DNA具有较高的变异和进化速率,常被用于鉴定近缘物种。常用的线粒体片段有Cytb[14]基因、COI[15]基因和D-loop区域(也称control region,CR)[16]等。
目前,聚合酶链式反应(polynlerase clmin reaction,PCR)技术是应用最为广泛的物种鉴定分子生物学方法。在普通PCR技术的基础上,实时荧光定量PCR(quantitative real-time PCR, qPCR)的应用越来越广泛。qPCR是在PCR体系中引入荧光信号,利用荧光信号的变化实时监测PCR扩增反应每一个循环PCR产物量的变化[17]。 其中,SYBR Green Ⅰ 法适用性较广,不需要合成特异性探针,具有低成本、高特异性、高检测效率等特点,常用于食品真伪鉴定。相比于传统PCR技术,qPCR的优点是不需要在反应结束后再开盖进行电泳检测,既降低了污染的可能性,也减少了操作时间。此外,有研究表明,水产品经过热加工,基因已经大量降解为200 bp以下的小片段[18-20]。qPCR所扩增的片段较短(一般小于250 bp),因此对冰冻和新鲜水产品,以及熟制或罐装等鳕鱼类产品均可进行物种鉴定。
本研究以鳕科大西洋鳕鱼、太平洋鳕鱼及黑线鳕为研究对象,阴性对照选择俗称“银鳕鱼”的南极犬牙鱼和假鳕鱼异鳞蛇鲭,利用线粒体16S rDNA和Cytb基因片段,建立qPCR体系,对其进行物种分析及鉴定,旨在探索建立鳕鱼市场监管的检测方法。
1 材料与方法
1.1 材料与试剂
大西洋鳕鱼、太平洋鳕鱼、黑线鳕和南极犬牙鱼及异鳞蛇鲭均由浙江工商大学海洋食品研究院提供,-20℃冰箱冷冻保存。13种检测样品(其中包括6种深加工样品)均购自杭州当地多处市场并低温(4℃)保存。
磷酸盐缓冲液(phosphate buffer solution, PBS),自制;液氮,杭州今工气体有限公司;Axygen基因组DNA小量提取试剂盒,吴江康宁生命科学有限公司;TB GreenTMPremix Ex TaqTM(Tli RNaseH Plus)(2×)试剂盒、PrimeSTAR Max Premix(2×) 试剂盒,大连TaKaRa生物公司。
1.2 主要仪器与设备
HB-100型恒温金属浴,杭州博日科技有限公司;MRIEX-5型漩涡振荡器,海门其林贝儿仪器制造有限公司;ChemDoc XRS型凝胶成像系统,T100型PCR仪、PTC-0148型Mini Opticon Monitor 3实时荧光定量PCR仪,美国Bio-Rad公司;BSAl24S-CW型电子天平,北京赛多利斯科学仪器有限公司;EVOLUTION 60S型紫外可见分光光度计、Fresco 21型高速冷冻离心机,美国Thermo Fisher Scientific 公司;LDZX-50KBS型立式压力蒸汽灭菌器,上海申安医疗器械厂。
1.3 试验方法
1.3.1 待测样品DNA提取 分别称取300 mg待测样品,使用Axygen基因组DNA小量提取试剂盒提取基因组DNA。获得的DNA经1.5%凝胶电泳检测后,通过紫外可见分光光度计在260 nm波长下测定其浓度。将大西洋鳕鱼、太平洋鳕鱼、黑线鳕、南极犬牙鱼及异鳞蛇鲭DNA用无菌双蒸水进行10倍连续梯度稀释进行绝对灵敏度试验。所有DNA置于-20℃保存备用。
混合DNA制备:将切碎的异鳞蛇鲭肉分别与3种鳕鱼肉(大西洋鳕鱼、太平洋鳕鱼及黑线鳕)混合制得含10%、1%、0.1%、0.01%及0.001%(w/w)目标鳕鱼肉的混合物,分别称取300 mg,使用Axygen基因组DNA小量提取试剂盒提取基因组DNA。所有DNA置于-20℃保存备用。
1.3.2 qPCR引物设计 通过NCBI数据库(http://www.ncbi.nlm.nih.gov/)下载鳕科中常见鳕鱼、南极犬牙鱼及异鳞蛇鲭的线粒体基因序列,如表1所示。经DNAStar软件里的MegAlign工具比对,找出各序列中的保守和变异区域。
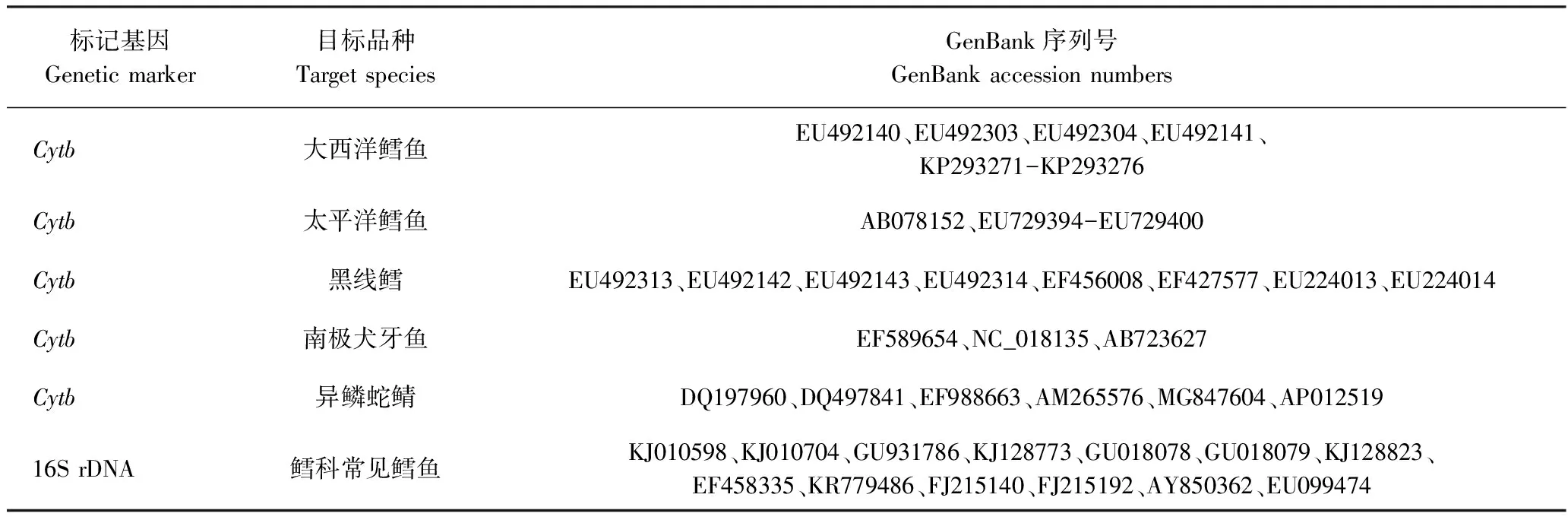
表1 引物设计的GenBank序列号Table 1 GenBank accession numbers for sequences used to design primers
使用Primer Premier 5.0(PREMIER Biosoft International,Palo Alto,CA)软件设计候选引物,并根据各引物的二聚体和错配发生率进行筛选。所有特异性引物都经过GenBank数据库中的BLAST(http://blast.ncbi.nlm.nih.gov.Blast.cgi)工具测试以保证其特异性。最终选择线粒体Cytb基因作为检测3种目标鳕鱼、南极犬牙鱼及异鳞蛇鲭的标记基因;选择16S rDNA 基因设计区分鳕科和非鳕科鱼类的引物。所设计的qPCR引物如表2所示。所有引物序列均由上海生工生物有限公司合成。

表2 qPCR的引物Table 2 The primer sequences for quantitative real-time PCR
1.3.3 引物特异性检测 在对3种鳕科鳕鱼(大西洋鳕、太平洋鳕和黑线鳕)及2种非鳕科鱼类(南极犬牙鱼和异鳞蛇鲭)的引物特异性试验中,目标鳕鱼为试验组,其他四种为阴性对照,以无菌双蒸水为模板作空白对照,进行3个平行的qPCR试验。在利用16S rDNA 基因区分鳕科和非鳕科鱼类试验中,上述3种鳕科鳕鱼为试验组,非鳕科品种(南极犬牙鱼和异鳞蛇鲭)为阴性对照,以无菌双蒸水为模板作空白对照,进行3个平行的qPCR试验。
qPCR反应体系为20 μL,包含10 μL TB GreenTMPremix Ex TaqTM反应液、0.3 μL正向引物和反向引物(各10 μmol·L-1)、1.5 μL DNA模板、7.9 μL无菌双蒸水。大西洋鳕鱼,太平洋鳕鱼特异性体系反应条件:95℃预变性30 s;95℃变性5 s,61℃退火30 s,72℃延伸30 s,共40个循环。南极犬牙鱼的反应条件与上述相同,仅退火温度设定为55℃。此外,黑线鳕、异鳞蛇鲭的反应体系及16S rDNA体系反应条件也与上述相同,仅将退火温度设定为58℃。
1.3.4 扩增效率与可靠性 单一鱼肉样品:将各测试鱼类DNA进行10倍连续梯度稀释,分别进行各浓度DNA样品的qPCR试验,每个浓度设置3个平行试验。以目标鳕鱼DNA浓度(ng·μL-1)对数值为横坐标,该浓度对应的平均循环阈值(Ct)为纵坐标,建立各体系的标准曲线。计算曲线的R2值,并根据曲线斜率(slope)得出反应效率:E=[10(-1/slope)-1] ×100%,以此判断每个体系的反应效率和目标DNA 浓度检测区间。
混合鱼肉样品:选取大西洋鳕鱼、太平洋鳕鱼和黑线鳕3种样品,分别对含10%、1%、0.1%、0.01%及0.001%(w/w)目标鳕鱼肉的混合鱼肉样品DNA进行各质量分数的qPCR试验,设置3个平行试验。以质量分数(%)对数值为横坐标,该浓度对应的平均循环阈值(Ct)为纵坐标,构建各特异性体系的标准曲线。并根据曲线斜率(slope)得出反应效率,以此判断每个体系的反应效率和相对浓度检测区间。
1.3.5 市售鳕鱼及鳕鱼深加工制品的检测 qPCR检测:为验证所建立qPCR体系的实际应用性,从当地市场购得13种鳕鱼及鳕鱼深加工制品,试验重复3次。
常规PCR检测:常规PCR反应体系为20 μL,包含10 μL PrimeSTAR Max Premix (2×)反应液、0.5 μL正向引物和反向引物(同qPCR,各10 μmol·L-1)、1 μL DNA模板、8 μL无菌双蒸水。常规PCR反应条件:95℃预变性30 s;95℃变性5 s,59℃退火30 s,72℃延伸30 s,共35个循环。反应结束后取5 μL产物,用1.5%琼脂糖凝胶进行电泳检测。
2 结果与分析
2.1 样品DNA提取
通过紫外可见分光光度计在260 nm波长下测定分析,大西洋鳕鱼DNA的浓度为380 ng·μL-1,太平洋鳕鱼DNA的浓度为470 ng·μL-1,黑线鳕DNA的浓度为345 ng·μL-1,南极犬牙鱼DNA的浓度为465 ng·μL-1, 异鳞蛇鲭DNA的浓度为435 ng·μL-1。
2.2 qPCR体系的优化
通过调整反应退火温度和引物浓度来优化qPCR体系,最终确定大西洋鳕鱼、太平洋鳕鱼特异性体系反应的退火温度为61℃;南极犬牙鱼特异性体系反应的退火温度为55℃;黑线鳕、异鳞蛇鲭特异性反应体系及16S rDNA体系反应的退火温度为58℃;qPCR体系正向引物和反向引物的浓度均为300 nmol·L-1时,能获得较强的荧光信号和较低的检出时间(Ct值)。
2.3 qPCR体系的特异性
通过测试目标物种与其他物种的扩增性能来评估各反应体系的特异性。为区分非特异性扩增,将Ct值小于33的试验结果判定为有效,即阳性扩增。由图1可知,每个体系中对应的目标基因都出现S型扩增曲线(阳性),而非目标基因及空白对照在Ct值小于33时并未出现扩增反应(阴性),表明本研究设计的六组qPCR体系具有较强的特异性。
2.4 qPCR体系的标准曲线分析
针对单一鱼肉样品,将各测试鱼类样品DNA连续梯度稀释后,分别对各浓度样品进行qPCR反应,并根据试验结果评估各反应体系的绝对灵敏度并构建标准曲线。结果显示,大西洋鳕鱼、太平洋鳕鱼和黑线鳕的16S rDNA体系标准曲线(图2-A)斜率分别为-3.174、-3.584、-3.409,对应的扩增效率最低90.11%,最高106.56%,曲线的R2值分别为0.999 6、0.998 3、0.999 0。 品种特异性扩增体系中,大西洋鳕鱼、太平洋鳕鱼、黑线鳕、异鳞蛇鲭和南极犬牙鱼标准曲线(图2-B)的斜率分别为-3.093、-3.399、-3.244、-3.464、 -3.259, 对应的扩增效率分别为110.53%、96.88%、103.36%、102.69%、94.39%,R2值分别为0.991 2、0.999 2、0.999 9、0.999 1、0.997 9。
为了研究各反应体系的相对灵敏度,对含0.001%~10%(w/w)目标鳕鱼肉的混合鱼肉样品DNA分别进行各质量分数样品的qPCR试验。结果显示,16S rDNA体系中大西洋鳕鱼、太平洋鳕鱼和黑线鳕的标准曲线斜率分别为-3.262、-2.649、-2.697(图2-C),对应的扩增效率最低102.56%,最高138.51%,曲线的R2值最低0.992 4,最高0.997 0。品种鉴定特异性扩增试验体系中大西洋鳕鱼、太平洋鳕鱼和黑线鳕的标准曲线的斜率分别为-3.507、-2.954、-2.896(图2-D),对应的扩增效率最低92.81%,最高121.46%,R2值最低0.991 8,最高0.999 6。
上述结果体现出单一样品中模板浓度对数值以及混合样品中质量分数对数值与Ct值之间均存在良好的线性关系,说明所有体系都具有良好的重复性。且扩增效率可以满足qPCR反应的要求,根据建立的标准曲线,可对单一或混合样品中目标鳕鱼的含量进行推算。
2.5 市售鳕鱼及鳕鱼深加工制品的检测
从当地市场购得13种鳕鱼产品(含6种深加工制品),采用本研究建立的qPCR体系进行物种检测,并采用常规PCR方法进行平行检测。由表3可知,13个检测样品中有8个在16S rDNA体系中显示阳性,表明其确实属于鳕科(与产品标签一致),其中挪威北极鳕(9号和10号样品)是大西洋鳕鱼中的一种,是挪威海产局为了强调产地和物种另起的商品名称。13个所测鳕鱼产品中未检出黑线鳕,可能是由于黑线鳕主要销售于英国市场,在国内市场比较少见。深加工样品(2号和6号)中出现大西洋鳕鱼和太平洋鳕鱼同时检出的现象,由于国内市场太平洋鳕鱼价格低于大西洋鳕鱼,因此在加工制品中存在以次充好的现象,但13个检测样品中未出现使用异鳞蛇鲭假冒鳕鱼的情况。此外,1、4、7、8、12号样品产品名称分别为鳕鱼肠、鳕鱼饼、鳕鱼切片、无头鳕鱼和黑鳕鱼,但检测结果发现其不属于常见的大西洋鳕鱼、太平洋鳕鱼和黑线鳕,也不属于鳕科鱼类,该结果与常规PCR检测结果一致(图3),表明市场上可能存在标签造假的现象,但也有可能是鳕形目种类繁多,而本研究中设计的鉴定鳕科的qPCR引物不能全面覆盖。
3 讨论
当前,我国对鳕鱼产品的需求量越来越大,各种鳕鱼产品的掺假问题引起了媒体和消费者的广泛关注。虽然本研究中并未发现异鳞蛇鲭假冒鳕鱼的情况,但利用异鳞蛇鲭等鱼类对鳕鱼进行掺伪的行为在世界各国均有报道[21-23]。除鲜销外,鳕鱼也被加工制成烤鳕鱼片、鳕鱼肠等制品。这对鳕鱼种类鉴定方法的有效性和准确性提出了更高的要求[24-27]。本试验在准确鉴定鳕鱼种类的基础上,建立了检测3种单一鳕鱼样品(大西洋鳕鱼、太平洋鳕鱼及黑线鳕)和混合鱼肉样品中鳕科鳕鱼成分含量的标准曲线,可用于定量分析。
目前qPCR法在肉类物种鉴定中已广泛使用[28-29],主要包括 SYBR Green Ⅰ、Taq Man和Molecular Beacon 3种方法。其中SYBR Green Ⅰ法最为简便,适用性广,适用于目的基因定量分析、基因表达量的研究及物种鉴别,但荧光染料是与体系中的所有双链DNA非特异性结合,结果可能受引物非特异性扩增或二聚体的影响[30]。因此该方法对引物的设计要求比较高。
本研究使用DNAStar软件的MegAlign工具分析比较了不同鳕鱼之间线粒体DNA序列的差异,发现Cytb基因表现出的种内和种间差异高于16S rDNA、12S rDNA及COI基因,而差异最小的为16S rDNA基因。因此,选择16S rDNA基因设计区分鳕科与非鳕科的引物,选择Cytb基因设计鳕鱼种类特异性引物。但本试验所研究的3种鳕鱼的遗传关系较近,Cytb基因差距较小,对引物设计时的高特异性要求有一定的影响。因此,在3种鳕鱼的特异性扩增体系中,当Ct值达到33之后出现了非特异性扩增,于是将反应的截止点设定为33循环,即反应的Ct值大于33时出现的扩增判定为阴性(未检出)。此外,在设计反应体系时,退火温度极为重要,最佳退火温度一般取决于体系中引物的熔解温度(Tm值)[9,31]。本研究采用三步法进行试验,为确保体系的高扩增效率和高特异性,每种引物需要不断调试退火温度。最终确定大西洋鳕鱼和太平洋鳕鱼特异性体系反应的退火温度为61℃;南极犬牙鱼特异性体系反应的退火温度为55℃;黑线鳕,异鳞蛇鲭特异性反应体系及16S rDNA体系反应的退火温度为58℃。
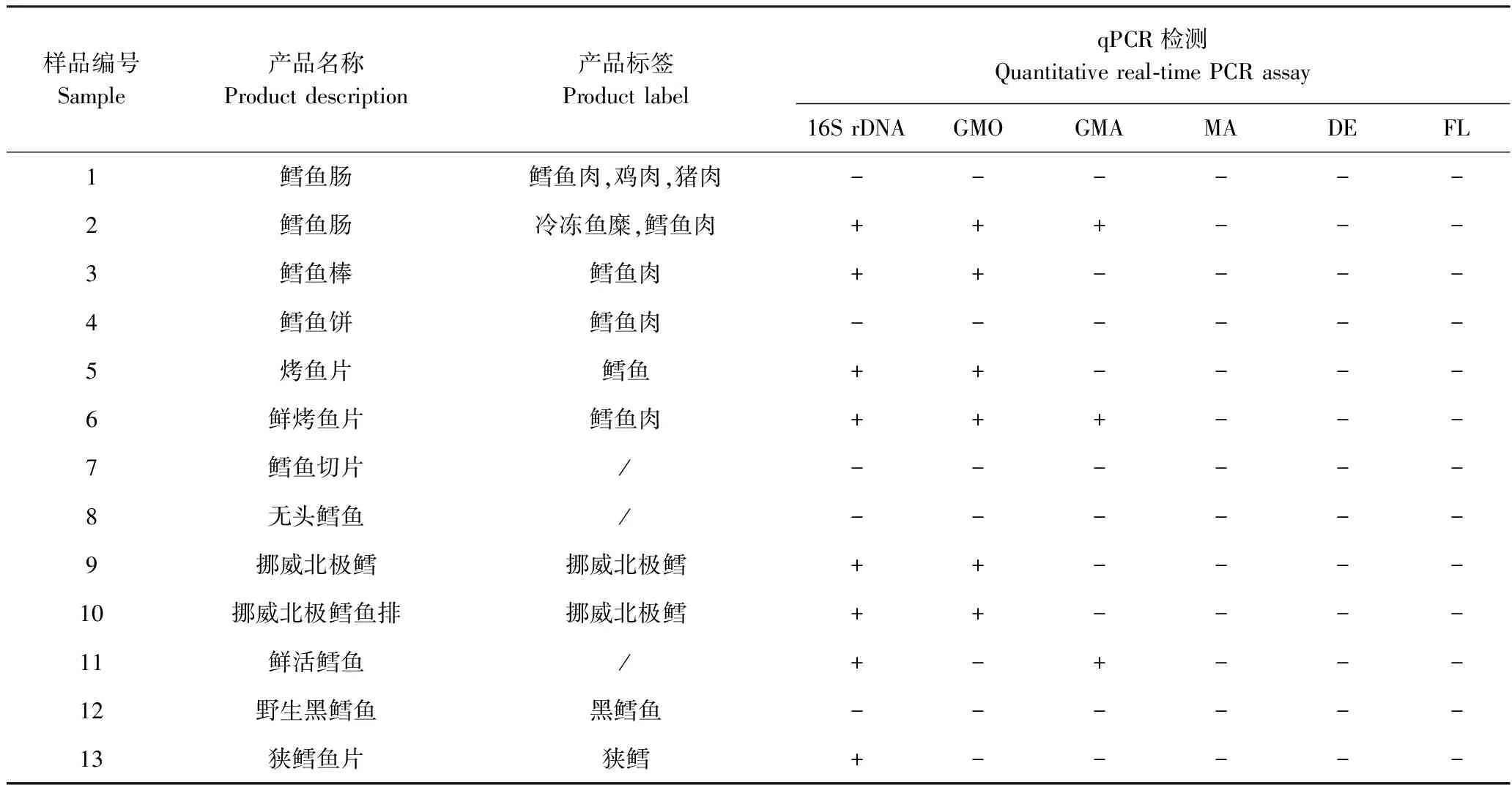
表3 市售鳕鱼产品的qPCR检测Table 3 Detection of commercial cod products by quantitative real-time PCR assays
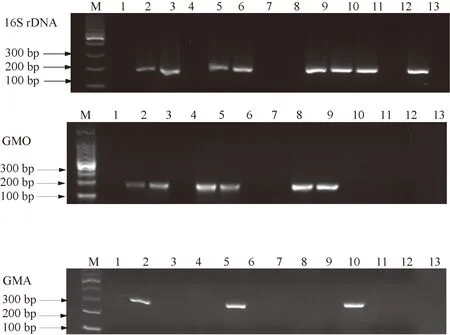
注:M:100 bp DNA marker;1~2:鳕鱼肠;3:鳕鱼棒;4:鳕鱼饼;5:烤鱼片;6:鲜烤鱼片;7:鳕鱼切片;8:无头鳕鱼;9:挪威北极鳕鱼;10:挪威北极鳕鱼排;11:鲜活鳕鱼;12:野生黑鳕鱼;13: 狭鳕鱼片。Note: M: 100 bp DNA marker. 1-2: Cod sausage. 3: Cod stick. 4: Cod cake. 5: Roast fish fillets. 6: Fresh roast fish fillets. 7: Cod fillet. 8: Headless cod. 9: Norwegian Arctic cod. 10: Norwegian Arctic cod steak. 11: Fresh cod. 12: Black cod. 13: Pollock fillt.图3 市售鳕鱼产品的常规PCR检测Fig.3 Detection of commercial cod products by conventional PCR assays
本研究在市售样品检测中发现,有5种样品不属于鳕科。其中,12号样品野生黑鳕鱼学名裸盖鱼,为鲉形目黑鲉科鱼类,其外形与鳕鱼相似,因此也被称为黑鳕鱼。但本研究并未针对裸盖鱼设计品种鉴定引物,因此无法对其是否与标签一致做出判断,只验证了属于鳕科的物种。事实上,“鳕鱼”并不代表任何特定的物种,需要添加“大西洋”或“太平洋”等限定词来确定物种[21]。这些结果表明市场上对海鲜产品缺乏系统的命名,而从为商业欺诈创造了条件。此外,当鳕鱼被制成深加工制品时,会有不良商家以次充好,掺杂价格较低的鳕鱼或者其他肉类,如鸡肉等。在加工过程中,DNA的降解以及反应抑制剂的存在会影响扩增时的Ct值,对正确的物种鉴定造成障碍[32]。而本研究建立的16S rDNA体系能够顺利检测出样品是否含有鳕鱼DNA,利用种类特异性体系能够分区出常见的3种鳕鱼,结合标准曲线,根据Ct值对其中的鳕鱼含量进行定量分析。本研究建立的16S rDNA体系及3种鳕鱼特异性体系在模拟混合样品的相对灵敏度均可达0.01%,通过对13种市售样品的检测,可检测出未加工及深加工产品中的鳕鱼成分,且整个过程能在半个工作日内完成。
4 结论
本研究选择16S rDNA基于设计了针对鳕科鱼类的特异性引物,选择线粒体Cytb基因设计区分常见的3种鳕鱼(大西洋鳕、太平洋鳕和黑线鳕),首次建立了针对黑线鳕的qPCR体系。16S rDNA体系和3种物种特异性体系都具有较强的特异性。在此基础上建立了两套标准曲线,能对单一或混合样品中的目标鳕鱼进行定量检测。通过13种鳕鱼类产品检测表明本研究建立的qPCR体系具有较强的实用性,能满足日常检测的要求。

