薄壳山核桃幼苗对干旱胁迫的生理生化响应
李剑威 晏舒蕾 黄元城 夏晓雪 储凌峰 李财运 王正加
(浙江农林大学亚热带森林培育国家重点实验室培育基地,浙江 杭州 311300)
干旱是全球作物生产力面临的最严重威胁之一[1]。据统计,我国干旱、半干旱地区的面积已达到土地总面积的47%,耕地面积中干旱、半干旱地区占51%,且在其他大部分地区也经常发生不定期的气候干旱[2-3]。薄壳山核桃(Caryaillinoensis),又名美国山核桃、长山核桃[4],是重要的经济干果树种[5],也是重要的用材和绿化树种[6],具有经济、生态和社会的综合效益[7],主要分布在江苏、浙江、安徽、云南、陕西、福建、江西和湖南等地区[8-9]。薄壳山核桃若在生长过程中遭遇干旱胁迫,其生长量和商品性会降低,因此薄壳山核桃能够对特定的自然环境条件做出适应性调节反应已成为其进一步推广和种植的重要前提。
目前,关于干旱胁迫对木本植物生理生化指标影响的研究多集中于杨树[10-11]和桑树[12-13]。研究表明,紫仁核桃会通过增强其叶片超氧化物歧化酶(superoxide dismutase,SOD)和过氧化物酶(peroxidase,POD)活性来响应干旱胁迫[14];新疆野核桃幼苗在干旱胁迫下,其叶片的可溶性糖(soluble sugar,SS)、可溶性蛋白(soluble protein,SP)和游离脯氨酸(proline,Pro)含量均呈上升趋势[15];胡杨叶片气孔密度会随着干旱胁迫程度的增加呈上升趋势[16],但有关薄壳山核桃幼苗对干旱胁迫生理生化响应的相关研究鲜有报道。为此,本试验采用盆栽试验研究干旱胁迫对薄壳山核桃幼苗的生理生化特性的影响,旨在探究薄壳山核桃幼苗的需水规律及耐旱机制,为薄壳山核桃人工栽培及推广应用提供科学依据。
1 材料与方法
1.1 试验材料与试验地概况
供试材料为大小一致、生长健壮的一年生实生薄壳山核桃幼苗(平均株高63.7 cm,平均地径15.2 mm)。幼苗盆栽容器为34 cm×29 cm×23 cm(外口直径×内口直径×高)的塑料花盆(带托盘),每盆装土12.0 kg。所用土壤均为田园土,盆栽土壤的理化性质为pH值5.5,速效钾、有效磷、碱解氮含量分别为95.07、50.00、120.43 mg·kg-1,有机质占比为2.74%,田间持水量为28.73%。
试验地位于浙江农林大学果木园(30°15′N,119°43′E),该地属亚热带季风气候,年均降水量1 613.9 mm,降水日158 d,无霜期年平均为237 d,年平均气温16℃。
1.2 试验方法
栽植苗木后正常供水管理,缓苗生长3个月。2018年7月1日正式开始干旱胁迫试验。参照Hsiao[17]的方法,本试验共设置4个土壤水分梯度处理:1)正常水分处理(CK),土壤水分含量为田间持水量的75% ± 5%;2)轻度干旱胁迫(light drought,LD),土壤水分含量为田间持水量的55% ± 5%;3)中度干旱胁迫(moderate drought,MD),土壤水分含量为田间持水量的35% ± 5%;4)重度干旱胁迫(severe drought,SD),土壤水分含量为田间持水量的15% ± 5%。每个处理3个平行,每个平行3个重复,共36株。试验期间,每天18:00采用称重法适当补水(补充自然流失水分)。干旱胁迫处理后第20、第50天取相同的无病虫害的成熟叶片,于自然光下测定光合参数;并取无病害的叶片用液氮速冻后-80℃保存,用于抗氧化酶活性、渗透调节物质和叶绿素含量的测定;待生理生化指标测定结束后,即干旱胁迫处理后第60天时,对生长指标差异明显的CK和MD两组进行采样,每个处理各3株,在每株树冠同方位、同部位采取健康成熟的叶片,叶片以主脉中部为中心,切成1 mm×3 mm×1 mm大小,戊二醛固定,抽真空,4℃保存,用于观察叶片超微结构。
1.3 测定项目与方法
1.3.1 土壤理化性质测定 根据《测定土壤农业化学分析方法》[18],分别采用电位法、乙酸铵提取法、盐酸-乙酸铵法、碱解扩散法和高温外热重铬酸钾氧化-容量法测定pH值、速效钾含量、有效磷含量、碱解氮含量和有机质含量。
1.3.2 叶绿素含量测定 采用乙醇浸泡的方法提取薄壳山核桃的叶绿素,并用UV-2600分光光度计(日本岛津)测定叶绿素a和叶绿素b含量[19]。
1.3.3 光合参数测定 于晴朗天气的上午9:00-11:00, 采用LI-6800便携式光合测量系统(美国LI-COR公司)测定叶片的光合参数,包括净光合速率(net photosynthetic rate,Pn),气孔导度(stomatal conductance,Gs),蒸腾速率(transpiration rate,Tr)和胞间CO2浓度(intercellular CO2concentration,Ci)。
1.3.4 渗透调节物质含量测定 参照冯芳芳等[20]的方法,采用茚三酮比色法测定Pro含量,采用考马斯亮蓝G-250染色法测定SP含量。
1.3.5 抗氧化酶活性和丙二醛含量测定 参照殷东生等[21]的方法,采用氮蓝四唑(nitro-blue-terazolium, NBT)光还原法测定SOD活性,采用愈创木酚法测定POD活性,采用紫外吸收法测定过氧化氢酶(catalase,CAT)活性。参照王军娥等[22]的方法,采用硫代巴比妥酸比色法测定丙二醛(malondialdehyde,MDA)含量。
1.3.6 超微结构观察 取样品叶片经戊二醛和锇酸溶液双固定后,采用Hitachi SU-8010型扫描电镜(日立高新技术公司)对叶片表皮气孔结构进行观察,每个处理叶片正反面各观察10个视野并拍照;并用Hitachi H-7650型透射电镜(日立高新技术公司)对细胞结构以及叶绿体超微结构进行观察,超薄切片每个处理观察10个视野并拍照。
1.4 数据分析
本试验数据均用均值±标准误差表示,利用SPSS 17.0分析软件中的Duncan’s新复极差法进行差异显著性分析。采用GraphPad Prism 5.01软件制图,Microsoft Excel 2007软件制表。
2 结果与分析
2.1 干旱胁迫对薄壳山核桃幼苗生长的影响
SD的薄壳山核桃幼苗在处理后7 d,叶片出现严重萎蔫,试验终止。干旱胁迫后50 d,薄壳山核桃幼苗的生长情况在不同干旱胁迫程度下表现出一定的差异(表1),CK及LD幼苗生长良好,MD幼苗生长受到抑制,叶片出现枯黄脱落现象。其中,LD幼苗的株高最高(110.33 cm)且地径最粗(22.75 mm),CK的株高和地径较MD分别增加了12.14%、7.29%。结果表明,薄壳山核桃幼苗在中度及重度干旱胁迫条件下株高和地径生长受到明显抑制,幼苗出现落叶现象。
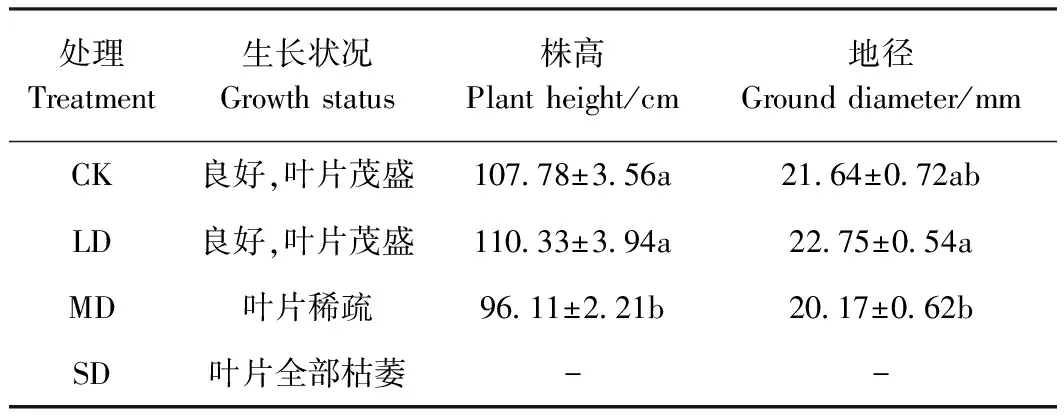
表1 干旱胁迫后50 d薄壳山核桃幼苗生长情况Table 1 Growth of pecan seedlings after 50 days of drought stress
2.2 干旱胁迫对薄壳山核桃幼苗叶片叶绿素含量的影响
由图1-A可知,叶绿素a含量随着干旱胁迫时间的延长呈下降趋势,干旱胁迫50 d时,LD和MD的叶绿素a含量分别较干旱胁迫20 d时下降了42.32%、47.37%;在干旱胁迫50 d时,CK显著高于LD和MD,其含量分别是LD和MD的1.22和1.35倍。由图1-B可知,在干旱胁迫50 d时,CK与LD、MD的叶绿素b含量差异不显著,而LD与MD的叶绿素b含量较干旱胁迫20 d时分别下降了16.00%和39.54%,且干旱胁迫50 d时,LD的叶绿素b含量最高,达到1.14 mg·g-1。 结果表明,干旱胁迫50 d时,随着胁迫强度的增加,薄壳山核桃幼苗叶片的叶绿素含量总体上呈递减的趋势。
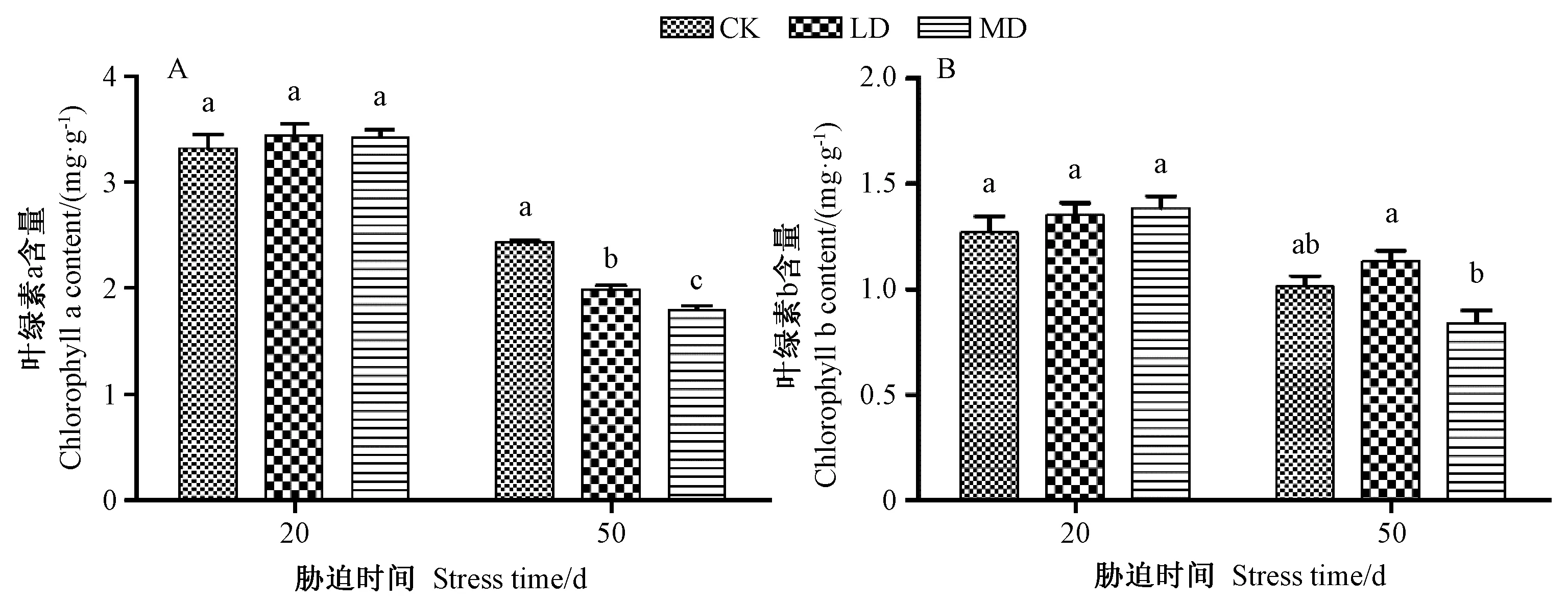
注:不同小写字母表示处理间差异显著(P<0.05)。下同。Note:Different lowercase letters indicate significant difference at 0.05 level among treatment. The same as following.图1 干旱胁迫对薄壳山核桃幼苗叶片叶绿素含量的影响Fig.1 Effects of drought stress on chlorophyll content in leaves of pecan seedlings
2.3 干旱胁迫对薄壳山核桃幼苗叶片光合参数的影响
薄壳山核桃幼苗叶片的Pn、Gs和Tr的变化规律基本一致,即随着干旱胁迫程度增加而逐渐下降(图2-A、B、C),干旱胁迫50 d时,LD和MD的Pn、Gs、Tr分别较CK下降了17.16%和58.42%、61.47%和85.68%、37.96%和68.01%。而CK、LD和MD的Ci差异不显著(图2-D)。表明薄壳山核桃幼苗叶片的Pn、Gs和Tr均受到了干旱胁迫的影响,中度干旱胁迫对光合参数的影响最大。
2.4 干旱胁迫对薄壳山核桃幼苗叶片渗透调节物质含量的影响
由图3可知,在干旱胁迫20 d时,薄壳山核桃幼苗叶片的SP和Pro含量在各水分梯度下差异不显著;在干旱胁迫50 d时,随着干旱胁迫程度的加剧,SP含量和Pro含量均呈逐渐上升趋势,LD和MD的SP含量分别较CK显著增加141.68%和204.17%,MD的Pro含量较CK显著增加了61.15%。表明薄壳山核桃幼苗会通过提高可溶性蛋白和脯氨酸含量来应对干旱胁迫。
2.5 干旱胁迫对薄壳山核桃幼苗叶片MDA含量和抗氧化酶活性的影响
由图4-A、B可知,在干旱胁迫50 d时,随着干旱胁迫程度的增加,薄壳山核桃幼苗叶片的MDA含量和SOD活性均呈逐渐上升趋势。LD与MD的MDA含量分别较CK显著增加165.09%和204.69%;SOD活性在MD达到峰值(367.93 U·mg-1prot),较CK显著增加了37.24%。由图4-C、D可知,在干旱胁迫50 d时,随着干旱胁迫程度的增加,薄壳山核桃幼苗叶片CAT活性呈下降趋势,LD和MD的CAT活性较CK分别显著下降了58.39%和59.72%。干旱胁迫50 d时,LD和MD的叶片POD活性较干旱胁迫20 d分别下降了13.48%和23.44%。结果表明,薄壳山核桃幼苗在干旱胁迫下活性氧(reactive oxygen species,ROS)增多,引发脂质过氧化,MDA含量升高,同时,幼苗会通过提高SOD活性来增强细胞消除ROS的能力。

图2 干旱胁迫对薄壳山核桃幼苗叶片光合参数的影响Fig.2 Effect of drought stress on photosynthetic parameters of leaves of pecan seedlings
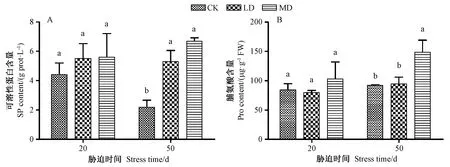
图3 干旱胁迫对薄壳山核桃幼苗叶片渗透调节物质含量的影响Fig.3 Effect of drought stress on the content of osmotic adjustment substances in leaves of pecan seedlings
2.6 干旱胁迫对薄壳山核桃幼苗叶片气孔结构及数量的影响
对比CK和MD,在薄壳山核桃幼苗叶片上表面均未发现气孔,仅在下表面出现气孔(图5-A、B);气孔形态在干旱胁迫下较CK出现差异,CK呈正常开放状态,且开张程度较大,保卫细胞形态趋于饱满(图5-C);而MD呈闭合状态,气孔闭合形式是保卫细胞内侧壁外部闭合,呈现出内陷的形态(图5-D)。
由表2可知,薄壳山核桃受到干旱胁迫后总气孔密度无显著变化,但张开气孔密度与关闭气孔密度发生显著变化,其中CK张开气孔密度达到187 个·mm-2, MD闭合气孔密度达到236 个·mm-2。由此可见,薄壳山核桃幼苗遭遇干旱胁迫时,叶片表皮的关闭气孔密度显著提高,以减少水分的散失,同时干旱胁迫也导致气孔结构发生了变化。
2.7 干旱胁迫对薄壳山核桃幼苗叶肉细胞超微结构的影响
由图6可知,CK的薄壳山核桃叶肉细胞结构和叶绿体结构均较完整,细胞呈条形,叶绿体紧贴壁分布,叶绿体基粒片层堆叠紧密,类囊体排列整齐。但MD的叶绿体与细胞壁脱离,细胞形状变成卵圆形,叶绿体外被呈波浪状,断裂不完整,基粒和基质类囊体模糊不可见,排列混乱,且在细胞内出现大量脂质。由此可见,在干旱胁迫下,薄壳山核桃幼苗叶肉细胞及叶绿体趋于损伤受胁迫状态。

图4 干旱胁迫对薄壳山核桃幼苗叶片MDA含量和抗氧化酶活性的影响Fig.4 Effect of drought stress on MDA content and protective enzyme activities in leaves of pecan seedlings

注:A:CK及MD叶片上表面;B:CK及MD叶片下表面;C:CK气孔结构;D:MD气孔结构。Note: A:Upper surface of blade of CK and MD. B:Lower surface of the blade of CK and MD. C:Stomatal structure of CK. D:Stomatal structure of MD.图5 干旱胁迫对薄壳山核桃幼苗叶片气孔结构的影响Fig.5 Effects of drought stress on stomatal structure of leaves of pecan seedlings

表2 干旱胁迫对薄壳山核桃幼苗气孔数量的影响Table 2 Effect of drought stress on the number of stomata in pecan seedlings
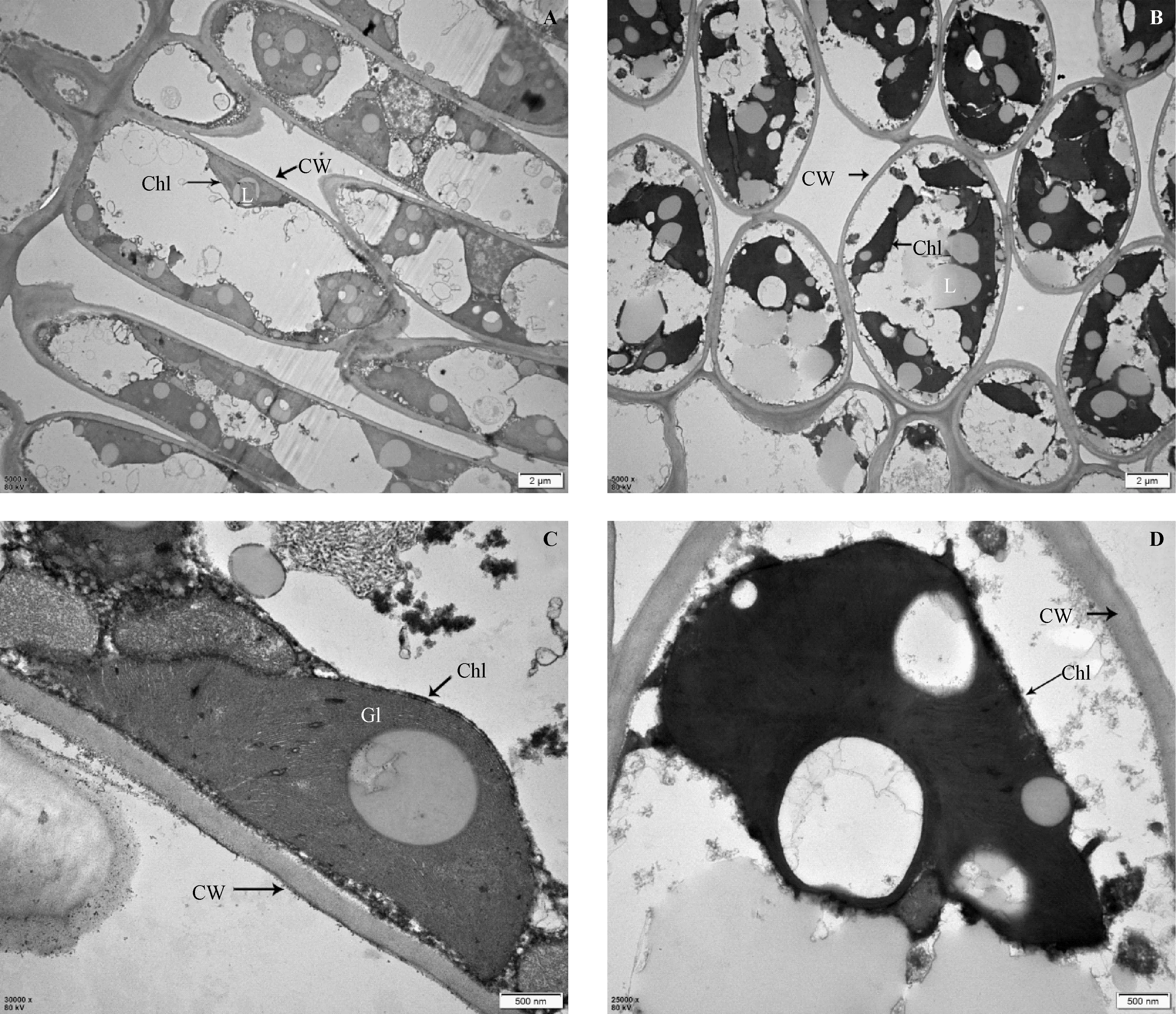
注:A:CK细胞形态;B:MD细胞形态;C:CK叶绿体形态;D:MD叶绿体形态;Chl:叶绿体;CW:细胞壁;Gl:基粒片层;L:脂类。Note: A:Cell morphology of CK. B:Cell morphology of MD. C:Chloroplast morphology of CK. D:Chloroplast morphology of MD. Chl:Chloroplast. CW:Cell wall. Gl: Granum lamella. L:Lipid.图6 干旱胁迫对薄壳山核桃幼苗叶肉细胞超微结构的影响Fig.6 Effect of drought stress on the ultrastructure of mesophyll cells in pecan seedlings
2.8 干旱胁迫下薄壳山核桃幼苗叶片各生理生化指标的相关性
由表3可知,Pn与Gs、Tr呈极显著正相关(P<0.01),相关系数分别为0.923和0.933,但与SP含量、POD活性呈显著负相关(P<0.05);SOD活性与叶绿素a、叶绿素b含量呈显著负相关(P<0.05),与Pro含量呈显著正相关(P<0.05);MDA含量与SP含量呈极显著正相关(P<0.01);SP含量与CAT活性呈显著负相关(P<0.05);叶绿素a含量与叶绿素b含量呈显著正相关(P<0.05)。
2.9 薄壳山核桃幼苗叶片12个主要生理生化指标的主成分分析
根据特征值大于1的原则,通过主成分分析将干旱胁迫下12个生理生化指标转换成4个主成分,可有效反映原12个指标90.150%的信息(表4),理论上达到85%的累计贡献率即可认为具有较强的信息代表性。根据各特征向量的绝对值大小,第1主成分在SP和MDA含量上均有较高的载荷量;第2主成分在Pn、Gs、Tr和POD含量上均有较高的载荷量;第3主成分在叶绿素a含量、叶绿素b含量、SOD活性和CAT活性上均有较高的载荷量;第4主成分在Ci和Pro含量上均有较高的载荷量。可见,薄壳山核桃的抗旱受多因子影响,根据各指标在不同因子上的载荷,综合相关分析确定,MDA含量、Pn、SOD活性、叶绿素b含量、Ci和Pro含量这6个生理指标为干旱反应敏感的生理指标。
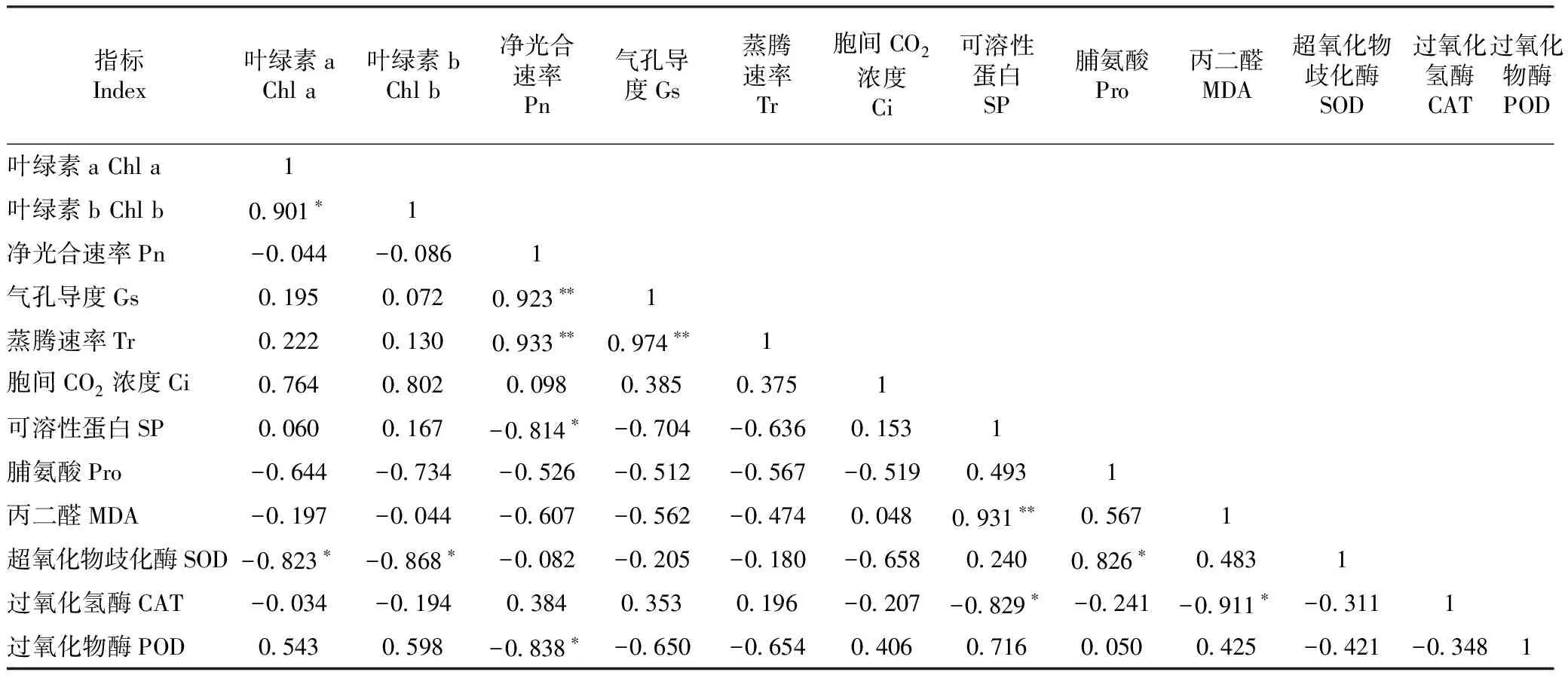
表3 干旱胁迫下薄壳山核桃幼苗叶片各生理生化指标的相关性Table 3 Correlation of physiological and biochemical indexes in leaves of pecan seedlings under drought stress
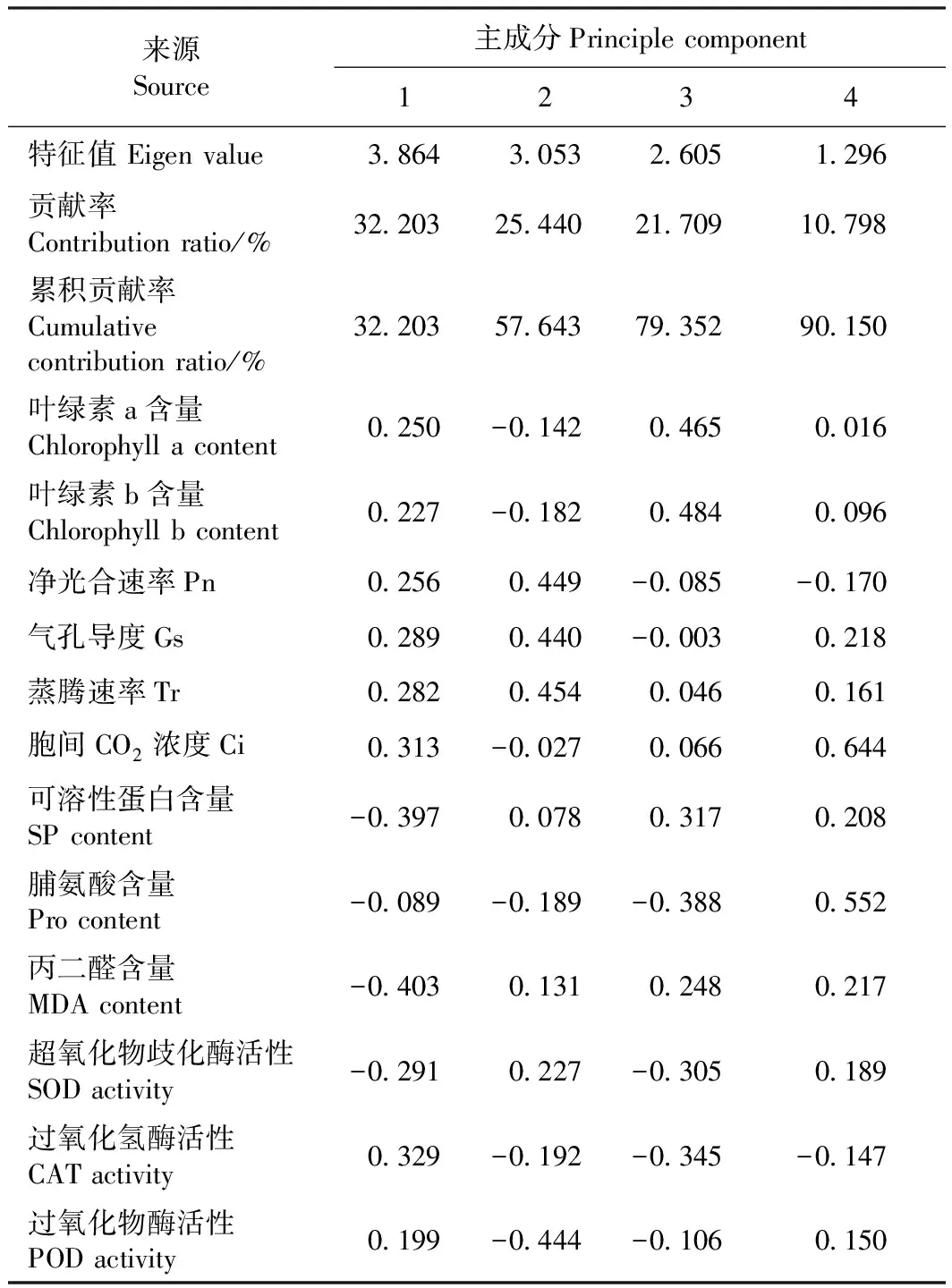
表4 薄壳山核桃幼苗叶片12个主要生理指标的主成分分析Table 4 Principal component analysis of twelve main physiological indexes of pecan seedlings
3 讨论
干旱胁迫对植物造成最明显的影响是抑制其生长[23],表现为植株矮小、叶片加速衰老和脱落等现象[24]。本研究中,重度干旱胁迫下薄壳山核桃幼苗叶片枯萎,继而停止生长甚至死亡。中度干旱胁迫下幼苗出现植株矮小与叶片脱落的现象,这与Diego等[25]发现干旱胁迫会抑制辐射松植物生长的结果相符合。本研究发现,与其他干旱处理相比,薄壳山核桃幼苗在轻度干旱胁迫下长势最好,表现为株高最高和地径最粗,说明适当的干旱处理能起到“炼苗”的作用,有利于幼苗的生长,这与刘世鹏等[24]发现适当胁迫有利于枣树组培苗分蘖以及吕亮雪等[26]发现轻度土壤干旱处理有利于多年生落花生生长的研究结果相似,但具体作用机理有待进一步探究。
本试验中,薄壳山核桃幼苗叶片Pn在干旱胁迫后大幅下降,同时叶绿素a和叶绿素b含量也随着干旱胁迫时间的延长和干旱程度的增加呈下降趋势,这与沙棘[27]、香樟[28]的研究结果一致,干旱胁迫引起幼苗光合速率下降的同时,光合电子传递受阻使过剩电子形成活性氧[29],导致叶绿素含量的变化;另一方面,干旱胁迫引起叶片气孔大量闭合,导致气孔导度的下降,这也是Pn下降的原因之一[30],而Ci无显著变化,此时可能非气孔限制已成为光合速率降低的首要原因[31]。此外,干旱胁迫下叶绿体产生的活性氧会破坏叶绿体的膜结构、基粒和基质类囊体,并使其功能丧失[32],导致幼苗Pn下降。而轻度胁迫下幼苗叶片叶绿素b含量最高,叶绿素的降解速度较缓慢,Pn较高,幼苗长势较好,这与轻度胁迫的幼苗的生长状态相适应。
植物主要通过积累渗透调节物质[33]和提高抗氧化酶活性[34]来应对干旱胁迫不断产生的ROS。荣少英等[35]对甜高粱幼苗的研究表明,Pro和SP是重要的渗透调节物质。本研究中,中度干旱胁迫下薄壳山核桃幼苗的Pro和SP含量迅速上升以应对胁迫,干旱胁迫50 d时,SOD活性随干旱程度的增加呈上升趋势,因此SOD对薄壳山核桃抵御干旱胁迫有积极作用。中度干旱胁迫50 d时,幼苗的CAT活性低于对照,且POD活性较干旱胁迫20 d下降,说明干旱的强度及持续时间超出植物所能忍受的范围会导致抗氧化酶活性下降[36]。
4 结论
薄壳山核桃幼苗会通过积累渗透调节物质、提高抗氧化酶活性和关闭气孔等方式来应对干旱气候条件。薄壳山核桃幼苗在轻度干旱胁迫下长势最好,中度干旱胁迫下叶片叶绿体结构破损严重,重度干旱胁迫会导致幼苗死亡,故应保证种植地土壤含水量处于田间持水量的50%~60%,若低于田间持水量的30%~40%应及时补充水分以满足幼苗的生长需要。结合对12个与抗旱相关的生理指标进行主成分分析,证明了叶片光合参数以及渗透调节物质含量等生理指标与薄壳山核桃生理抗旱密切相关,可作为薄壳山核桃抗旱性鉴定提供理论依据。本研究为薄壳山核桃品种人工栽培及推广应用提供了理论基础。

