红细胞药物递送系统的研究进展
杨根生,金陈浩,徐书敏,杨庆良,郭钫元,欧志敏
(浙江工业大学 药学院,浙江 杭州 310014)
恶性肿瘤是对人类健康和生命有重大威胁的疾病。化学治疗作为全身药物治疗手段,是目前针对无法通过手术切除或药物等手段治疗的转移性恶性肿瘤的主要治疗方式,但传统化疗药物缺乏对肿瘤的特异性,毒副作用大,患者长期化疗也极易产生多药耐药性(MDR)[1]。构建基于肿瘤靶组织或靶细胞的特异性药物递送系统是实现肿瘤精准治疗的重要方式,能够在提高药物疗效的同时减少抗肿瘤药物的毒副作用,因此也是药剂学领域的研究热点。在微纳米技术的快速进步之下,该技术被广泛应用于药物递送的微纳米药物制剂领域,比如:微乳、微球、聚合物胶束、纳米粒、脂质体等可一定程度地提高化疗药物的血浆半衰期,改善药物体内分布,控制释药速度,并降低药物的系统毒性[2-3]。例如:钱俊青等[4]研究发现,杨梅素脂质体和杨梅素相比,具有更长体内循环时间和更高的药效;王文喜等[5]将米诺地尔制备成米诺地尔脂质体纳米粒,具有较好的生物相容性和缓释性能。
递药系统在循环系统中极易在调理素作用下发生调理作用,被单核吞噬细胞系统(MPS)快速清除[6],从而导致生物利用度低等问题,同时可能诱导人体产生超敏反应。虽然,常见的聚乙二醇(Poly ethylene glycol, PEG)作为一种亲水性聚合物,用来修饰以解决纳米粒生物相容性问题,就如洪伟勇等[7]研究表明:HCPT的PEG-PHDCA纳米囊泡能显著延长药物的体外释放时间和体内半衰期,甚至已有几种产品达到临床应用条件,但是这一策略已被广泛应用于人们的日常消费品中,导致在人类体内产生其特异性抗体[8],类似如此的缺陷极大限制了微纳米药物在临床上生物应用。因此,探索低免疫原性的新型纳米给药系统、提高药物靶向效率成为抗肿瘤药物递送领域具有巨大应用价值的研究课题。红细胞作为新型药物载体具有极高的生物相容性、超长的半衰期、低免疫原性和靶向性等独特的优势[9-10],可以显著降低免疫相关反应,提高药物的生物利用度。近年来,这些优点使其成为仿生抗肿瘤药物递送系统的研究热点。笔者综述了近年来红细胞药物递送系统的研究进展,系统阐述了细胞膜载药的原理、方法以及优缺点。
1 红细胞的特点
红细胞(Red blood cell, RBC)是人体血液中数量最多、寿命最长的一种细胞,同时也是人体内运送氧气的最主要的媒介[11],其比表面积较大,并且具有极强的流动可塑性特性,这两种特性有利于细胞发生形变和物质互换。
1.1 具有极高的生物相容性
红细胞膜的生物相容性高于其他传统载体系统。因此,通过使用自体红细胞的方法,不会引起血液凝集和机体排异反应。此外,凭借红细胞的可生物降解性,它适用于药物载体本身及其膜为药物的涂层[12],提高药物的生物利用度。
1.2 超长的半衰期
研究[13]表明:与其他药物载体相比,人源红细胞的生命周期很长(大约为120 d)。就生命周期而言,鼠源红细胞虽然比人源红细胞的短(大约为50 d),但在某种程度上仍然具有长周期[14]。因此用红细胞载药可极大地保护并降低药物在体内的被巨噬细胞吞噬的速度,使药物尽可能到达目标部位。
1.3 低免疫原性
近几年,Gao等[15]研究发现:RBC-AuNPs凭借RBC的膜以及相关蛋白,使AuNPs不被巨噬细胞吞噬。在此类模型中,红细胞膜变成很多个“空心球”,成功包裹药物,防止一些内源性因素的干扰而造成药物的分解和失效,增加药物在体内的稳定性,并且减少蛋白质、核酸等外源性大分子引起的免疫反应,故能克服人体自身的免疫排斥作用,有利于药物全身治疗的应用。
1.4 精准靶向递送
目前,精准靶向治疗一直是药物研发及抗肿瘤领域不断前进和研究的方向。研究表明:红细胞膜表面具有一定的可修饰性,且通常使用化学方法,但具有潜在的化学变性风险。在研究中,研究人员通常使用理想的靶向配体进行表面修饰,例如:有研究团队开发了一种脂质插入方法,其中靶向基团先栓在脂质分子上,然后插入红细胞膜[16]。2015年,Gao等[17]就通过收集红细胞膜,用物理挤压方法制备红细胞膜涂层纳米粒子(CCNPs),在肿瘤部位明显增强了药物结合和吸收。另外,红磁性(SPIO)纳米粒子已被临床用作MRI造影剂多年,Antonelli等[18]通过对药物进行红细胞的包裹,到达了两种作用,一种是靶向治疗作用,另一种是延长造影剂的时间的作用。这些技术对红细胞膜伪装药物的精准治疗具有借鉴意义。
2 红细胞膜内载药研究
依据上述红细胞膜独一无二的特性及优势,海内外已展开诸多深入研究。这类新型仿生递送系统的研究对恶性肿瘤的靶向治疗具有重大意义。膜内载药能很好控制药物在体内的代谢速度和降低药物毒性,现已发展有众多包载方法。
研究报道表明:药物分子进入细胞内腔的方法主要有物理方法[17]和化学方法[19]。目前,研究中出现红细胞膜囊泡包载药物等新型载药方法[20],提高了载药量,包载效率较高。
2.1 物理方法
2.1.1 低渗膨胀法
低渗膨胀法[21]是目前最常用最简便的方法。该法是利用成熟的红细胞在低渗条件下,细胞发生膨胀,变为球状,孔道打开,药物进入红细胞,再通过高渗溶液关闭孔道,进而完成药物包封[22]。例如,在报道中,Wu等[23]采用低渗法制备红细胞药物,将氧化铁纳米粒子成功加载到RBCs。
2.1.2 电脉冲法
电脉冲法是主要的物理包载方法。该法是通过将红细胞放在脉冲电场中,瞬时红细胞膜被高电压击穿,细胞膜被瞬间打开,打开后药物流入红细胞。与2.1.1节所述方法不同,细胞外渗透压差对该法影响不大,即使细胞外存在高浓度的生物活性物质,也可以通过此法进入细胞内。但是要使药物进入细胞必须要控制好电压:电压过小,击不穿细胞膜,药物无法流入细胞内腔;电压过大很容易击穿并导致细胞凋亡[24]。
2.2 化学方法
化学扰动是主要的化学包载方法。该法的原理是通过化学物质对红细胞膜发生作用,同时利用细胞膜的物质互换的通道,从而增强细胞膜的渗透能力,使药物分子能够进入到细胞内部。此法最大的优点就是能最大程度减小对红细胞的伤害,极大可能地保存细胞膜的完整性,且胞内物质不易渗出[25],例如细胞穿透肽能够穿透细胞膜,因此,一些大分子物质常常被负载到细胞穿透肽上,共同进入到细胞内腔。
2.3 新型包埋技术
近年来,随着多学科的发展与研究的深入,出现多种新型药物包埋技术。研究人员利用新型技术结合和已有仪器的组装自制包载设备。例如:有团队为了合成RBC-NPs,通过脂质体挤压仪机械挤出将洗涤干净的红细胞膜与聚乳酸-羟基乙酸共聚物(PLGA)纳米颗粒融合得到的RBC-NPs,呈现核-壳结构[26]。2019年,Lee等[27]收集红细胞膜微囊气泡,使用微型挤出机使产生的红细胞膜泡通过孔径为400 nm和200 nm聚碳酸酯膜挤出。89Zr标记的纳米颗粒与细胞膜泡混合,然后挤出通过200 nm聚碳酸酯膜至少10 次,以获得最终的RBC-NPs。最近,还有研究人员采用超声的方法,纳米粒和膜在超声波的作用下,自发形成核-壳纳米结构[22]。另外,结合快速混合和电穿孔的微流体系统已成功用于在磁性纳米颗粒外涂覆RBC膜。设备由Y形合并通道、S形混合组成通道和出口前的电穿孔区。通过调节脉冲电压和时间,以及流速,制备稳定性较强的红细胞膜纳米粒[28]。表1为RBCs膜内载药技术例子。
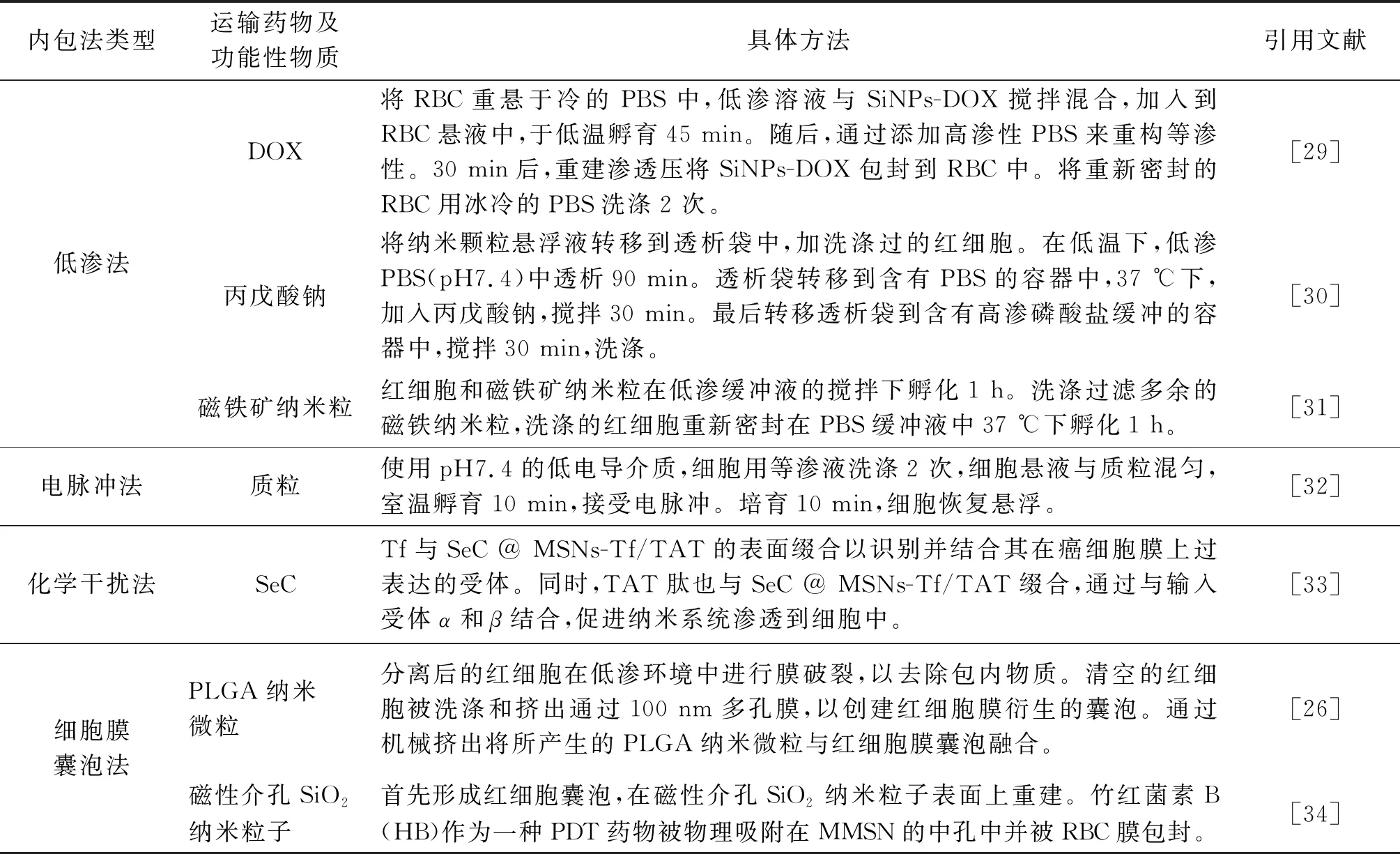
表1 RBCs膜内载药技术例子Table 1 Examples of drug-loading technology in erythrocyte membrane
3 红细胞膜外载药研究
红细胞的双凹结构,为载药提供大的比表面积,不但可以负载各种小分子化合物,而且能装载蛋白质、核酸等大分子化合物,并且其膜流动性为在通过窄毛细管时提供了更好的柔韧性[35]。
研究表明:Gao等[17]采用人细胞系MDA-MB-435细胞膜包被的纳米粒,比单独的PLGA纳米粒摄取效果强很多;Sun等[36]在2015年通过结合光治疗和药物治疗的特点,利用红细胞为药物载体,设计了一种靶向控释载药系统应用于肿瘤治疗。表2为RBCs膜外载药技术例子。

表2 RBCs膜外载药技术例子Table 2 Examples of erythrocyte membrane surface drug-loading technology
4 基于红细胞药物递送体系构建的新探索
近几年,红细胞除了用来包载小分子和一些大分子药物以外,还用来探索基因工程RBC[40],非基因工程RBC和RBC膜包覆生物纳米粒子,因其在多种生物医学领域具有重大作用,在研究红细胞膜给药系统的创新尤为重要。
最新研究中,Han等[13]通过造血干细胞的遗传修饰,使RBC可以在细胞表面或胞质溶胶中显示多种治疗性蛋白质,使其能治疗各种癌症、自身免疫性疾病和其他罕见疾病。在Shi等[41]研究的另一项工作中,利用遗传工程改造红细胞前体后,产生了在其膜上表达分选酶可修饰蛋白的RBC。这些RBC可以在不损害体内细胞的前提下,通过分选酶催化反应用各种功能探针进行标记。除了膜表面的修饰,结合外部设备进行精准靶向治疗也是一个思路,Wan等[42]基于红细胞制备了仿生纳米载体系统,得到具有较高光热效应的DIRAs,用于ICG和DOX的共同加载和控制释放,结合PTT/PDT和化疗能更加有效地治疗乳腺癌。
目前看来,虽然红细胞载药系统有很大的潜在价值,但是仍有很多的困难[43-45]需要克服:这些仿生结构的潜在免疫原性仍可能造成不理想的副作用和安全问题,包括在膜提取或与纳米颗粒融合期间可能发生膜锚定片段(例如,蛋白质,聚糖等)的构象变化,这可以被认为是激活免疫应答的入侵者。值得注意的是,当将模拟病原体的纳米颗粒设计为刺激适应性免疫应答的疫苗时,适度的免疫原性可能对人类健康有益。
5 结 论
总体来说,RBCs作为新型药物载体具有生物相容性好、半衰期长、免疫原性低以及靶向性强等特性,发展潜力巨大,特别是在RBCs表面连接药物或靶向受体。同时,对于癌症的治疗也有极大的研究意义。此外,虽然此载体系统有特别明显的优势,但是仍然有一些问题需要解决:1) RBCs的活性会受到载药过程及药物自身的影响;2) 红细胞载药量不理想,对于治疗有所限制;3) RBCs存在大量提取、运输和存放等问题。因此,现阶段有一些研究正在尝试克服这些问题,包括仿生膜的出现,探究新的载药方法,提高载药量等措施。另外,这些问题的存在和膜仿生结构独特的优越性必将随着科学的发展而呈现美好的前景,在抗肿瘤等医药领域发挥更大的作用。

