肝癌分子靶向治疗的现状与展望
田大治 张炜琪 蒋文涛
1天津市第一中心医院肝移植科300192;2天津医科大学一中心临床学院300070
0 引 言
原发性肝癌在全球恶性肿瘤发病率中排名第五,也是恶性肿瘤相关死亡的第二大常见原因。肝细胞肝癌(hepatocellular carcinoma,HCC)是原发性肝癌最常见的类型,占原发性肝癌的80%~90%。多种因素均与HCC 的发生有关,包括过量饮酒、乙型肝炎病毒(hepatitis B viruses,HBV)感染、丙型肝炎病毒(hepatitis C viruses,HCV)感染、黄曲霉素暴露等[1]。为有效治疗HCC,针对其发生发展的机制研究一直以来备受关注。近年来诸多研究结果表明,各类细胞因子,如血管内皮生长因子(vascular endothelial growth factor,VEGF)、成纤维细胞生长因子(fibroblast growth factor,FGF)、转化生长因子-α(transforming growth factor-α,TGF-α)以及胰岛素样生长因子-Ⅱ等在HCC 的发生发展过程中发挥着重要作用,所涉及的分子通路包括Ras/Raf/MAPK、Wnt/β-Catenin、JAK/STAT、PI3/AKT/mTOR、泛素-蛋白酶体等[1]。针对这些分子及通路的分子靶向药物也成为肝癌研究的热点。值得注意的是,HCC 是血供较为丰富的实体肿瘤,滋养血管的生成在其发生发展中起着重要作用[2]。另有研究结果表明,与滋养血管生成相关的VEGF 在组织中的表达水平随肝癌的进展而逐渐升高[3]。因此,靶向抑制VEGF 的抗血管生成药物在HCC 的靶向治疗中扮演着重要角色。此外,近年来免疫检查点的发现极大促进了HCC 免疫治疗的进展,针对程序性细胞死亡蛋白1(programmed cell death protein 1,PD-1)及其配体(programmed cell deathligand 1,PD-L1)和细胞毒性T 淋巴细胞相关抗原4(cytotoxic T lymphocyte-associated antigen 4,CTLA-4)的免疫检查点抑制剂应运而生,且对于药物的联合应用也在不断探索中。本文对肝癌分子靶向治疗的研究进展进行综述,为推动临床肝癌分子靶向治疗的开展提供参考。
1 抗血管生成药物
1.1 索拉非尼
2007 年美国食品药品监督管理局(Food and Drug Administration,FDA)批准了索拉非尼对终末期HCC 的临床应用,拉开了HCC 临床分子靶向治疗的序幕。索拉非尼是一种口服酪氨酸激酶抑制剂(tyrosine kinase inhibitor,TKI),可通过下调Raf/MEK/ERK 通路来抑制肿瘤细胞增殖,同时还可通过抑制血管内皮生长因子受体(vascular endothelial growth factor receptor,VEGFR)1-3 及血小板衍生生长因子受体-β 来抑制血管生成[4-5]。大范围的Ⅲ期临床试验(SHARP 试验)结果证实,索拉非尼能显著延长晚期HCC 的进展时间(time to progression,TTP)和总体生存期(overall survival,OS)[4],随后的Asia-Pacific 试验也得到了同样结果[4](表1)。值得注意的是,在对SHARP 试验的探索性亚组分析中,HCV 阳性患者的中位OS 为14 个月,而服用安慰剂的患者的中位OS 为7.4 个月,且在TTP(7.6 个月比2.8 个月)和客观缓解率(objective response rate,ORR)(44.2%比29.6%)方面也取得了明显改善[6]。该结果表明,索拉非尼对HCV 感染的HCC 似乎效果更佳,此后的一项荟萃分析也得到了相同结果[7]。但相关机制尚不清楚。
作为晚期肝癌的一线治疗药物,索拉非尼虽在一定程度上延长了患者的生存期,但患者平均生存期仍不足1 年,且部分患者对其不良反应无法耐受,因此索拉非尼单一治疗的临床收益并不十分令人满意。若能提高疗效并更好地管理其不良反应,可能会取得更好的结果。索拉非尼联合经导管动脉化疗栓塞或放射治疗等局部治疗取得了比索拉非尼单一治疗更好的OS 和无进展生存期(progressionfree survival,PFS)[8-9]。最近的研究结果显示,在HCC治疗中,采用小干扰RNA 敲除α7nAChR 可增强索拉非尼的抗肿瘤活性[10]。因此在未来的临床实践中,索拉非尼联合小干扰RNA 敲除α7nAChR 有望进一步提高索拉非尼的疗效。
1.2 乐伐替尼
乐伐替尼也是一种TKI,可以选择性地抑制VEGFR1-3、成纤维细胞生长因子受体(fibroblast growth factor receptor,FGFR)1-4、血小板衍生生长因子受体-α、RET 和cKIT。文献报道,长期暴露于索拉非尼可增加肝癌细胞对索拉非尼的耐药性,并伴有FGFR1 的上调,而FGF 作为一种促血管生成因子被认为能诱导肿瘤细胞逃避抗VEGF 治疗[11]。与索拉非尼相比,乐伐替尼具有抗FGFR1-4 活性,这被认为是其抗肿瘤作用优于索拉非尼的关键机制之一[12]。由于乐伐替尼可双重抑制VEGF 和FGF,故可能会减少治疗期间耐药的发生。乐伐替尼还具有一定的免疫调节活性[13],提示其与免疫治疗存在联合应用的可能。
REFLECT 试验结果显示,在未经治疗的晚期不可切除的肝细胞肝癌(unresectable hepatocellular carcinoma,uHCC)患者中,乐伐替尼对肿瘤的抑制效果不劣于索拉非尼[14](表1)。与索拉非尼相比,乐伐替尼在PFS、TTP、ORR 等次级终点上均有显著改善,且两组患者3 级及以上不良反应的发生率相似。在针对OS 的亚组分析中,患者无论是按种族还是按有无血管侵犯进行分层,乐伐替尼组获得的OS均明显优于索拉非尼组,尤其是对于血清甲胎蛋白>200 ng/ml 的患者,该优势更为显著(10.4 个月比8.2 个月)[15]。基于REFLECT 试验结果,乐伐替尼成为继索拉非尼之后十余年来第一个被批准用于晚期uHCC 的一线治疗药物。对于我国晚期肝癌患者来说,与索拉非尼相比,使用乐伐替尼能获得更长的中位OS(14.7 个月比10.4 个月),且在HBV 感染亚组中也显示出同样优势(14.4 个月比10.2 个月)[12]。由此可见,与索拉非尼不同的是,乐伐替尼对于HBV相关HCC 患者的疗效更佳,也更符合我国肝癌的特征[16]。乐伐替尼正逐步成为我国晚期肝癌的临床一线首选分子靶向治疗药物。
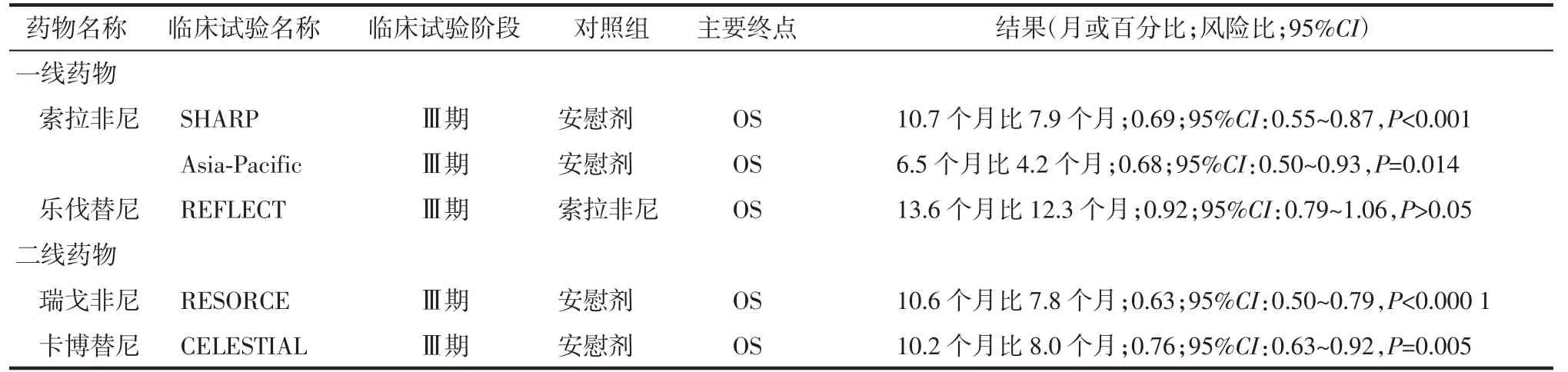
表1 部分抗血管生成药物的临床试验结果
1.3 瑞戈非尼
索拉非尼虽提高了晚期肝癌患者的中位OS,但其单药临床疗效尚不完全令人满意。对于索拉非尼治疗期间或治疗后出现肿瘤进展的患者,仍需新的二线分子靶向药物作为支持。瑞戈非尼是在调整索拉非尼分子结构以优化其疗效的过程中发现的一种多靶点TKI[17]。其化学结构及作用机制与索拉非尼相似,在血管生成、肿瘤发生、肿瘤转移和肿瘤免疫中也发挥着重要作用[18]。但与索拉非尼相比,瑞戈非尼的作用范围更广,对VEGFR、cKIT、TIE-2 以及SHP-1 的抑制作用更强[19]。
Ⅲ期RESORCE 试验结果显示,对于索拉非尼治疗期间病情进展的HCC 患者,与安慰剂相比,瑞戈非尼可显著延长患者的中位OS、PFS 和TTP(表1),并使患者死亡风险降低,在包括地理区域和病因学在内的各亚组分析中均观察到了相似的患者获益[20]。因此,瑞戈非尼被批准成为第一个用于索拉非尼治疗期间或治疗后进展的uHCC 患者的二线治疗药物。与索拉非尼相似,瑞戈非尼最常见的3 级或4 级不良反应也是高血压(15%)、手足皮肤反应(13%)、腹泻(3%)和乏力(9%)。然而,上述Ⅲ期RESORCE试验纳入的患者均为肝功能Child-Pugh A 级,且必须能耐受索拉非尼,此纳入标准可能降低了严重不良反应的发生率,且对于肝功能严重受损的患者能否安全使用瑞戈非尼尚不清楚。此外,RESORCE 试验结果还发现,第1 个治疗周期中出现手足皮肤反应的患者,其OS 延长更为显著[19]。
1.4 卡博替尼
新近研究结果表明,在抗血管生成药物治疗过程中或治疗后,受体酪氨酸激酶MET 和AXL 的表达上调,不仅增加了肿瘤局部侵袭和远处转移的风险,同时还参与了HCC 抗血管生成药物耐药性的产生,被认为与HCC 患者的不良预后相关[21-24]。卡博替尼是一种针对MET、AXL、VEGFR1-3 等的TKI,在血管生成、肿瘤发生、侵袭及转移等过程中发挥抑制作用[25]。Ⅲ期CELESTIAL 试验结果证实了卡博替尼在晚期肝癌治疗中的有效性和安全性[23](表1),因此卡博替尼获得了欧洲药品管理局及美国FDA的批准,用于治疗曾接受索拉非尼治疗的HCC 患者。
在CELESTIAL 试验的患者纳入标准中,对肝功能要求仍是Child-Pugh A 级,但与RESORCE 试验不同的是,其允许纳入对索拉非尼不耐受的患者。最终结果显示,CELESTIAL 试验的OS(10.2 个月)、ORR(4%)、PFS(5.2 个月)及治疗持续时间(3.8 个月)均与RESORCE 试验(分别为10.6 个月、6%、3.1 个月、3.6 个月)无明显差异。因此,虽然瑞戈非尼和卡博替尼均被批准作为索拉非尼耐药后的二线用药,但卡博替尼可用于索拉非尼不耐受的患者。CELESTIAL 试验中卡博替尼组3 级或4 级不良反应的发生率几乎为安慰剂组的两倍(68%比36%),且与RESORCE 试验相比,卡博替尼因治疗相关不良反应停药或减剂量应用的情况似乎更常见,表明其潜在的毒副作用可能较瑞戈非尼大[22]。由此可见,对于一般状态较差的HCC 患者,使用卡博替尼或许更需慎重。成本效益分析结果表明,对于索拉非尼耐药的HCC 患者来说,虽然能从卡博替尼治疗中获益,但其经济成本更高[26]。因此,无论是为了提高疗效、减少不良反应还是降低医疗成本,如何选择卡博替尼的最佳受益人群显得尤为关键。从卡博替尼对MET 阳性肝癌的疗效来看,MET 似乎是其选择最佳受益人群的一个潜在生物学标志,但仍需进一步的研究证明。
2 免疫检查点抑制剂
免疫检查点是表达在B 细胞、T 细胞、NK 细胞等免疫细胞上的膜结合分子,可抑制T 细胞的过度激活,充当激活T 细胞的“刹车”作用,从而抑制过度激活T 细胞反应。而肿瘤细胞可通过表达免疫检查点相关分子来抑制T 细胞的激活,逃脱机体的免疫监视。PD-1 和CTLA-4 是目前研究最多的具有临床意义的检查点分子[27-28],已针对它们开发出了纳武单抗、派姆单抗、卡瑞利珠单抗、曲美目单抗和伊匹木单抗等多种免疫检查点抑制剂,为晚期肝癌患者的免疫治疗提供了新选择。其中纳武单抗被批准为一线用药,派姆单抗为二线用药。遗憾的是,两者的Ⅲ期临床试验均未达到预期结果[29-30]。曲美目单抗、伊匹木单抗等CTLA-4 抑制剂的单一治疗效果有限,与其他治疗联合应用可能成为未来的发展方向。最近我国学者进行的卡瑞利珠单抗Ⅱ期临床试验取得了成功[31]。卡瑞利珠单抗有望成为我国第一个获批用于晚期肝癌的PD-1 抑制剂。
2.1 PD-1/PD-L1 抑制剂
相关研究结果表明,在HCC 中,Kupffer 细胞和CD8+T 细胞高水平表达的PD-1 和PD-L1 参与肿瘤细胞免疫逃逸,并与较差的预后相关[32]。此外,PD-1的表达上调与肝硬化向HCC 的进展有关[33]。这些研究结果为PD-1/PD-L1 抑制剂用于肝癌的免疫治疗提供了理论依据。
2.1.1 纳武单抗
纳武单抗是第一个获得美国FDA 批准用于索拉非尼治疗失败后晚期HCC 患者的二线免疫疗法,也是目前被认为最有前景的免疫检查点抑制剂。纳武单抗是一种能与PD-1 受体结合的人免疫球蛋白G4(immunoglobulin G4,IgG4)单抗,可阻断PD-1 和PD-L1 间的相互作用,增强效应T 细胞活性,从而产生持久和显著的抗肿瘤效果[34]。纳武单抗已被批准用于晚期黑色素瘤、转移性非小细胞肺癌、HCC 等多种恶性肿瘤[28]。在Ⅰ/Ⅱ期CheckMate 040 研究中,纳武单抗在晚期HCC 的治疗中展现出较好的临床效果(表2),且对于之前未接受治疗的HCC 患者,纳武单抗实现了23%的ORR 和82%的9 个月OS[35]。因此,美国FDA 加速批准了纳武单抗用于索拉非尼耐药的HCC 患者。然而,在一线治疗的Ⅲ期研究(CheckMate 459)中,与索拉非尼对照组相比,纳武单抗治疗组的OS 虽有提高,但两组间差异并不明显(表2)[30]。
2.1.2 派姆单抗
与纳武单抗类似,派姆单抗也是一种针对PD-1的高选择性人源化单克隆IgG,可通过阻断PD-L1与PD-1 之间的相互作用来抑制免疫检查点所产生的免疫抑制调节信号[36]。派姆单抗的Ⅱ期研究(KEYNOTE-224)结果显示,17%的受试者实现了客观应答,TTP 为4.9 个月,并实现了12.9 个月的中位OS 和良好的耐受性[37]。基于此,美国FDA 加速批准派姆单抗用于接受过索拉非尼治疗的HCC 患者的二线治疗。遗憾的是,与CheckMate 459 研究一样,在派姆单抗作为二线药物治疗晚期肝癌患者的Ⅲ期临床试验(KEYNOTE-240)中,与安慰剂组相比,虽然派姆单抗组的中位OS 及PFS 均有所提高(表2),死亡风险降低了22%,但差异仍未达到预期[29]。尽管如此,该结果仍证明了派姆单抗在晚期肝癌治疗中的潜在价值,并进一步支持了派姆单抗用于晚期肝癌的二线治疗[15]。目前,派姆单抗的另一项Ⅲ期KEYNOTE-394 试验正在我国开展,期待取得有价值的研究结果。
2.1.3 卡瑞利珠单抗
卡瑞利珠单抗是由苏州盛迪亚生物医药有限公司开发的一种人源化高亲和力IgG4-κ 单抗,已被证明可阻断PD-1 与PD-L1 的结合,从而抑制肿瘤细胞的免疫逃逸。2019 年5 月,卡瑞利珠单抗首次在我国获得批准,用于治疗之前至少接受过两次系统化疗的复发或难治性经典霍奇金淋巴瘤患者。目前该药物还被研究用于治疗包括HCC 在内的多种恶性肿瘤[38]。最近,我国学者开展的一项旨在评估卡瑞利珠单抗在晚期HCC 预处理患者中的抗肿瘤活性和安全性的Ⅱ期临床试验取得了成功[31]。这有可能使卡瑞利珠单抗成为继瑞戈非尼之后在我国获得批准的晚期肝癌二线治疗药物。
2.2 CTLA-4 抑制剂
CTLA-4 是另一种重要的免疫检查点分子,可通过与抗原提呈细胞表面表达的B7-1(CD80)/B7-2(CD86)配体结合发出抑制信号来阻断T 细胞的激活[39-41]。有研究结果发现,肝癌来源的调节T 细胞(regulatory T cell,Treg)可通过CTLA-4 依赖的方式,下调树突状细胞(dendritic cell,DC)表面共刺激分子CD80/CD86 的表达,并抑制DC 产生肿瘤坏死因子-α 和白细胞介素-12。阻断CTLA-4 则可增强DC介导的免疫反应,并拮抗Treg 对DC 的抑制作用。因此,通过抑制CTLA-4 来阻断Treg 介导的免疫抑制可达到抗肿瘤的目的[42]。
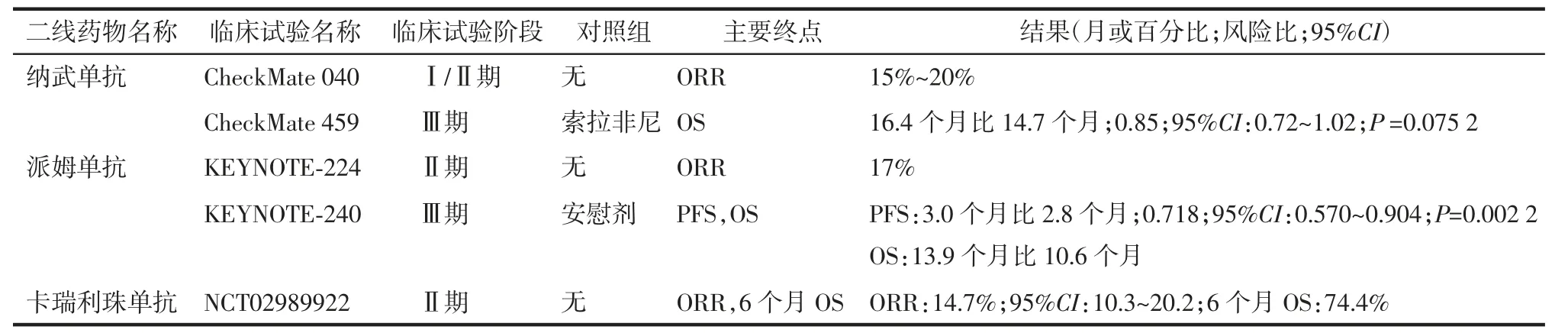
表2 部分免疫检查点抑制剂的临床试验结果
曲美目单抗是一种针对CTLA-4 的人源IgG2单抗,可通过抑制B7-CTLA-4 介导下调T 细胞活化,从而发挥抗肿瘤作用[41,43]。在一项HCV 相关HCC 的Ⅱ期临床研究中,Sangro 等[41]使用曲美目单抗作为单一疗法,观察到中位TTP 为6.48 个月,中位OS 为8.2 个月,ORR 为17.6%,疾病控制率高达76%,从而证明了曲美目单抗在HCC 中的抗肿瘤活性。另外,在该试验中,还观察到大多数患者在随访至少3 个月后出现病毒载量下降。因此,曲美目单抗可能既有抗肿瘤作用,又有抗HCV 作用。随后Duffy 等[43]的研究结果证明,对于接受索拉非尼治疗后的晚期HCC 患者群体,采用曲美目单抗联合消融治疗能取得更好的疗效。值得注意的是,该试验还纳入了5 例病毒抑制状态的乙肝患者,在试验过程中均未发现病毒重新激活。在上述两项关于曲美目单抗的试验中,阻断CTLA-4 均未导致病毒载量升高,相反似乎具有一定的抗病毒作用,其机制值得进一步的探索。
3 展 望
近年来,肝癌分子靶向药物发展迅速,为晚期肝癌患者提供了多种治疗选择,但总体临床收益仍不理想。生物标志物可用于确定特定的最佳受益人群,减少不必要的不良反应,同时提高经济效益。目前,各类肝癌相关的分子靶向治疗均无良好的生物标志物。另外,部分药物与其他抗肿瘤手段的联合应用已取得了不错的临床疗效,值得进一步深入研究。探索新的肿瘤治疗靶点如集落刺激因子-1 及其受体、CD47,共抑制受体如LAG-3、T 细胞免疫球蛋白黏蛋白-3 和TECH 等,并开发出针对这些靶点的特异性药物将为肝癌的临床治疗带来更多新选择。
利益冲突所有作者均声明不存在利益冲突

