胰岛素腹腔注射对2型糖尿病KKAy小鼠异常血脂调节的影响
夏婷 高关心 夏慧琳 孙洪范 俞兰 都莉娜 孙佳慧 杨诗钰 常洁
1内蒙古自治区人民医院医学工程处,呼和浩特010017;2中国医学科学院生物医学工程研究所,天津市生物医学材料重点实验室,天津300192;3内蒙古医科大学计算机信息学院,呼和浩特010110
0 引 言
2019 年,世界卫生组织发布全球十大健康威胁,其中包含糖尿病的非传染性疾病位列名单第2 项,糖尿病已发展成为严重影响人类健康的疾病。2 型糖尿病患者的胰岛素分泌紊乱、糖脂代谢异常,会对全身多组织、多器官造成损害。有研究结果指出,胰岛素分泌异常或胰岛素抵抗致使来源于血糖的脂肪过多地储存于肝细胞内,进而产生脂肪肝,同时体内脂肪分解加速、合成减少,血浆中脂质增多,从而加重2 型糖尿病[1-4]。此外,肥胖与胰岛素抵抗、2 型糖尿病之间关系密切[5-8]。2 型糖尿病及胰岛素抵抗导致体内糖脂代谢紊乱,血脂含量改变促进或加重2 型糖尿病的发展,而肥胖进一步加重胰岛素抵抗,严重影响了患者的身体健康。
相关研究结果发现,与皮下注射相比,腹腔注射胰岛素对2 型糖尿病模型KK 小鼠具有更好的血脂调节能力[9]。KKAy 小鼠来源于KK 小鼠,但编码基因不同,由a/a 纯合子变异为Ay/a 杂合子,且KKAy小鼠也具有代谢异常综合征,包括肥胖和高血糖等。决定KKAy 小鼠发展为糖尿病的主要因素有遗传和环境两方面,与2 型糖尿病的发展途径相似[10]。为明确胰岛素腹腔注射对2 型糖尿病KKAy 小鼠异常血脂调节的影响,本研究对2 型糖尿病KKAy 小鼠进行胰岛素腹腔注射治疗,并在治疗中期转为皮下注射,观察注射方案改变对小鼠体质量、血糖及血脂的影响,并与实验期间全程皮下注射组进行对比。
1 材料与方法
1.1 主要材料与仪器
基础饲料(江苏省协同医药生物工程有限责任公司),高脂高糖饲料(北京华阜康生物科技股份有限公司),生物合成人胰岛素注射液[诺和诺德(中国)制药有限公司,300 IU/3 ml(笔芯)],重组甘精胰岛素注射液[甘李药业股份有限公司,300 IU/3 ml(笔芯)],甘油三酯(triglyceride,TG)测试盒、总胆固醇(total cholesterol,TC)测试盒、高密度脂蛋白胆固醇(high-densitylipoproteincholesterol,HDL-C)测试盒、低密度脂蛋白胆固醇(low-density lipoprotein cholesterol,LDL-C)测试盒(南京建成生物工程研究所)。
健康清洁级C57BL/6J 雄性小鼠6 只,5 周龄,体质量范围26.5~32.6 g,购于内蒙古医科大学实验动物中心,许可证号SCXK(蒙)2015-0001;健康无特定病原体级KKAy 雄性小鼠21 只,5 周龄,体质量范围26.3~33.5 g,购于北京华阜康生物科技股份有限公司,许可证号SCXK(京)2014-0004。实验前小鼠均采用基础饲料喂养,室温20~25 ℃,相对湿度45%~55%,自由饮水。
DA-3 血糖仪及试纸(三诺生物传感股份有限公司),Elx808 IU 全自动酶标仪(美国Bio-Tek 公司),TP1020 生物组织自动脱水机、RM2235 石蜡切片机(德国Leica 公司),TB-718 生物组织自动包埋机、TK-218Ⅱ恒温摊片烤片机(湖北泰维科技实业股份有限公司)。
1.2 方法
1.2.1 2 型糖尿病小鼠模型的建立及实验分组
(一)2 型糖尿病小鼠模型的建立
采用高脂高糖饲料喂养KKAy 小鼠,待小鼠出现多饮多尿、毛发油腻等症状,且所测随机血糖值≥13.9 mmol/L 时表明2 型糖尿病模型建模成功。
(二)实验分组
将建模成功的KKAy 小鼠随机分为3 组:腹腔注射组(n=6)、皮下注射组(n=6)和发病未治疗组(n=3)。同时选取健康C57BL/6J 小鼠作为正常组(n=6),健康KKAy 小鼠作为未发病组(n=6)。
1.2.2 胰岛素治疗方案
按照实验分组进行胰岛素注射治疗,治疗分为两个阶段。其中,发病未治疗组、正常组和未发病组不予注射。
第一阶段为期6 周,腹腔注射组和皮下注射组分别进行胰岛素腹腔和皮下注射。两组均每天注射5 次,第1 次与第2 次注射间隔0.5 h,第2 次与第3 次注射间隔3.5 h,其余注射时间点间隔均为4 h。两组均在第1 次注射重组甘精胰岛素注射液(腹腔注射组:0.250 IU/g;皮下注射组:0.125 IU/g),其余时间点均注射生物合成人胰岛素注射液(腹腔注射组:0.125 IU/g;皮下注射组:0.075 IU/g)。
第二阶段为期4 周,腹腔注射组和皮下注射组均进行胰岛素皮下注射,注射方案与第一阶段皮下注射相同。
治疗期间除未发病组小鼠喂食基础饲料外,其余组小鼠均喂食高脂高糖饲料。
1.2.3 检测指标
每两周测量小鼠体质量1 次;采集小鼠尾尖血,血糖仪测定空腹血糖和餐后2 h 血糖,并采用对应的试剂盒测定血清中的TG、TC、HDL-C 和LDL-C 含量。治疗结束后,取小鼠肝脏组织,经固定、常规脱水、透明、浸蜡、包埋、切片后进行苏木精-伊红染色,并采用Image-Pro Plus 6.0 软件对图像进行分析。
1.3 统计学方法
采用SPSS19.0 统计学软件处理数据,符合偏态分布的计量资料以中位数(四分位数间距)[M(QR)]表示,组间比较采用非参数检验(Kruskal-Wallis检验),以P<0.05 为差异具有统计学意义。
2 结 果
2.1 体质量变化情况
在建立动物模型前,各组小鼠的体质量约30 g。由表1 可知,腹腔注射组改变注射方案对小鼠体质量无明显影响,且各组小鼠治疗第6 周与第10 周的体质量差异均无统计学意义(均P>0.05)。
2.2 血糖变化情况
2.2.1 空腹血糖
由表1 可知,腹腔注射组改变注射方案对小鼠空腹血糖无明显影响,对比未发病组发现,在整个治疗过程中腹腔注射组小鼠空腹血糖控制良好;治疗第10 周正常组小鼠空腹血糖值出现升高的现象,且与第6 周相比差异具有统计学意义(P<0.05);发病未治疗组小鼠空腹血糖值从第6 周起降至正常范围。
2.2.2 餐后2 h 血糖
由表1 可知,腹腔注射组改变注射方案对小鼠餐后2 h 血糖无明显影响,与上述空腹血糖结果类似,在整个治疗过程中腹腔注射组和皮下注射组小鼠餐后2 h 血糖均控制良好;发病未治疗组小鼠餐后2 h 血糖值持续较高。
2.3 血脂变化情况
2.3.1 TG
如表2 所示,腹腔注射组改变注射方案对小鼠血清TG 含量无明显影响,治疗第10 周小鼠血清TG 含量与第6 周比较差异无统计学意义(P>0.05),但治疗累积效果导致治疗第10 周小鼠血清TG 含量低于治疗第2 周,差异具有统计学意义(P<0.05),且治疗第10 周腹腔注射组的血清TG 含量与未发病组相近;皮下注射组结果也证明,全程皮下注射胰岛素可明显降低血清TG 含量(P<0.05)。
2.3.2 TC
如表2 所示,腹腔注射组改变注射方案对小鼠血清TC 含量无明显影响,注射方案改变前后血清TC含量差异无统计学意义(P>0.05);治疗前6 周,与发病未治疗组相比,腹腔注射组和皮下注射组均在一定程度上降低了血清TC 含量,且皮下注射组优于腹腔注射组;但在治疗第10 周,腹腔注射组和皮下注射组小鼠血清TC 含量仍明显高于未发病组。
2.3.3 HDL-C
如表2 所示,腹腔注射组改变注射方案对小鼠血清HDL-C 含量影响较大,腹腔注射治疗后血清HDL-C 含量大幅升高,治疗第6 周的血清HDL-C含量高于治疗第2 周(P<0.05),并与未发病组相近,亦高于同期皮下注射组和发病未治疗组;改变注射方案后,腹腔注射组的血清HDL-C 含量降低,治疗第10 周的血清HDL-C 含量与治疗第2 周相比差异无统计学意义(P>0.05),并与同期皮下注射组相近。
2.3.4 LDL-C
如表2 所示,腹腔注射组改变注射方案对小鼠血清LDL-C 含量影响较大,腹腔注射治疗后血清LDL-C 含量大幅降低,治疗第6 周的血清LDL-C 含量低于治疗第2 周(P<0.05),并与未发病组相近,亦低于同期发病未治疗组和皮下注射组;改变注射方案后,腹腔注射组的血清LDL-C 含量大幅升高,治疗第10 周的血清LDL-C 含量高于治疗第6 周(P<0.05),并与同期皮下注射组相近。
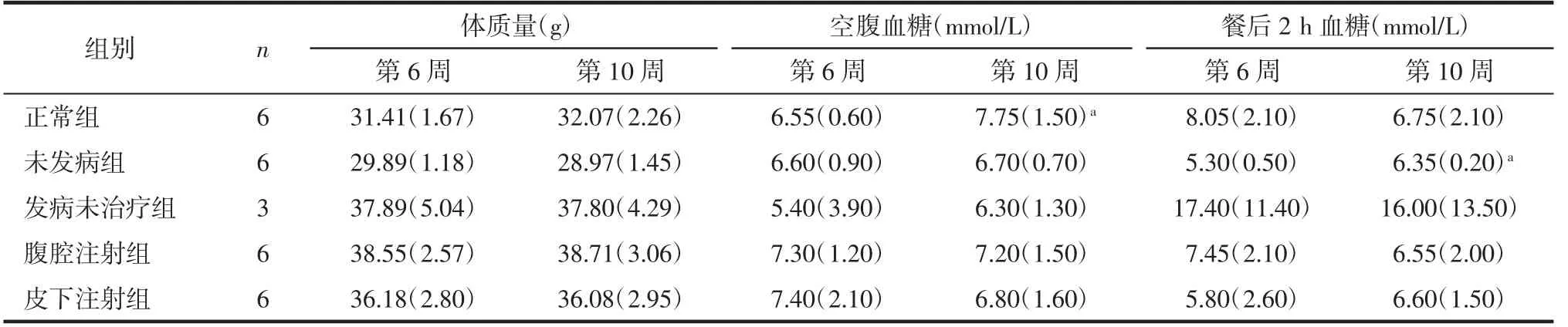
表1 不同治疗阶段各组小鼠的体质量及血糖变化[M(QR)]
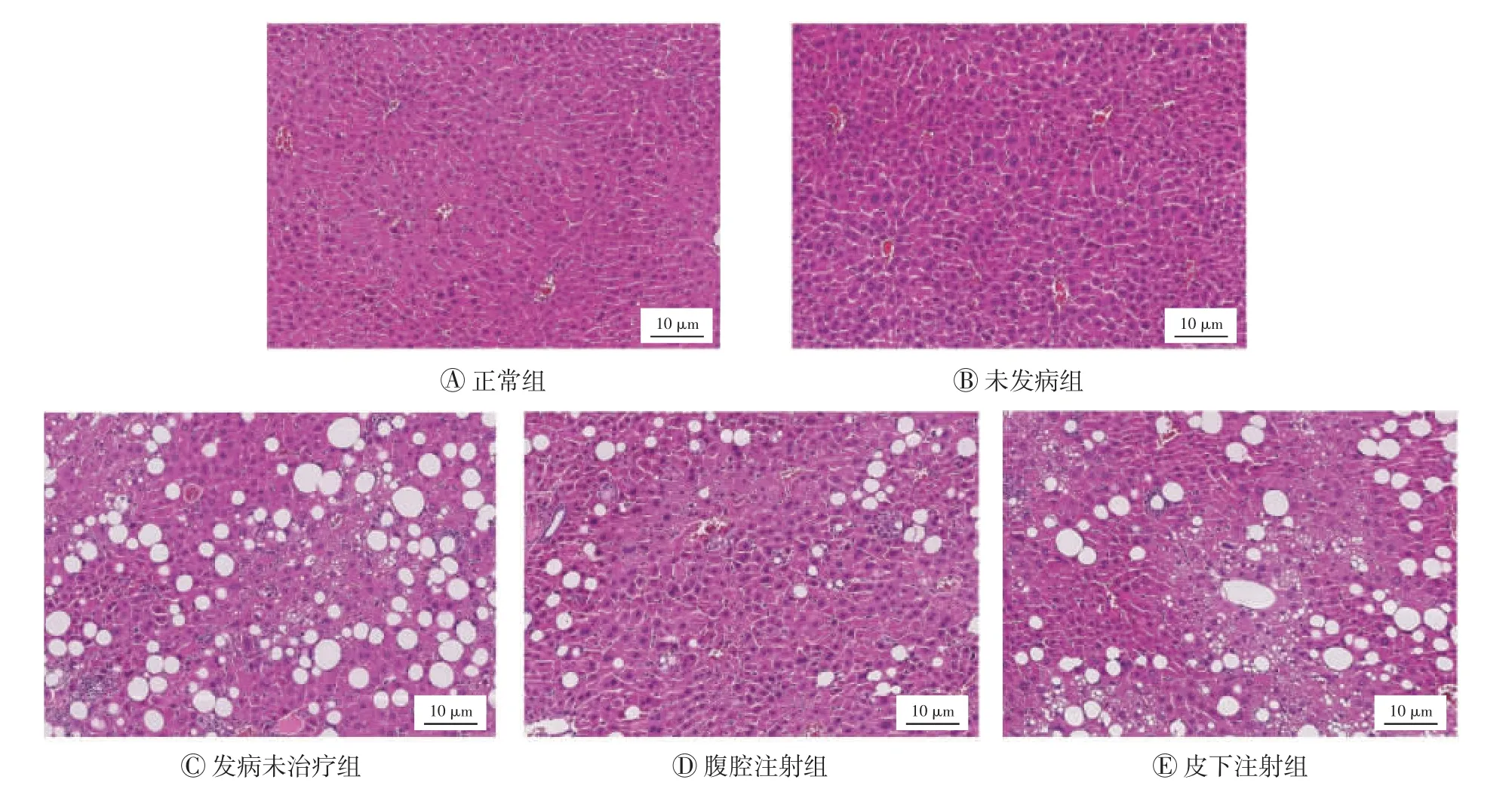
图1 治疗10 周后各组小鼠肝组织的苏木精-伊红染色结果
2.4 肝脏切片的苏木精-伊红染色结果
如图1 所示,正常组和未发病组小鼠肝组织结构清晰,肝细胞排列整齐紧密,无脂肪空泡及明显异常;发病未治疗组小鼠肝组织出现大范围的脂肪空泡,空泡面积占总面积的17.0%,窦状隙结构完全不清晰,肝细胞体积变大,甚至部分肝细胞形态消失;腹腔注射组和皮下注射组结果介于正常组、未发病组与发病未治疗组之间;腹腔注射组小鼠肝组织出现脂肪空泡,空泡面积占总面积的6.1%,窦状隙结构较清晰,肝细胞体积变大;皮下注射组小鼠肝组织亦出现脂肪空泡,且数量较多,空泡面积占总面积的11.3%,窦状隙结构不清晰,肝细胞体积变大,可见大范围坏死病灶。
3 讨论与结论
伴有肥胖症状的2 型糖尿病是一种难以治愈的代谢疾病,其涉及的糖脂代谢紊乱也是引发心脑血管疾病、脏器损伤等并发症的潜在原因,表现为TG、TC 和LDL-C 含量升高,HDL-C 含量降低[11]。造成糖脂代谢紊乱的主要原因之一是胰岛素抵抗,而肥胖也是导致胰岛抵抗加重的主要原因[12]。因此,改善胰岛素抵抗是纠正糖脂代谢紊乱的方法之一。
胰岛素皮下注射对血糖具有较好的调控作用,但对于改善胰岛素抵抗、纠正血脂异常的作用较小[13]。研究人员认为胰岛素皮下注射后外周胰岛素浓度升高,脂肪分解氧化受到抑制,使得游离脂肪酸含量降低,从而在一定程度上改善了血脂代谢异常。但胰岛素皮下注射可能引发医源性高胰岛素血症,导致肝脏脂蛋白酯酶活性降低,HDL-C 含量降低,LDL-C 含量升高[11]。这些研究结果在本研究中亦有所体现,即胰岛素皮下注射组的TG 含量降低,但HDL-C 含量亦降低,LDL-C 含量升高。
胰岛素腹腔注射在稳定血糖的前提下,对血脂调控具有不同结果。本研究中腹腔注射组分阶段执行胰岛素腹腔注射和胰岛素皮下注射。完成第一阶段的腹腔注射方案后,血脂检测结果显示腹腔注射对HDL-C、LDL-C 和TG 具有调节作用。在对KKAy小鼠体质量和血糖无影响的条件下,腹腔注射组进行第二阶段的胰岛素皮下注射,对比同组胰岛素皮下注射前后的效果发现,HDL-C 和LDL-C 数据发生反弹,证明了胰岛素腹腔注射对HDL-C 和LDL-C的有效调节作用。分析其原因如下:①不同于皮下注射,胰岛素腹腔注射可有效模拟正常生理条件,确保肝脏胰岛素浓度大于外周血胰岛素浓度,进而改善胰岛素抵抗,纠正糖代谢异常,为恢复脂代谢正常提供基础[14-16]。②胰岛素腹腔注射可刺激合成胰岛素样生长因子-1,促进脂肪细胞的脂肪分解,提高胰岛素的敏感性和利用率,从而改善胰岛素抵抗[17-18]。因此,胰岛素腹腔注射对于改善脂代谢异常具有一定作用,但关于胰岛素腹腔注射改善胰岛素抵抗、调节血脂紊乱的机理,尚需进一步的研究证明。同时,本研究中各组小鼠肝脏病理切片的苏木精-伊红染色结果提示,与皮下注射相比,胰岛素腹腔注射对脂肪肝形成具有更强的抑制作用,值得进一步的深入研究。
此外,本研究选取了两种不同遗传背景的健康小鼠作为对照,即KKAy 小鼠(未发病组)和C57BL/6J 小鼠(正常组),通过与治疗组和发病未治疗组比对,可多维度地探讨治疗效果。对比发病未治疗组和未发病组发现,高脂高糖饲料可促进KKAy 小鼠发病。对比正常组和未发病组发现,饲料对KKAy 小鼠发病影响较大。C57BL/6J 小鼠(正常组)喂食高脂高糖饲料第6 周血糖维持正常,血清中TC、TG、LDL-C和HDL-C 含量均未见明显改变,但第10 周小鼠空腹血糖、TC、TG 指标变化明显,差异均具有统计学意义(均P<0.05)。由此可见,短期内高脂高糖饮食对正常机体的糖脂代谢不会产生影响,但长期高脂高糖饮食会破坏正常的糖脂代谢。有文献报道,皮下注射胰岛素可降低2 型糖尿病KK 小鼠的血清TC 含量[11]。而本研究结果发现,在给药期间(10 周内),腹腔注射和皮下注射胰岛素对2 型糖尿病KKAy 小鼠血清TC 含量的调控作用较小,这可能与KKAy 小鼠持续高脂高糖饮食及其肥胖特征相关。
综上所述,本研究对具有肥胖特征的2 型糖尿病KKAy 小鼠进行胰岛素腹腔注射治疗,并在治疗中期改变胰岛素注射方案,发现胰岛素腹腔注射对促进HDL-C 升高和LDL-C 降低具有积极作用,对TG 降低亦具有一定作用,这为具有肥胖特征的2 型糖尿病的治疗提供了新思路。
利益冲突所有作者均声明不存在利益冲突

