不同低氧胁迫方式构建SD大鼠高原肺水肿模型的比较研究
林 雪,雷有芳,蒲小燕
(青海大学医学院基础医学部,西宁 810016)
高原肺水肿(high altitude pulmomary edema,HAPE)是指机体快速(24~72 h内)暴露于高原低氧环境后,急性缺氧导致肺毛细血管内皮细胞和肺泡上皮细胞受损,通透性增加,进而产生以肺间质或肺泡水肿为基本病理特征的急性高原疾病,临床表现为心慌、胸闷、咳嗽、呼吸困难、咳粉红色泡沫痰、肺部湿啰音和发绀等,该病危害性大,严重时可危及生命[1-2]。由于HAPE的发病机制复杂,目前其发病原因仍不清楚[3-4],可能与海拔高度、环境温度、运动强度及机体的适应与重塑有关[5-6],但至今仍无一种制作HAPE模型的标准方法。因此,本课题组通过不同的低氧胁迫方式构建重现性较高的HAPE大鼠模型,为后期的疾病研究创造基础条件。
1 材料与方法
1.1 实验分组及模型构建
SPF级雄性SD大鼠60只,体质量200±2 0 g,购自西安交通大学医学部实验动物中心[SCXK(陕)2019-0001]。所有大鼠随机分为3组:(1)对照组,饲养于四川大学华西医院科技园区科研基地动物实验楼(海拔4 0 0 m)[SYXK(川)2018-119];(2)低压氧舱组,于青海大学医学院高原医学研究中心低压氧舱室,先模拟海拔6 000 m低氧胁迫48 h后,立即降至3 500 m进行动物实验;(3)实地低氧组,于青海省玛多县人民医院(海拔4 200 m)低氧胁迫28 d后,立即进行动物实验。每组20只。实验期间,3组动物的饲养环境均达到如下要求:SPF环境饲养,温度为20~26 ℃,相对湿度为40%~70%,自由进食饮水(饮水瓶的瓶口加钢珠)。所有大鼠用45 mg/kg戊巴比妥钠进行腹腔麻醉,取仰卧位固定于实验台,手术部位备皮消毒,待大鼠无角膜反射及收缩反应后,进行下述实验操作。实验中所涉及处理动物的操作均按照国家相关法规要求执行。
1.2 血气及血管组织病理检测
切开大鼠腹部皮肤及肌肉层,暴露腹腔背侧面,分离腹主动脉,用PresetBM动脉采血器(美国BD公司产品)抽取全血1 mL,通过Sysmex全自动血气分析仪分析腹主动脉血氧分压及氧饱和度;分离右颈外静脉,结扎远心端,用动脉夹夹住近心端,挑起颈外静脉,气管插管行机械通气后,使用PowerLab生理记录仪观察压力波形的变化。将导管缓慢插入上腔静脉到右心房,可见小的压力波形,继续将导管插入右心室,记录右心室压力曲线。再将导管在右心室血流的作用下送入肺动脉,通过压力传感器采集肺动脉压力,并记录数据。
1.3 肺组织含水量测定
以断颈法迅速处死大鼠后,取左肺上叶,用吸水纸吸去组织表面水分,电子天平称湿重,记为W1;恒温烘干箱55 ℃烤72 h至恒重,称干重,记为W2。根据Elliot公式计算肺组织含水量=(W1-W2)/W1×100%。
1.4 肺组织HE染色后显微结构检测
以断颈法处死大鼠后,取右肺下叶组织,大小5 mm×5 mm×5 mm,漂洗后用4%多聚甲醛溶液(编号BL539A,日本TaKaRa公司产品)固定。常规石蜡包埋,制成5 µm厚的石蜡切片后,用HE染色试剂盒染色(编号G1120,日本TaKaRa公司产品),光学显微镜(型号CX-21,日本Olympus公司产品)放大400倍后观察各组大鼠肺组织的形态结构变化。
1.5 肺组织超微结构检测
取右下肺尖处肺组织,切成1 mm3小块,固定于2.5%戊二醛溶液即Gluta固定液(编号P1126,日本TaKaRa公司产品)中,按常规制作电镜超薄切片,用透射电镜(型号JEM-1400PLUS,日本电子株式会社产品)观察各组大鼠肺组织的超微结构改变。
1.6 肺组织氧化应激相关蛋白检测
取左肺下叶肺组织,加入一定量的PBS手动匀浆,取匀浆液于低温离心机中3000 r/min离心20 min。取上清液,严格按照ELISA试剂盒(上海酶联生物科技有限公司产品)操作说明,检测谷胱甘肽过氧化物酶(glutathione peroxidase,G S H-P x)、超氧化物歧化酶(s u p e r o x i d e dismutase,SOD)和丙二醛(malondialdehyde,MDA)含量,用酶标仪检测各孔吸光度,最后计算出目的蛋白浓度。
1.7 实时荧光定量PCR检测关键基因表达
使用TRIzol(编号N0.9769,日本TaKaRa公司产品)提取左肺下叶肺组织总RNA,反转录成cDNA,然后采用实时荧光定量PCR法检测组织中水通道蛋白1(aquaporin-1,AQP-1)和血管内皮生长因子(vascular endothelial growth factor,VEGF)的表达情况。按照Real-time Quality PCR试剂盒说明书进行操作,用实时荧光定量仪(美国ThermoFisher公司产品)对样品进行检测。引物序列见表1,由生工生物工程(上海)股份有限公司合成。以β-actin作内参,采用2-△△Ct方法计算目的基因的相对表达值。各个基因的表达值测量均重复3次。
1.8 蛋白质印迹法检测关键蛋白表达
细胞总蛋白提取:用冷的PBS洗肺组织3
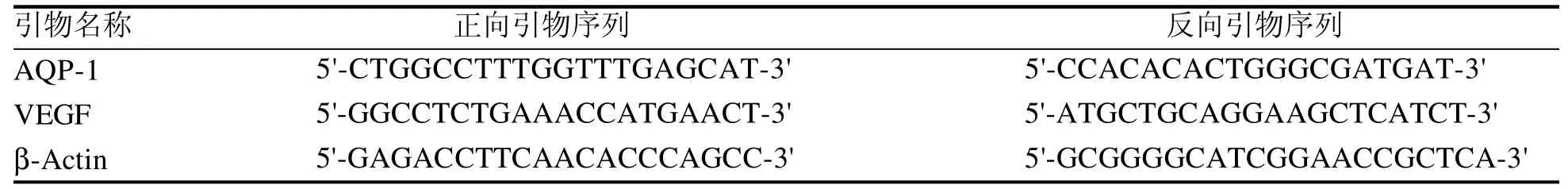
表 1 PCR引物序列Table 1 PCR primer sequence
次,滤纸吸去水分,置于液氮中研磨至粉末状,加入RIPA裂解液,4 ℃ 12 000 r/min离心30 min,上清液即为细胞总蛋白。根据所测定蛋白质的质量浓度(µg/µL),计算所要上样的体积(µL),将样品加入等体积的2×SDS上样缓冲液,100 ℃加热变性,上样后进行SDS-PAGE(80 V 30 min,120 V 60 min)。电泳结束后,切下需要的凝胶条带,加入事先预冷的2×Transfer Buffer,冰盒内电转膜(200 mA 90 min)。用含5% BSA的封闭液进行封闭,加入1∶500稀释的兔抗人VEGF多克隆抗体(编号SP0810,广州深达生物有限公司产品)和兔抗人AQP-1多克隆抗体(编号P4788Rb-h,上海万疆生物有限公司产品),4℃孵育过夜;随后加入1∶10 000稀释的荧光标记的羊抗兔IgG(编号BA1054,武汉博士德生物工程有限公司产品),室温避光孵育1 h,用Licor Odyssey红外成像系统扫描实验结果,最后运用Quantity One软件分析目的条带与β-actin蛋白条带的灰度值之比。
1.9 统计学分析
采用SPSS 18.0统计学软件进行数据处理。数据的正态性和方差同质性采用Kolmogoroe-Simirnov和Levene检验,符合正态分布并具有同质性的数据均以x-±s表示。3组比较采用单因素方差分析,组内两两比较采用LSD-t检验,以P<0.05为差异有统计学意义。
2 结果
2.1 大鼠肺动脉压及血氧值分析
与对照组相比,低压氧舱组和实地低氧组大鼠的肺动脉压显著升高(均P<0.01),而氧分压及氧饱和度均显著下降(均P<0.01);此外,肺动脉压、氧分压及氧饱和度在低压氧舱组和实地低氧组之间比较,均显示无明显差异(P>0.0 5),见图1。
2.2 肺组织含水量分析
与对照组相比,低压氧舱组和实地低氧组大鼠的肺组织含水量均明显升高(每组6只,肺组织含水量分别为0.720±0.007、0.799±0.004和0.7 92±0.0 09),差异具有统计学意义(均P<0.01);此外,肺组织含水量在低压氧舱组和实地低氧组之间比较,均显示无明显差异(P>0.05)。

图 1 各组大鼠的肺动脉压、腹主动脉血氧饱和度及动脉血氧分压Figure 1 Pulmonary arterial pressure, abdominal aortic oxygen saturation and arterial partial pressure of oxygen of rats in each group
2.3 肺组织形态学变化
HE染色后,对照组大鼠的肺组织形态在光镜和电镜下均显示结构正常:光镜下,肺泡腔结构清晰,肺泡间隔无大量红细胞,并未出现水肿现象;电镜下,肺泡结构完整,未出现间质水肿。低压氧舱组和实地低氧组大鼠的肺组织水肿十分严重:光镜下,两组肺组织均可见肺泡间隔明显增宽,大量红细胞和炎性细胞溢出;电镜下,两组大鼠均出现肺泡间隔明显水肿,见图2。
2.4 肺氧化应激水平分析
ELISA检测结果显示,与正常对照组相比,低压氧舱组及实地低氧组大鼠肺组织中SOD活力和GSH-Px含量均明显降低,MDA浓度明显升高,差异均有统计学意义(均P<0.01)。此外,SOD、MDA和GSH-Px在低压氧舱组和实地低氧组之间比较,均显示无明显差异(P>0.0 5),见表2。
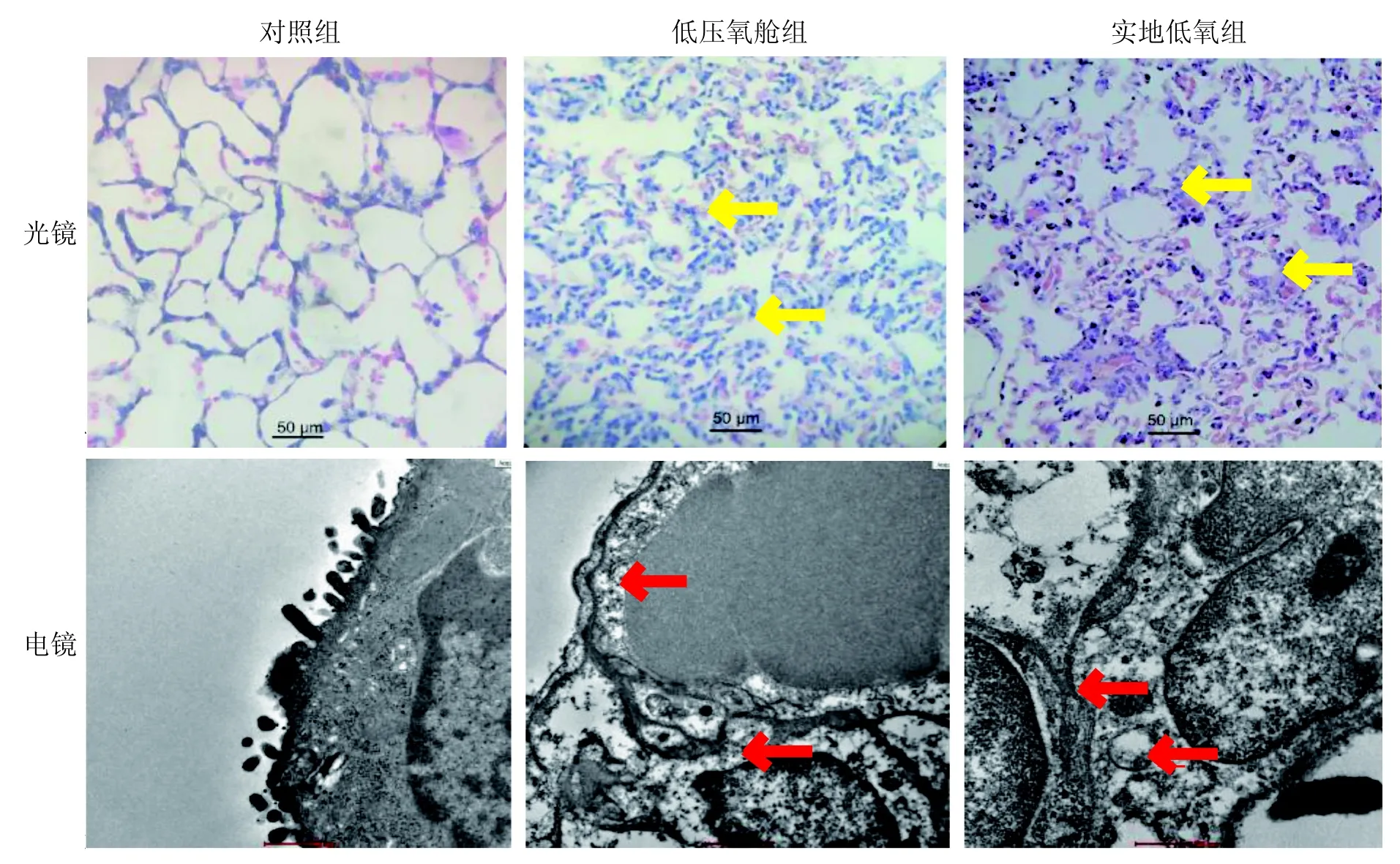
图 2 各组大鼠肺组织的光镜和电镜观察结果Figure 2 Light and electron microscopic results of rat lung tissues in each group
表 2 各组大鼠肺组织氧化应激水平Table 2 Oxidative stress levels in lung tissues of rats in each group(± s)
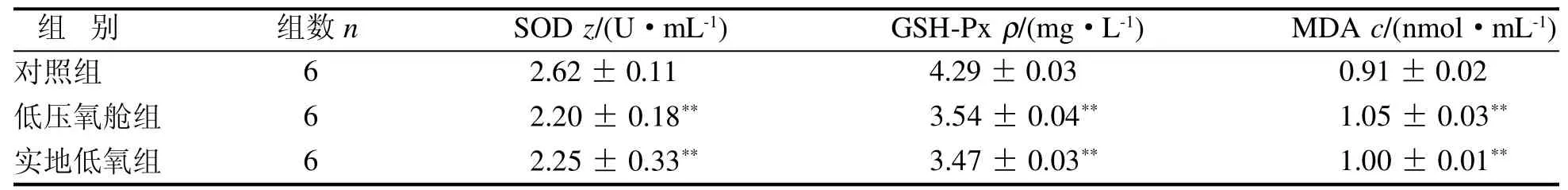
表 2 各组大鼠肺组织氧化应激水平Table 2 Oxidative stress levels in lung tissues of rats in each group(± s)
注:与对照组相比,**P<0.0 1。
?
2.5 肺组织中VEGF及AQP-1表达
实时荧光定量PCR(图3A)和蛋白质印迹法(图3 B)检测结果显示,低压氧舱组和实地低氧组大鼠肺组织中AQP-1 mRNA和蛋白表达水平均较对照组明显升高,差异有统计学意义(均P<0.01),而VEGF mRNA和蛋白表达水平均较对照组明显降低,差异有统计学意义(均P<0.01)。
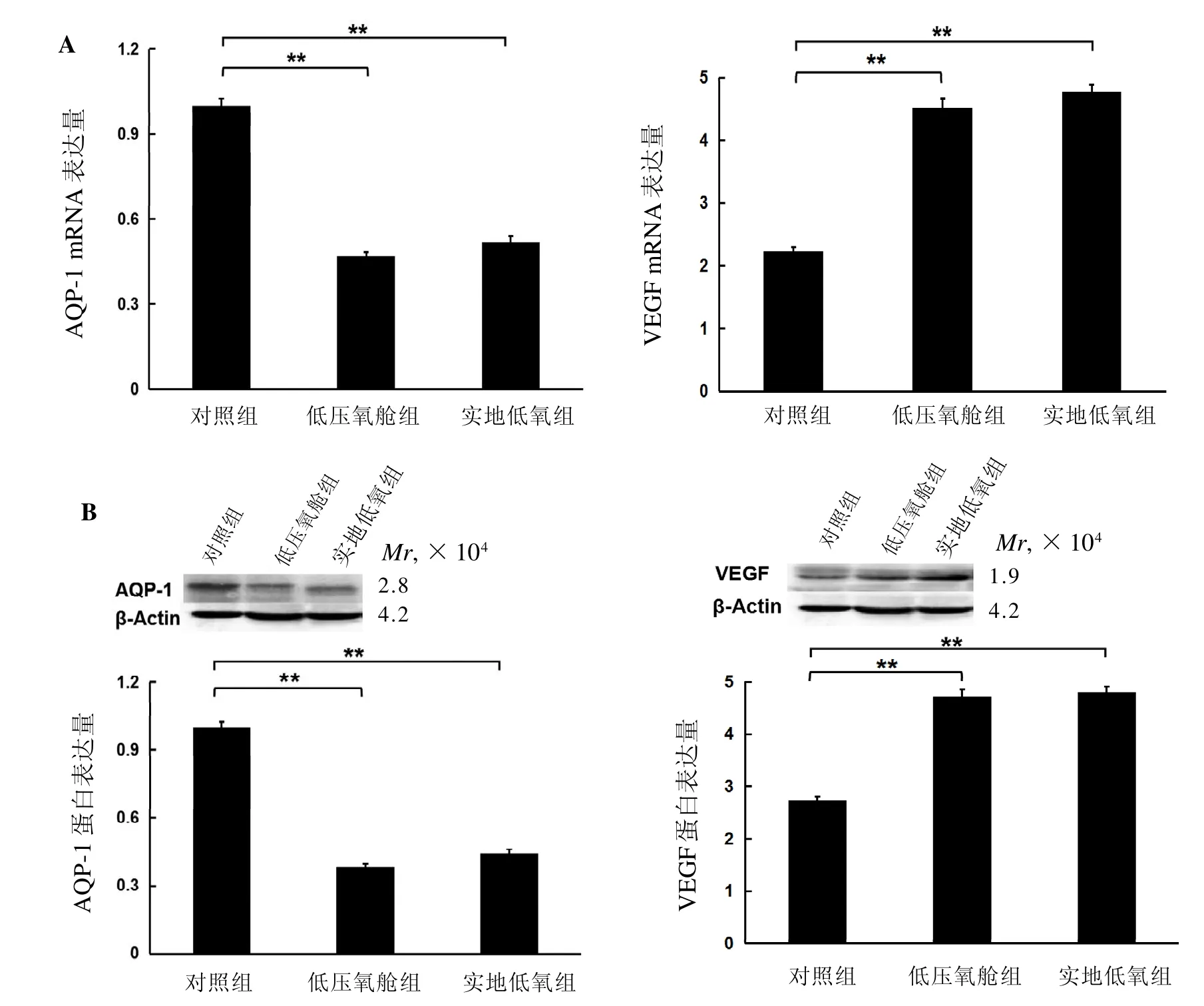
图 3 各组大鼠肺组织中VEGF和AQP-1 mRNA(A)及蛋白(B)的表达量分析Figure 3 The expressions of vascular endothelial growth factor (VEGF) and aquaporin-1 (AQP-1) at the levels of mRNA (A)and protein (B)
3 讨论
HAPE作为一种非心源性肺水肿,是由于机体快速进入高海拔地区后对低压低氧环境不适应而产生的一种高原地区特发性疾病[7]。国内外多采用模拟高原低氧环境复制HAPE大鼠模型,通过观察大鼠行为活动、疾病的发生过程及相应病理变化,以确定高原舱模拟的HAPE大鼠模型成功建立。由于高原舱模拟的HAPE大鼠模型的成功建立需要达到相应的评判标准,并受到海拔高度、减压速度及持续时间、舱内环境和机体情况等多种因素影响,所以理想的动物模型建立除了能够复制疾病的发生、发展过程及相应病理变化外,还应该满足操作简便、因地制宜、人力及物力消耗少等条件[8]。本实验在既往HAPE动物模型复制(低压氧舱环境模拟海拔6 000 m)的研究基础上,还在实地低氧环境(青海省玛多县海拔4 200 m)下构建了HAPE动物模型,然后比较两组HAPE大鼠模型肺组织的干湿比、显微结构、超微结构、部分血氧值、肺动脉压力、关键基因(AQP-1及VEG F)表达及氧化应激对应指标的差异,证明了两种造模方法均能成功构建HAPE模型。
本实验通过肺组织的HE染色发现,相较于正常对照组,低压氧舱组和实地低氧组大鼠均表现出严重的肺组织水肿现象,两组肺组织肺泡间隔明显增宽,大量红细胞和炎性细胞溢出,且出现肺泡间隔的明显水肿,这一结果说明在低氧刺激下,肺毛细血管通透性增加,大量液体通过靠近阻力血管的动脉壁漏出、转移并潴留,引起肺间质和肺泡水肿,推测两组SD大鼠HAPE模型构建成功。此外,在本实验中,低压氧舱组和实地低氧组均表现为显著的肺动脉高压,而腹主动脉血氧分压及氧饱和度均明显下降,这是由于大鼠进入急性低氧环境后,对环境的习服适应机制尚未建立,从而产生一系列应激反应,持续的应激反应使肺血管直接或间接收缩、阻力增大,导致肺动脉压力升高,从而引起血氧分压及氧饱和度下降[9]。
国内外大量研究表明,肺脏干湿重比的测定是评估肺水肿动物模型效果的最佳方法[10]。本实验采用该方法评价低氧胁迫方式构建的大鼠HAPE模型,结果显示,两组模型中(W1-W2)/W1比值升高,符合肺水肿后肺组织的病变特征。有研究表明,VEGF与其特异性受体结合后能够提高血管通透性,且AQP-1与水和蛋白的漏出密切相关[11]。因此,本实验通过实时荧光定量PCR和蛋白质印迹法检测了肺组织中VEGF及AQP-1的表达,发现低压氧舱组和实地低氧组肺组织内VEGF表达水平均异常升高,超出机体的代偿能力,而两个模型组大鼠肺组织中AQP-1表达水平均显著下降。结合以往文献推测,VEGF使肺毛细血管通透性增加,导致大量血浆蛋白漏出血管外[12];而AQP-1使肺泡主动转运液体功能及细胞膜水通透功能异常,出现了水抑制[13],进而出现了肺水肿现象。现在的研究认为,SOD是机体内主要的抗氧化酶[14];而MDA作为脂质过氧化反应的最终产物,是机体内反映氧化损伤程度最经典、最有效的指标之一[15]。此外,GSH是一种能够直接清除ROS、保护细胞免受自由基损害的内源性抗氧化剂。本实验结果显示,低压氧舱组和实地低氧组大鼠肺组织中SOD和GSH-Px含量均显著低于对照组,说明低氧胁迫后大鼠抗氧化能力下降,机体受到氧化应激损伤;此外这两组大鼠肺组织中MDA浓度明显高于对照组,说明HAPE启动了脂质过氧化反应,提高了脂质过氧化物含量,从而加重了肺损伤。
综上所述,本研究对比了两种造模方法,发现不同低氧胁迫方式均能构建SD大鼠HAPE模型,且可安全、便捷地观察其病理变化过程。另外,本实验初次在实地低氧环境中建立适合高海拔地区的、简单有效且可复制的大鼠H A P E实验模型,为在高原地区进一步研究HAPE发病机制并预防和诊治该疾病提供了动物实验基础,具有重要意义。

