川芎嗪对胶原诱导型关节炎大鼠细胞外调节蛋白激酶通路的影响
梁锦峰,刘文华,鄢 宏,邓少杰
(1. 深圳市宝安区人民医院骨科中心,深圳 518100;2. 深圳市第二人民医院骨关节外科,深圳518000)
类风湿关节炎(rheumatoid arthritis,RA)是一种自身免疫性骨关节炎,主要病理改变为关节滑膜腔炎性浸润以及患者运动功能受损,临床症状表现为关节肿痛、关节畸形和行动不便。目前,临床上治疗RA的主要方向是减轻患者关节炎症、改善患者骨侵蚀程度,这需要通过抑制滑膜细胞增殖、血管翳形成而实现[1]。RA发病机制尚未完全明确,但已有研究[2]证实一些炎性因子如白细胞介素1β(IL-1β)、肿瘤坏死因子α(TNF-α)等在RA发病过程中发挥重要作用。细胞外调节蛋白激酶(extracellular regulated protein kinase,ERK)作为参与细胞信号转导的重要通路之一,具有促进细胞增殖分化以及参与机体炎性反应功能。研究[3]证实,ERK通路也参与了RA的发生和发展过程,RA的关节炎性浸润病理改变与ERK通路存在紧密联系,因此ERK通路在RA中的作用逐渐引起高度重视。川芎嗪(tetramethylpyrazine)是目前临床中医治疗RA的一种常用药物,临床试验证实其具有抗炎、消肿和镇痛之功效,可以有效缓解RA患者关节炎临床症状。同时川芎嗪还具有抑制血管内皮细胞增殖和新生血管生成的作用[4],但川芎嗪治疗RA是否通过干预ERK通路起效仍需要进一步研究证实。本研究通过建立胶原诱导型关节炎大鼠模型,观察川芎嗪对关节炎模型大鼠病理学变化和体内炎性因子水平的影响,探讨和分析川芎嗪治疗RA的起效机制以及对ERK通路的影响。
1 材料与方法
1.1 动物、试剂及仪器
30只SPF级雄性SD大鼠,(10.23±2.15)周龄,体质量300~350 g,购自深圳康泰生物制品股份有限公司[SCXK(粤)2018-0193]。动物饲养于康美华大基因技术有限公司[SYXK(粤)2019-0 2 0 5],动物实验伦理审批文号:医科伦审-2018017。TNF-α、血管生成素1(Ang-1)、IL-1β和血管内皮生长因子(VEGF)抗体试剂盒均购自上海酶联生物科技有限公司;磷酸川芎嗪片购自广州康和药业有限公司(规格50 mg,国药准字H 4 4 0 2 4 2 7 2);酶联免疫吸附测定(E LI S A)试剂盒购自北京索莱宝科技有限公司;反转录试剂盒和总RNA提取试剂盒购自美国赛默飞公司。
荧光定量PCR仪(型号 ABI 7500,美国赛默飞公司);高速冷冻离心机(型号Mikro220R,德国Hettich公司);电泳仪和电泳槽(型号分别为DYCZ、DYCP,中国北京六一仪器厂);分光光度计(型号UV-2000, 美国安捷伦科技公司);酶标仪(型号E L3 0,美国B i o-T e k公司);ELISA分析软件(ReaderFit,中国杭州艾米绿公司);96孔酶标板(美国Costar公司)。
1.2 方法
将30只大鼠随机分为对照组、模型组和川芎嗪组,每组各10只,采用文献报道的胶原诱导型关节炎造模方法[5-6]:将20 mg鸡Ⅱ型胶原充分溶解于10 mL浓度为0.1 mol/L的乙酸中,得到质量浓度为2 g/L的鸡Ⅱ型胶原,然后将等体积弗氏完全佐剂与该溶液混合并乳化完全得到乳化剂。造模成功后,川芎嗪组每日给予川芎嗪(0.1 g/kg)(其中磷酸川芎嗪片使用适量生理盐水溶解,配制成灌胃混悬液),连续灌胃给药28 d;模型组、正常组给予相同体积生理盐水。每周测量3组大鼠后足体积变化情况,采取HE染色法观察各组大鼠炎性细胞浸润情况,采用ELISA法测定各组大鼠滑膜组织及血清中TNF-α、Ang-1、IL-1β、VEGF水平,另外采用蛋白质印迹法检测各组大鼠ERK1/2蛋白及磷酸化ERK1/2(p-ERK1/2)蛋白的表达水平。
1.3 观察指标及评价标准
1.3.1 各组大鼠关节肿胀度测定及比较 造模成功后,使用记号笔在大鼠足部踝骨关节突出位置作标记,每周使用排水法[7]测量并记录各组大鼠后足的体积大小,每只大鼠每次测定3次,取平均值。
1.3.2 各组大鼠组织病理学变化比较 于实验28 d脊椎脱臼法处死大鼠后,使用体积分数10%的多聚甲醛溶液浸泡大鼠双后肢膝关节1 d,然后使用体积分数5%的硝酸溶液浸泡膝关节组织2周,浸泡至组织脱钙完全且能够顺畅切断骨质后,重新使用体积分数10%的多聚甲醛溶液浸泡,然后进行石蜡包埋、切片以及HE染色。
1.3.3 各组大鼠滑膜组织及血清中炎性因子水平测定 于实验28 d脊椎脱臼法处死大鼠前采集大鼠动脉血4 mL,离心后分离得到上层血清。另外,手术切取大鼠膝关节滑膜组织,用ELISA试剂盒检测所有样本中TNF-α、IL-1β、Ang-1以及VEGF水平。严格按试剂盒操作说明检测,使用酶标仪进行样品检测。
1.3.4 滑膜组织各炎性因子mRNA表达测定 分别取各组大鼠关节滑膜组织,用总RNA提取试剂盒提取组织中总RNA,使用紫外分光光度计测定总RNA浓度,样品吸光度比值A260/A280≥1.80视为合格。采用反转录试剂盒将总RNA进行反转录,分别得到模板单链cDNA,然后使用PCR试剂盒对cDNA进行PCR。 PCR反应条件为95 ℃30 s,退火60 ℃ 40 s,延伸72 ℃ 30 s;连续循环30次。然后采用2-△△Ct计算血清mRNA相对表达量[8]。
1.3.5 蛋白质印迹法测定ERK1/2、p-ERK1/2蛋白表达水平 剪取各组小鼠滑膜组织并加入裂解缓冲液,当组织得到充分匀浆后将其静置一段时间,然后放入离心机以12 000 r/min离心20 min,取出上清液后采用BCA法对ERK1/2、p-ERK1/2蛋白进行定量测定。使用10%SDS聚丙烯酰胺凝胶电泳对蛋白样品进行分离后,将蛋白转移到聚偏二氟乙烯(PVDF)膜上,使用封闭液将样品于室温下封闭2 h。将膜转入封闭液稀释的一抗,4 ℃过夜后使用PBST冲洗液进行洗涤,加二抗后继续于室温下孵育1 h,洗涤后采用电化学发光法检测并进行印迹成像。
1.4 统计学分析
采用SPSS 19.0统计软件分析不同组别各项指标间差异,多组间采用方差分析,组间两两比较采用SNK-q检验。P<0.05为差异具有统计学意义。
2 结果
2.1 大鼠关节肿胀度
从第2周开始,模型组大鼠后足开始发生明显肿胀,后足体积显著大于川芎嗪组和对照组(P<0.0 5)(表1)。
2.2 大鼠关节组织病理学观察
对照组大鼠关节结构完整且关节面光滑,关节间隙大小正常,未显示存在炎性浸润和滑膜组织增生,关节两端未发生骨侵蚀(图1A);模型组大鼠关节腔间隙比对照组显著变大,且间隙中填充有滑膜增生组织,存在炎性浸润和骨侵蚀现象,关节面和关节结构被破坏(图1B)。川芎嗪组大鼠关节病理切片情况相比模型组有明显好转,关节面较清晰,关节间隙轻微增大,存在轻微炎性浸润情况,但未发生明显骨侵蚀,骨关节结构比较完整(图1 C)。
2.3 大鼠血清和滑膜组织中炎性因子水平
模型组和川芎嗪组大鼠血清和滑膜组织中炎性因子TNF-α、Ang-1、IL-1β表达水平比对照组大鼠均显著升高(P<0.05),同时川芎嗪组大鼠血清和滑膜组织中各炎性因子水平比模型组均降低(P<0.05)。各组大鼠血清中均未检测到VEGF,但模型组和川芎嗪组大鼠滑膜组织中VEGF水平均升高(P<0.05),且川芎嗪组明显低于模型组(P<0.0 5)(表2)。
2.4 大鼠滑膜组织各炎性因子mRNA表达
与对照组相比,模型组和川芎嗪组大鼠滑膜组织中各炎性因子mRNA表达水平均显著升高(P<0.05);川芎嗪组大鼠各炎性因子mRNA水平与模型组相比均显著降低(P<0.05)(表3)。
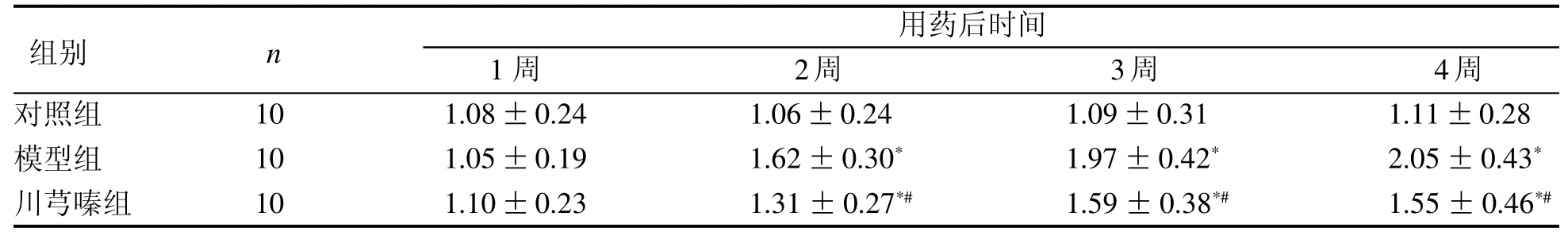
表 1 各组大鼠关节肿胀度测定Table 1 Results of joints welling test in rats (-x± s)
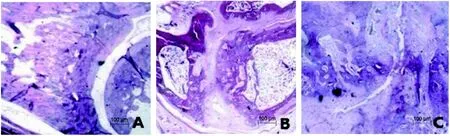
图 1 大鼠关节组织病理学观察 (HE染色)Figure 1 Pathological observation on joint tissues in rats (HE staining)
2.5 大鼠滑膜组织ERK1/2、p-ERK1/2蛋白表达
与对照组比较,模型组和川芎嗪组大鼠滑膜组织p-ERK1/2蛋白表达水平均升高(P<0.05),但川芎嗪组表达水平低于模型组(P<0.05);模型组和川芎嗪组大鼠ERK1/2蛋白表达水平与对照组相比差异无统计学意义(P>0.05)(表4)。

表 2 大鼠滑膜组织和血清中炎性因子水平Table 2 The levels of inflammatory factor levels in synovial tissue and serum of rats (-x ± s)
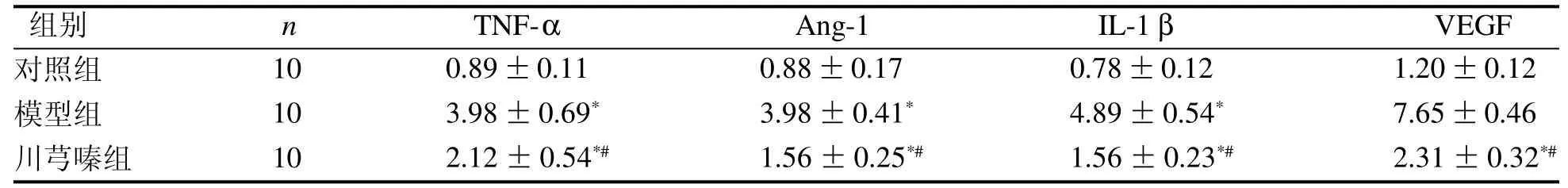
表 3 大鼠滑膜组织各炎性因子mRNA表达Table 3 The mRNA expressions of inflammatory factors in synovial tissues of rats (-x ± s)

表 4 大鼠滑膜组织ERK1/2、p-ERK1/2蛋白表达水平Table 4 The expressions of ERK1/2 and p-ERK1/2 proteins in synovial tissues of rats (-x ± s)
3 讨论
胶原诱导型关节炎大鼠模型是一种慢性免疫炎性动物模型,已被学术界认可作为研究RA发病机制的理想动物模型[9]。ERK作为与细胞信号转导和炎性反应密切相关的信号通路,与RA的新生血管生成、细胞增殖分化、炎性浸润以及蛋白酶表达等过程密切关联,在RA整个发生和发展过程中活跃度很高[10]。TNF-α、IL-1β是促炎性Th1细胞分泌的一些重要炎性因子,其中IL-1β属于炎性始动因子,高IL-1β水平会刺激软骨细胞过度合成胶原酶以及致炎致痛物质前列腺素E2,同时促进嗜中性粒细胞、巨噬细胞聚集于关节滑膜,从而产生关节滑膜炎性反应,导致软骨基质发生降解[11]。TNF-α不仅可以诱导炎性反应,还能促进成纤维细胞增生,以及导致软骨受损[12]。在RA患者体内Thl和Th2细胞处于失衡状态,其中Th1细胞及其分泌的促炎细胞因子占据绝对优势。本研究发现RA模型大鼠血清中TNF-α、IL-1β等Th1促炎因子相比正常组大鼠明显升高(P<0.05)。有研究表明,VEGF、基质金属蛋白酶等一些与血管新生相关的细胞因子在RA患者血清和关节滑膜组织中也呈现明显高表达,且与患者RA疾病严重程度存在显著正相关性[13]。以上研究结果说明上述细胞因子共同参与了RA疾病的进展,促进新生血管生成、炎性浸润以及骨侵蚀过程。
川芎嗪是从中药材川芎中提取出来的一种活性成分,其药理作用如抗新生血管生成、抑制细胞分化增殖和抑制炎性反应等均已得到充分证实,且大量临床研究和基础研究证实川芎嗪可以缓解RA患者临床症状[14]。本研究结果显示,造模后第2周开始,模型组大鼠后足体积以及炎性因子TNF-α、Ang-1、IL-1β水平显著大于或者高于对照组和川芎嗪组(P<0.05);且病理观察显示,模型组大鼠关节腔间隙存在炎性浸润、滑膜增生组织和骨侵蚀现象,关节面和关节结构被破坏,而川芎嗪组大鼠关节间隙炎性损伤程度明显低于模型组大鼠,未发生明显骨侵蚀,骨关节结构相对较完整,表明川芎嗪可降低炎性反应,减轻后足炎性损伤。谢平金等[15]研究发现,使用川芎嗪对模型大鼠进行干预后,大鼠血清IL-1β、TNF-α表达水平相对于模型组显著降低(P<0.05),证实川芎嗪在治疗RA中发挥显著抗炎作用。另外,本研究结果表明,模型组和川芎嗪组大鼠p-ERK1/2蛋白表达水平相比对照组均显著升高(P<0.05),但川芎嗪组相比模型组显著降低(P<0.05),说明模型大鼠中p-ERK1/2蛋白存在过度表达,而川芎嗪可以通过抑制ERK信号通路促进ERK1/2磷酸化即增加p-ERK1/2蛋白表达水平。李巍等[16]研究表明,川芎嗪可以通过抑制滑膜组织ERK通路活化,有效降低胶原诱导型关节炎模型动物血清和滑膜组织中IL-1β、TNF-α和IL-12 炎性因子表达水平(P<0.05),与本研究结果一致。王春亮等[17]研究发现,IL-l和TNF-α可以快速激活成纤维样滑膜细胞中ERK、c-JUN氨基末端蛋白激酶和P38激酶活性,激活后的ERK和P38又会进一步诱导IL-l和TNF-α等细胞因子表达,进而导致RA的发生发展。白菁安等[18]报道,川芎嗪治疗RA的起效机制可能与抑制ERK通路活化过程存在密切联系。结合本次研究结果,笔者认为川芎嗪治疗RA的起效机制可能是由于川芎嗪显著减少炎性因子分泌,抑制机体淋巴细胞增殖,从而抑制ERK通路,降低ERK相关蛋白表达水平,最终有效改善大鼠关节肿胀症状,缓解关节组织的病理情况。
本研究采用的是经典RA大鼠造模方法,已有大量文献报道验证,故研究中仅对造模组血清和滑膜组织炎性反应进行评估,就可以判断造模成功。同时考虑到本研究主要目的是观察川芎嗪对炎性因子和ERK通路相关蛋白表达的影响,因此着重关注川芎嗪组与模型组和空白对照组的比较,未设置阳性药对照组,后续可进一步完善。
综上所述,川芎嗪可能通过有效抑制ERK通路,调节胶原诱导型关节炎大鼠血清和滑膜组织中TNF-α、IL-1β等炎性因子水平,缓解关节肿胀症状。

