玉米ZmbHLH161基因的克隆及功能研究
杨梦婷 张 春 王作平 邹华文 吴忠义,*
研究简报
玉米基因的克隆及功能研究
杨梦婷1,2,**张 春2,**王作平2邹华文1,*吴忠义2,*
1长江大学农学院, 湖北荆州 434023;2北京市农林科学院 / 北京农业生物技术研究中心 / 农业基因资源与生物技术北京市重点实验室, 北京 100097
bHLH转录因子是植物第二大转录因子家族, 在调节植物生长发育、信号转导和逆境胁迫响应等方面发挥着重要的作用。为了研究玉米bHLH家族基因在逆境胁迫响应中的功能, 本研究从玉米根组织中克隆了(AC: NC_AQK75074)基因。生物信息学分析表明: 该基因包含3个外显子, cDNA全长1460 bp, 编码序列全长1059 bp, 编码352个氨基酸; 在玉米基因组中以单拷贝形式存在, 功能未知; ZmbHLH161蛋白分子量为37.1 kD, 理论等电点为6.10, 具有bHLH转录因子家族特有的保守结构域, 但不具跨膜结构, 无信号肽, 为亲水性蛋白, 蛋白二级结构无规则卷曲所占比例最大, 为42.05%。玉米原生质体瞬时表达试验表明, ZmbHLH161定位在细胞核内。实时荧光定量PCR (qPCR)分析表明, 正常生长条件下,主要在根系和幼胚中表达; 在脱水和干旱处理下,在玉米苗期叶片中上调表达。转基因异源表达拟南芥株系经不同浓度NaCl处理后, 其根长与野生型差异不显著, 而不同浓度甘露醇处理后其根长优于野生型。由此推测基因可能参与玉米对渗透胁迫应答。
玉米;; 转录因子; 原生质体; qPCR; 渗透胁迫
玉米是我国第一大农作物, 种植面积3300多万公顷, 其总产量2亿多吨, 在我国粮食安全和国民经济发展中起着重要作用[1]。玉米起源于南美洲高温多湿的热带地区, 喜温、需水较多、耐旱性不强, 耐盐性较差[2]。如今, 随着人类活动范围的扩大, 生态环境也遭受着巨大的破环, 如土壤沙漠化、盐碱化、水流污染和地下水枯竭等, 而土壤干旱、盐碱化则严重影响玉米产量, 如何提高玉米对干旱、高盐等不利因素的抵抗能力越来越受到重视。
转录因子(transcription factors) 是RNA聚合酶在真核生物特异启动子上起始转录所需要的作用因子, 由DNA结合区、转录调控区、寡聚化位点和核定位信号区组成[3]。bHLH (碱性/螺旋-环-螺旋, basic/Helix-Loop-Helix)转录因子名称来自其结构中的bHLH基序, bHLH结构域由50~60个氨基酸组成, 其结构包括2个保守区域: 一是长度为10~15个氨基酸的碱性区域, 分布在多肽链的N端,含有大量碱性氨基酸, 与DNA结合相关; 另一为长度40个氨基酸左右HLH区域, 分布在C端, 主要由疏水氨基酸残基构成, 利于HLH之间相互作用形成二聚体, 其中环的长度在不同bHLH蛋白中会有差异。1989年Murre等[4]从小鼠中首次鉴定出bHLH转录因子E12和E47, 之后越来越多bHLH转录因子在线虫、果蝇、小鼠和人类中得到了分离鉴定。Nuno等[5]发现, 在4.4亿年前的早期陆地植物中就已经存在bHLH转录因子家族。在研究较为深入的动物中, 依据其进化关系和DNA结合模式, 将bHLH蛋白分为6个组(A~F组)[6], 而植物中bHLH蛋白大多数都属于B组。与植物逆境抗性相关转录因子家族中, 研究较多的有bZIP、WRKY、AP2/EREBP和MYB四大类[7], bHLH转录因子家族在植物抗逆中的研究则相对滞后, 正因如此, 引起了科学家们广泛关注。bHLH转录因子是一个大家族, 在调节植物生长发育[8-11]、信号转导[12-15]和逆境胁迫响应[16-19]方面发挥着重要作用。其中bHLH转录因子基因不仅能促进玉米侧根生长发育, 而且对促进ABA合成、信号转导和提高耐旱性等方面都起到正向调控作用[20]。目前, 在拟南芥和水稻中分别鉴定到了162个和167个bHLH家族成员[21-22]。Zhang等[23]利用全基因组分析在玉米中鉴定到208个bHLH蛋白, 并通过与拟南芥bHLH蛋白进行比较, 将这些蛋白划分为18个亚家族。而其他植物因为基因组测序工作开展得较晚, 因此对其基因组中的bHLH家族成员分析还未见报道。由于已知的植物bHLH基因序列主要来源于水稻和拟南芥这两种模式植物, 对其他植物bHLH蛋白的功能研究开展的还比较少。
前期工作中, 我们对玉米根系生长发育4个关键时期进行了转录组测序分析, 在相邻时期间均显著差异表达的转录因子中, 鉴定到唯一一个bHLH家族转录因子基因, 推测该基因可能在调控玉米根系生长发育过程中发挥重要的作用, 那么作为bHLH转录因子家族的成员之一, 它是否也参与逆境胁迫响应呢?为了证实这一猜测, 我们首先克隆了玉米基因, 对其表达模式、亚细胞定位以及在高盐、脱水、低温和干旱胁迫处理下的表达情况进行了研究; 然后将该基因在拟南芥中进行了异源表达, 利用转基因拟南芥株系进行相关耐逆性研究, 初步探索了玉米转录因子的功能, 旨在为玉米抗逆遗传改良提供参考依据。
1 材料与方法
1.1 植物材料及试剂
试验材料为玉米自交系B73、郑58、野生型拟南芥()和农杆菌GV3101, 以上材料均为本实验室提供。
试验所用试剂为大肠杆菌Trans1-T1、pEASY T5 Zero Clone载体、RNA提取试剂盒、逆转录试剂盒等均购于北京全式金公司; Ex、LA、SYBRPremix ExII (Tli RNaseH Plus)等购于TaKaRa公司; EDTA、蔗糖、NaCl、乙醇、Tris、磷酸氢二钠、磷酸二氢钠酚、氯仿、异戊醇、异丙醇、浓硫酸、PEG-4000、冰醋酸、浓盐酸、甘油、琼脂糖、蛋白胨、酵母粉和β-巯基乙醇等生化试剂均购自生工生物工程(上海)股份有限公司, 所有的测序工作都由生工生物工程(上海)股份有限公司完成。
试验所用设备为低温高速台式离心机(型号: MUITLFUGE X1R); 低温台式水平离心机(型号: SC-3612); PCR仪(型号: T100 Thermal Cycler); 激光共聚焦显微镜(型号: Leica TCS SP8)。
玉米材料处理: 挑选颗粒饱满的自交系B73种子种植于温室花盆中, 分别设置对照组、脱水处理组、盐(0.2 mol L–1NaCl)处理组、冷(4℃)处理组、不浇水干旱处理组, 每组6盆, 每盆2株, 各设3个生物学重复。玉米幼苗正常生长至三叶一心时分别进行脱水、高盐、冷、干旱处理, 分别取脱水(将盆栽三叶期玉米幼苗整株取出, 用流水冲洗掉泥土, 用吸水纸吸收表面多余水分后, 室温放置, 自然脱水)、高盐、冷处理0、1、2、5、10和24 h后材料的叶片和根, –80℃冻存。不浇水干旱处理取0、3、7和12 d后的叶片和根(其中0 d为最后一次充分浇水时取样), –80℃冻存。组织差异表达材料取露地栽培自然生长至三叶期幼苗的根、叶以及抽雄期的根、茎、叶、雄穗、花丝、幼胚, –80℃冻存。
1.2 ZmbHLH161 cDNA的克隆及生物信息学分析
按照Transzol Up Plus RNA Kit试剂盒(北京全式金公司)说明提取玉米根组织的总RNA, 逆转录得到cDNA模板。依据基因信息利用Primer 5设计1号引物对(表1), 以逆转录的cDNA为模板进行PCR扩增, 反应程序为: 94℃预变性60 s; 98℃ 10 s, 68℃ 70 s, 30个循环; 72℃延伸10 min, 获得全长。PCR产物经胶回收后连接至T5Zero载体, 获得单克隆后送生工生物工程(上海)股份有限公司进行菌落测序。各引物序列见表1。
用DNAMAN 8软件进行序列比对分析, 应用ProParam (http://web.expasy.org/protparam/)分析玉米ZmbHLH161的编码氨基酸的数目、蛋白相对分子量、等电点等理化性质; 应用SPOMA (https://npsa-prabi.ibcp. fr/cgi-bin/npsa_automat.pl?page=/NPSA/npsa_opma.html)) 在线分析软件预测蛋白质二级结构, 利用(https://www. swissmodel.expasy.org/)预测其空间结构; 利用在线分析软件TMHMM2.0 (http://www.cbs.dtu.dk/services/TMHMM-2.0/)对氨基酸序列进行跨膜分析; 用在线软件BaCelLo (http://gpcr2.biocomp.unibo.it/bacello/pred.htm)对ZmbHLH161进行了亚细胞定位预测; 用在线软件Plant CARE (http: //bioinformatics.psb.ugent.be/webtools/plantcare/html/)对转录起始位置ATG上游长度为2 kb启动子的序列进行分析。
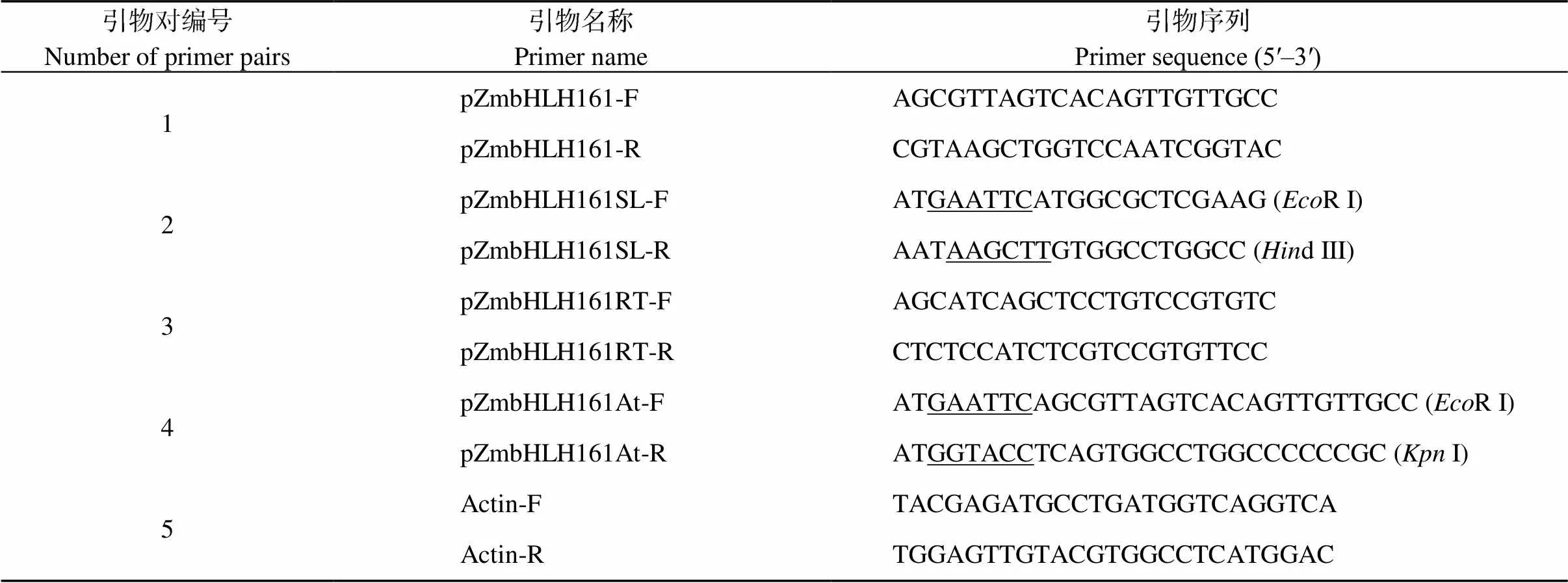
表1 本试验中所用的引物
1.2.1 植物表达载体pYBA1132:ZmbHLH161:EGFP的构建 使用2号引物对进行扩增, 获得在5′端和3′端分别引入R I、d III酶切位点的基因编码区, PCR产物经R I、dIII双酶切连接至PYBA1132表达载体上获得重组载体。将重组载体转化大肠杆菌(Trans1-T1)后, 挑取阳性克隆测序验证。
1.2.2 玉米原生质体的提取及转化 以玉米自交系郑58黄化苗胚芽鞘为材料, 依据Song-Dong[24]的方法进行改良后提取原生质体并转化。转化后的原生质体23℃黑暗孵育16 h后, 轻轻混匀后再加入终浓度为5 μmol L–1的DAPI (4,6-diamidino-2-phenylindole)染色5 min, PBS缓冲液洗涤后置于激光共聚焦显微镜下观看荧光情况。
1.3 玉米ZmbHLH161基因表达模式分析
按照试剂盒的说明提取地上部及根RNA, 逆转录后作为qPCR模板。设计3号特异引物对及内参基因特异引物5号引物对。应用BIO-RAD CFX96 Real-Time System qPCR仪进行实时荧光扩增。反应体系如下: 10 μL 2×SYBR Premix Ex、0.5 μL GSP (10 µmol L–1)、1 μL cDNA模板、8.5 μL ddH2O。PCR条件: 95℃ 30 s; 95℃ 10 s, 60℃ 20 s, 共40个循环; 融解曲线分析, Step 1: 95℃ 10 s; Step 2: 65℃ 1 min; Step 3: 95℃ 15 s。每组试验设3个生物学样本, 每个生物学样本设3个技术重复, 数据为3个生物学重复平均值±标准误。应用2–∆∆CT方法分析在各组织中的相对表达情况[25]。逆境处理试验分别以0 h时,在幼苗根和叶片的表达量计为1, 组织差异表达试验中以抽雄期花丝的该基因表达量计为1。
1.4 植物异源表达载体pYBA1132:ZmbHLH161的构建及拟南芥遗传转化
1.4.1 异源表达载体构建 设计4号引物对扩增获得含有酶切位点的编码区片段。PCR产物经R I、I双酶切连接至pYBA1132表达载体上获得重组载体, 将重组载体转化大肠杆菌(Trans1-T1)后, 挑取阳性克隆进行菌体PCR检验及酶切验证, 并送生工生物工程(上海)股份有限公司测序。
1.4.2 转化农杆菌GV3101及侵染拟南芥 pYBA1132:重组质粒转入农杆菌GV3101, 筛选鉴定后通过浸花法[26]侵染拟南芥幼苗。单株收取T0代种子, 经卡那霉素抗性筛选后获得T1代转基因拟南芥。提取T1代幼苗叶片基因组DNA为模板, 以4号引物对为引物进行PCR检测, 单株收获阳性植株种子并加代获得T3代纯合植株。
1.4.3 转基因拟南芥种子逆境处理 利用含NaCl、甘露醇的1/2 MS培养基对转基因拟南芥分别模拟盐和渗透胁迫。NaCl浓度梯度为0、0.10、0.15和0.18 mol L–1, 甘露醇浓度梯度为0、0.15、0.20和0.30 mol L–1, 调pH 5.8。逆境胁迫处理试验: 将拟南芥种子用消毒液消毒后, 将1/2 MS固体培养基上生长7 d的转基因和野生型拟南芥幼苗(根长相同), 分别移栽到含不同浓度NaCl、甘露醇的1/2 MS固体培养基上。培养基分为两部分, 野生型和转基因拟南芥各占一半, 各移6株, 设3个重复, 垂直放置于恒温培养箱中培养, 7 d后统计拟南芥根长。
2 结果与分析
2.1 玉米转录因子基因ZmbHLH161序列扩增与生物信息学分析
从玉米根中提取RNA, 经反转录获得cDNA, 以其为模,板用1号引物对扩增获得目的基因, 经测序表明,基因的cDNA序列全长1460 bp, 编码352个氨基酸。氨基酸序列比对表明,基因含有典型的HLH结构域(图1-A)。生物信息学分析表明, 其蛋白分子量为37.1 kD, 理论等电点pI为6.10; 蛋白二级结构无规则卷曲所占比例最大, 为42.05%, 其次是α螺旋(34.66%), 其空间结构预测结果如图1-B所示。该蛋白无信号肽, 为亲水性蛋白, 无跨膜结构区(图1-C)。亚细胞定位分析预测可能定位在细胞核。
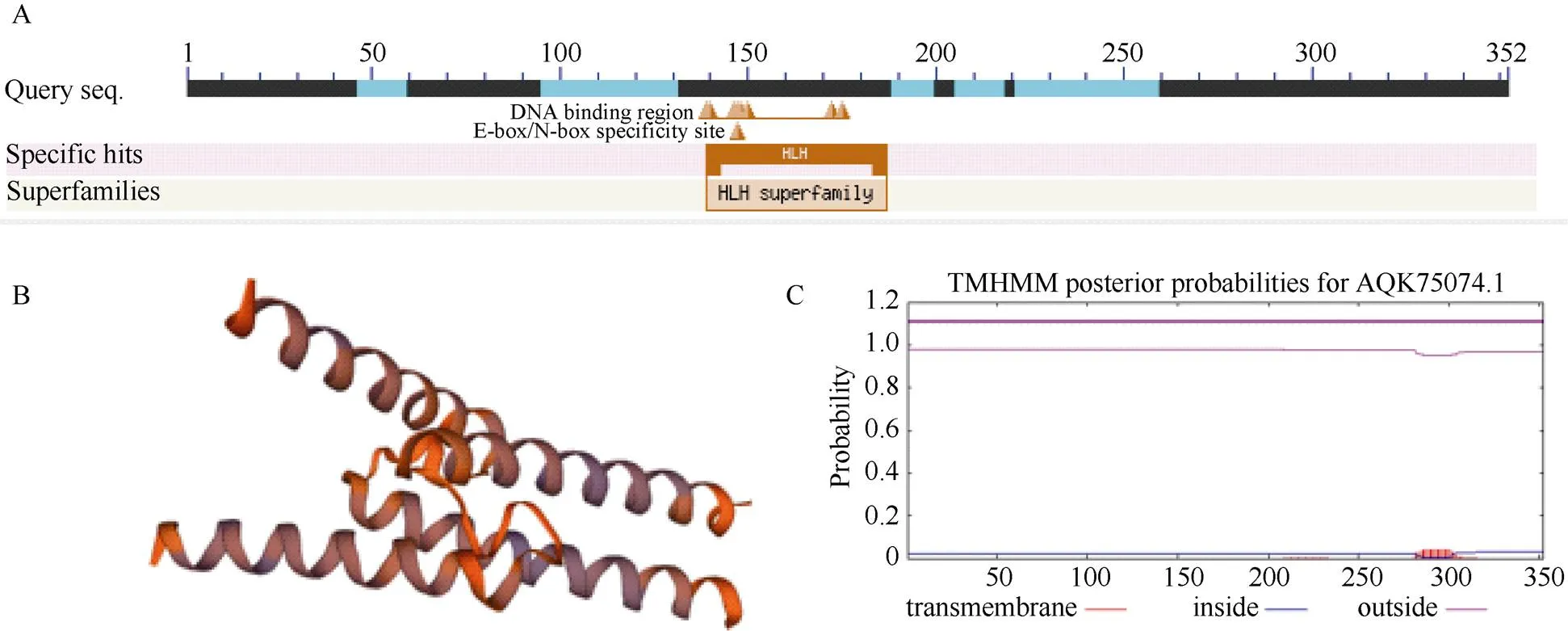
图1 ZmbHLH161生物信息学分析
A: 氨基酸序列比对; B: 蛋白二级结构预测; C: 跨膜结构预测。
A: amino acid sequence alignment; B: protein secondary structure prediction; C: transmembrane structure prediction.
序列比对结果显示,()和()同水稻()同源性较高, 与拟南芥中的、()和()具有较高的相似性(图2)。
启动子序列分析结果如图3,基因启动子含有多个与逆境胁迫相关的顺式作用元件, 如ABRE响应ABA胁迫、MYB响应干旱胁迫以及MYC响应ABA、低温胁迫。
2.2 亚细胞定位结果与分析
构建瞬时表达载体pYBA1132:ZmbHLH161:EGFP并转化玉米原生质体, 通过融合蛋白GFP荧光显示目的蛋白的亚细胞定位。原生质体经DAPI染色后置于激光共聚焦显微镜下观察发现(图4),转有绿色荧光蛋白空载体对照pYBA1132的玉米原生质体中, 整个细胞都有绿色荧光分布, 无明显细胞器定位特异性, 而转入目的基因的原生质体中, GFP绿色荧光只分布在细胞核, 并且与核特异染料DAPI的蓝色荧光完全重合, 表明ZmbHLH161定位于细胞核内。
2.3 玉米ZmbHLH161在不同组织中的表达情况
分别提取三叶期幼苗的根、叶, 抽雄期的根、茎、叶、雄穗、花丝和幼胚组织总RNA, 逆转录获得cDNA后进行qPCR分析, 结果表明,在不同组织中表达差异较大, 以抽雄期花丝中的表达量为标准进行比较, 生长旺盛期根中的表达量最高, 约为花丝中表达量的29.2倍; 其次是幼根和幼胚, 分别为8.3倍和5.4倍; 其他组织的表达量均低于花丝, 幼叶中的表达量最低(图5), 表明基因可能参与玉米根和幼胚的生长发育。

图2 拟南芥、水稻和玉米bHLH转录因子氨基酸序列的系统发育树
2.4 不同逆境处理对叶片和根中ZmbHLH161表达的影响
由图6可知, 不浇水干旱处理下, 叶片中的表达量在1~7 d一直呈下调趋势, 至12 d上调, 约为对照8.6倍, 而在根中则一直呈下调趋势。在脱水处理下, 叶片中的表达量在1 h内上调, 然后下调, 到5 h时约为对照的18倍, 随后上调并在10 h时达到峰值, 约为对照的82倍, 24 h时表达量约为对照的72倍; 而根中的表达量基本保持不变。低温处理下, 叶片中的表达量在1 h上调至对照1.9倍左右, 随后则是下调, 到24 h时为对照0.3倍; 根中先上调在2 h时达到峰值, 约为对照的1.4倍然后回落, 至24 h时约为对照的0.28倍。盐处理下,的表达量在叶片中急剧下调, 至24 h时约为对照的0.01倍; 根中先下调至5 h时约为对照的0.72倍, 后逐渐上调至24 h时, 约为对照1.5倍左右。以上结果表明,玉米叶片中基因受到非生物胁迫干旱和脱水的诱导表达, 对冷和盐胁迫信号也有应答反应; 在玉米根中基因受到非生物胁迫干旱的诱导表达, 对冷和盐胁迫信号也有应答反应, 但不受脱水胁迫的诱导表达。
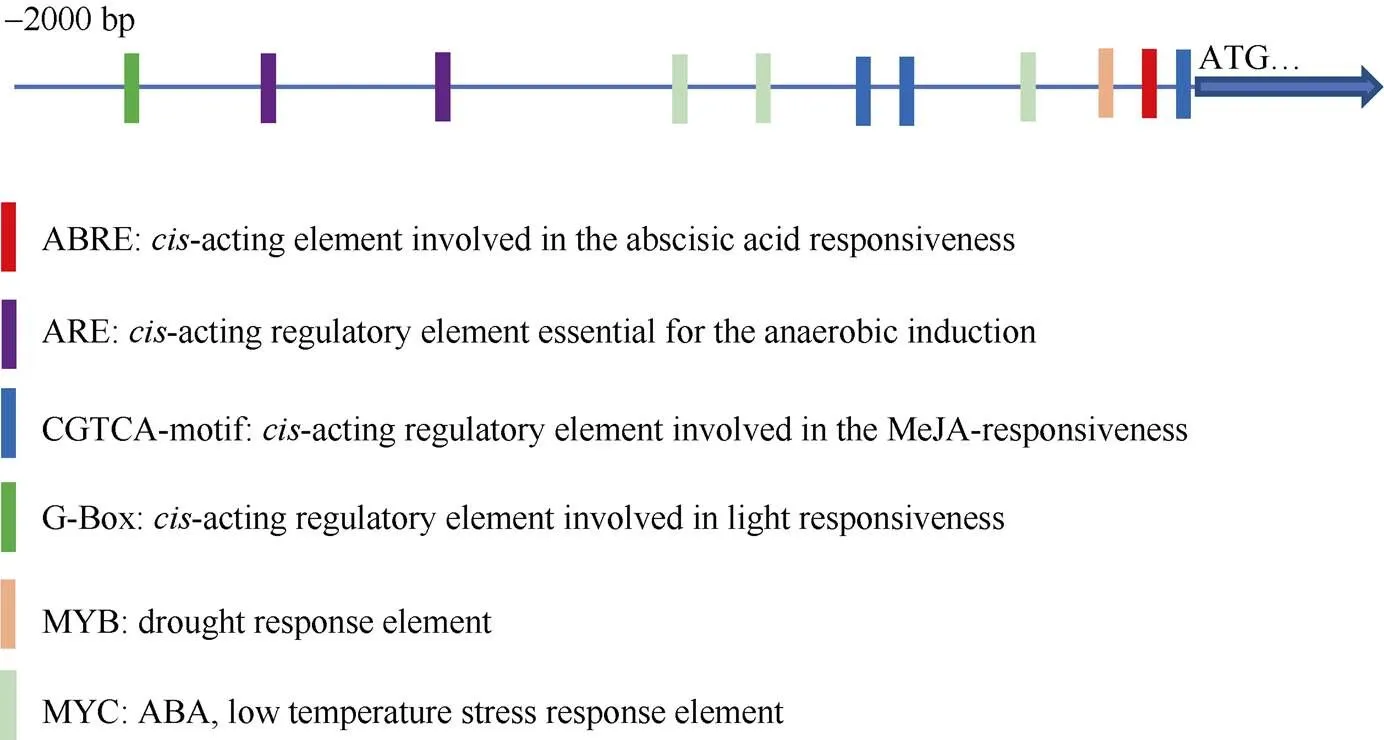
图3 ZmbHLH161启动子序列分析

图4 ZmbHLH161蛋白在玉米叶片原生质体中的亚细胞定位
GFP: GFP标记的ZmbHLH161在玉米原生质体的亚细胞定位; DAPI: DAPI标记的原生质体细胞核; Bright: 同一视野光镜下的原生质体; Merged: 光镜及荧光照片的叠加; CK: 转入空载体的原生质体; ZmbHLH161: 转入目的基因载体的原生质体; 标尺为3 µm。
GFP: GFP-labeled ZmbHLH161 subcellular localization in maize protoplasts; DAPI: DAPI-labeled protoplast nuclei; Bright: protoplasts under the same field of view light microscope; Merged: superposition of light microscope and fluorescence photos; CK: transfer empty vector protoplasts; ZmbHLH161: transfer into protoplast of target vector; Bar = 3 µm.
2.5 转基因拟南芥阳性植株鉴定
提取卡那霉素抗性阳性植株叶片DNA进行PCR检测,结果如图7所示, 阴性对照和野生型都无目的条带, 有3株转基因拟南芥含有目的基因。
2.6 转基因拟南芥的耐盐性分析
0 mol L–1NaCl浓度时野生型和转基因拟南芥均能正常生长, 当NaCl浓度为0.10 mol L–1和0.15 mol L–1时, 野生型和转基因拟南芥均能正常生长, 转基因拟南芥主根比野生型略长, 但差异不显著; 当NaCl浓度升为0.18 mol L–1时, 野生型和转基因拟南芥均不能正常生长, 叶片发黄枯死, 主根不生长, 无侧根(图8)。说明在转基因拟南芥响应盐胁迫过程中没有起到明显促进作用。
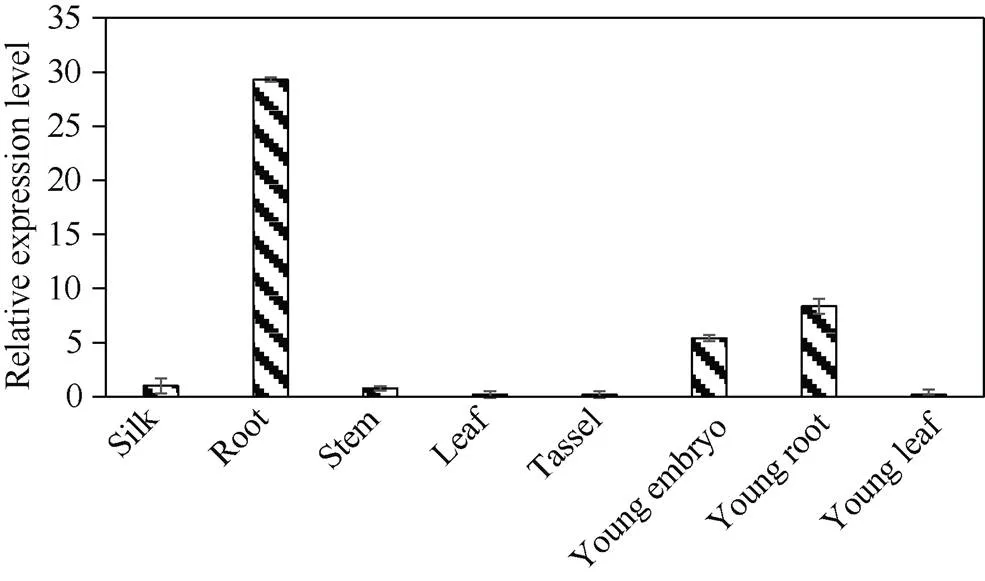
图5 ZmbHLH161在玉米不同组织中的相对表达量
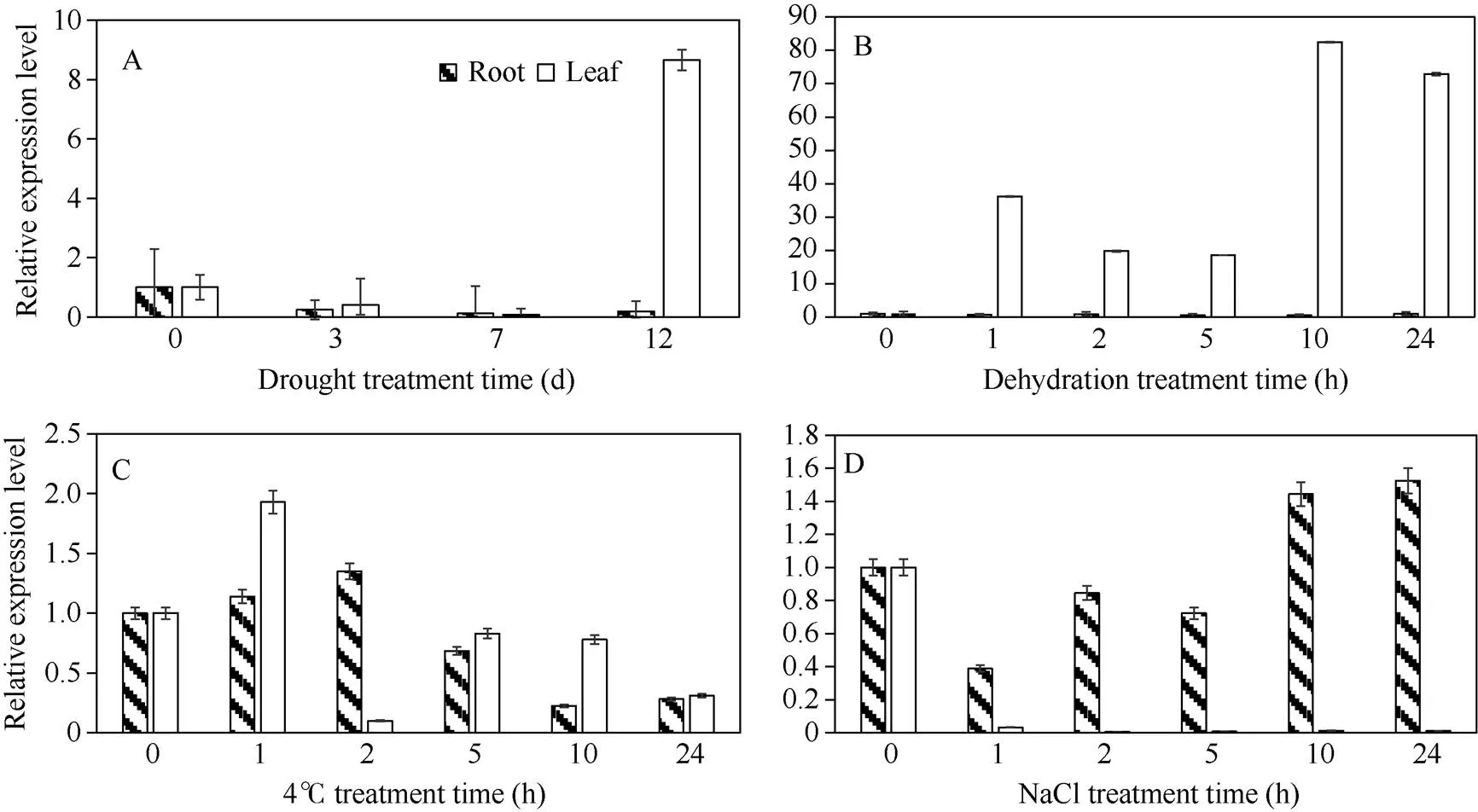
图6 实时荧光定量PCR分析不同处理条件下ZmbHLH161基因在叶片和根中的表达情况
A: 干旱处理; B: 脱水处理; C: 低温(4℃)处理; D: 高盐(200 mmol L–1NaCl)处理。数据为3个生物学重复±标准差。
A: drought treatment; B: dehydration treatment; C: cold (4℃) treatment; D: high salt (200 mmol L–1NaCl) treatment. The error bar represents ± SD of three biological replications.
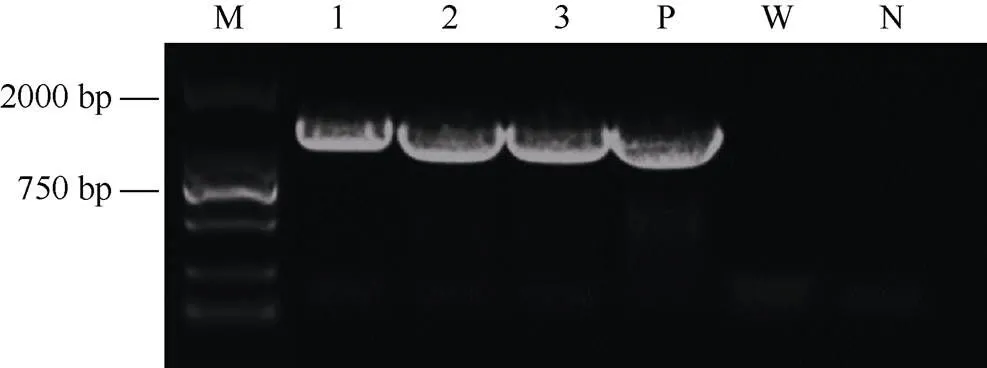
图7 T1代拟南芥PCR检测
M: DL2000 marker; P: 阳性对照; W: 野生型拟南芥; N: 阴性对照; 1~3: T1代拟南芥。
M: DL2000 marker; P: positive control; W: wild-type; N: negative control; 1–3: T1generation.
2.7 转基因拟南芥的耐甘露醇分析
由图9可知, 0 mol L–1甘露醇浓度时, 野生型和转基因拟南芥均能正常生长, 根系发达; 当甘露醇浓度为0.15 mol L–1时, 野生型和转基因拟南芥均能正常生长, 但转基因拟南芥根长明显长于野生型, 且差异显著(<0.05)。当甘露醇浓度为0.2 mol L–1时, 野生型和转基因拟南芥长势较弱, 叶片略微发黄, 转基因拟南芥主根比野生型略长, 差异显著(<0.05)。当甘露醇浓度为0.3 mol L–1时, 2种拟南芥叶片明显变黄, 生长明显受到影响, 植株细小, 其中OE-1和OE-2拟南芥主根长度较野生型拟南芥呈差异极显著水平(<0.01)。说明基因在拟南芥响应渗透胁迫过程中起到一定的促进作用。
3 讨论
转录因子是能与真核基因顺式作用元件相互作用的DNA结合蛋白, 起激活或者抑制转录的作用。近年来, 越来越多的研究关注各种转录因子在响应植物胁迫中的作用, bHLH转录因子也是其中之一。在干旱研究方面, Chen等[27]通过农杆菌介导法将和在水稻中过表达, 其结果表明可以显著提高对缺水胁迫的耐受性。Rozenn等[28]报道了缺失突变体对干旱胁迫的敏感性比野生型略高, 且过表达株系显示出侧根形成缺陷和对干旱胁迫的耐受性显著提高。Yao等[29]将苦荞基因在拟南芥中进行异源过表达, 结果显示其干旱和氧化耐受性增强, 这不仅归因于丙二醛(MDA)降低, 离子泄漏(IL)和活性氧(ROS)降低, 而且脯氨酸(Pro)含量高; 与野生型抗氧化剂活性相比较高, 转基因品系中的酶和光合作用效率更高。在盐胁迫研究方面, Li等[30]从东乡野生稻中分离并鉴定了bHLH蛋白基因, 在拟南芥中过表达此基因后增强了转基因拟南芥植株对冰冻和盐胁迫的耐受性; Zhou等[31]从野生稻克隆并鉴定的基因在拟南芥中的过表达赋予了其对盐和渗透胁迫的耐受性。Liu等[32]研究表明, 与野生型相比, 过表达转基因拟南芥对干旱、NaCl和渗透胁迫表现出更大的抗性。相反, bHLH122突变体比野生型植物对NaCl和渗透胁迫更敏感。在低温胁迫研究方面, Xu等[33]研究发现, 中国野生葡萄或耐冷种“黑龙江苗”VvbHLH1转录因子过表达不影响转基因拟南芥植物生长和发育, 但增强了对冷胁迫的耐受性。烟草bHLH转录因子, 响应冷胁迫(4℃), 过表达烟草在冷胁迫下表现出电解质泄漏较低, 丙二醛含量降低, H2O2和ROS积累, 这有助于减轻冷胁迫处理后对细胞膜的氧化损伤, 从而增强了转基因烟草植株耐寒性[34]。
A~D分别为0、0.10、0.15和0.18 mol L–1盐处理的生长情况; E: 不同盐浓度下拟南芥平均主根长度; WT: 野生型拟南芥; OE: 转拟南芥; 标尺为1.5 cm。
A–D indicates the seedling growth under the NaCl concentrations of 0, 0.10, 0.15, and 0.18 mol L–1; E: the average main root length; WT: wild type; OE:transgenic. Bar = 1.5 cm

图9 不同甘露醇浓度下转基因拟南芥根长比较
A~D分别为0、0.15、0.2和0.3 mol L–1甘露醇处理的生长情况; E: 不同甘露醇浓度下拟南芥平均主根长度; WT: 野生型拟南芥; OE: 转拟南芥; 标尺为1.5 cm。*和**分别表示转基因拟南芥主根长度较野生型呈差异显著水平(<0.05)和差异极显著水平(<0.01)。
A–D indicates the seedling growth under the mannitol concentrations of 0, 0.15, 0.2, and 0.3 mol L–1; E: the average main root length ofat different mannitol concentrations; WT: wild type; OE:of transgenic; Bar = 1.5 cm.*and**indicate that the root length of transgenicis significantly different from that of wild type (< 0.05) and the difference is extremely significant (<0.01).
本研究应用qPCR分析不同组织中表达情况, 结果表明该基因在不同时期多种组织中均有表达。其中以生长旺盛期根中表达量最高, 其次是幼根和幼胚, 因此推测可能参与根和幼胚生长发育调控。在转录起始密码子上游2 kb的DNA序列分析发现, 有多个与逆境胁迫、光反应等功能相关的顺式作用元件, 如ABRE、MYB、MYC等是响应盐、干旱、ABA、低温胁迫的响应元件。在脱水和干旱逆境处理中的叶片表达量上调程度最明显, 最高分别能达到对照的82.0倍和8.6倍, 推测参与植株体内干旱等逆境胁迫应答。利用不同浓度梯度NaCl和甘露醇处理过表达转基因拟南芥和野生型并统计根长, 结果表明, 甘露醇处理下转基因拟南芥主根比野生型长, 且差异显著(<0.05); 而在盐胁迫处理试验中, 转基因株系根系生长与野生型无显著差异。
[1] 刘天金, 王玉玺, 宁明宇, 靖飞, 董晓霞, 王志敏, 刘春青. 我国玉米种业转型升级的路径与策略探讨. 中国种业, 2018, (2): 1–7. Liu T J, Wang Y X, Ning M Y, Jing F, Dong X J, Wang Z M, Liu C Q. Discussion on the path and strategy of transformation and upgrading of China’s maize seed industry., 2018, (2): 1–7 (in Chinese).
[2] 余爱丽, 赵晋锋, 王高鸿, 杜艳伟, 李颜方, 张正. 玉米基因在盐、干旱等逆境胁迫下的表达分析. 玉米科学, 2016, 24(3): 31–35. Yu A L, Zhao J F, Wang G H, Du Y W, Li Y F, Zhang Z. Expression analysis ofgene under salt, drought and other stress., 2016, 24(3): 31–35 (in Chinese with English abstract).
[3] 张艳馥, 沙伟. 转录因子概述. 生物学教学, 2009, 34, (10): 7–8.Zhang Y F, Sha W. Overview of transcription factors., 2009, 34, (10): 7–8 (in Chinese).
[4] Murre C, McCaw P S, Baltimore D. A new DNA binding and dimerizing motif in immunoglobulin enhancer binding, daugtherless, MyoD, and MYC proteins., 1989, 56: 777–783.
[5] Nuno P, Liam D. Origin and diversification of basic- helix-loop-helix proteins in plants., 2010, 27: 862–874.
[6] Atchley W R, Fitch W M. A natural classification of the basic helix-loop-helix class of transcription factors., 1997, 94: 5172–5176.
[7] 罗赛男, 杨国顺, 石雪晖, 卢向阳, 徐萍. 转录因子在植物抗逆性上的应用研究. 湖南农业大学学报(自然科学版), 2005, 31: 219–223. Luo S N, Yang G S, Shi X H, Lu X Y, Xu P. On the application of transcription factors to plant stress resistance.(Nat Sci Edn), 2005, 31: 219–223 (in Chinese with English abstract).
[8] Anna-Marie S, Sandra K, Ulrike S, Unte P H, Koen D, Heinz S. TheABORTED MICROSPORES () gene encodes a MYC class transcription factor., 2003, 33: 413–423.
[9] Dany H, Hidenori S. Antagonistic actions of HLH/bHLH proteins are involved in grain length and weight in rice., 2012, 7: e31325.
[10] Ikeda M, Mitsuda N, Ohme-Takagi M. ATBS1 INTERACTING FACTORs negatively regulatecell elongation in the triantagonistic bHLH system., 2013, 8: e23448.
[11] Endo T, Fujii H, Sugiyama A, Nakano M, Nakajima N, Ikoma Y, Omura M. Overexpression of a citrus basic helix-loop-helix transcription factor (), which is homologous toactivation-tagged bri1 suppressor 1 interacting factor genes, modulates carotenoid metabolism in transgenic tomato., 2016, 243: 35–48.
[12] Danielle M F, Jennifer N, Takamichi M, Julin N M, José A, Joseph R E, Masaki F, Joanne C. Three redundant brassinosteroid early response genes encode putative bHLH transcription factors required for normal growth., 2002, 162: 1445–1456.
[13] Ni M, Tepperman J M, Quail P H. Binding of phytochrome B to its nuclear signalling partner PIF3 is reversibly induced by light., 1999, 400: 781–784.
[14] Huq E. PIF4, a phytochrome-interacting bHLH factor, functions as a negative regulator of phytochrome B signaling in., 2002, 21: 2441–2450.
[15] Kiribuchi K, Jikumaru Y, Kaku H, Minami E, Hasegawa M, Kodama O, Seto H, Okada K, Nojiri H, Yamane H. Involvement of the basic helix-loop-helix transcription factor RERJ1 in wounding and drought stress responses in rice plants., 2005, 69: 1042–1044.
[16] Li H M, Sun J Q, Xu Y X, Jiang H L, Wu X Y, Li C Y. The bHLH-type transcription factorpositively regulates ABA response in., 2007, 65: 655–665.
[17] Jiang Y Q, Yang B, Deyholos M K. Functional characterization of thebHLH92 transcription factor in abiotic stress., 2009, 282: 503–516.
[18] Chinnusamy V, Ohta M, Kanrar S, Lee B H, Hong X H, Agarwal M, Zhu J K. ICE: a regulator of cold-induced transcriptome and freezing tolerance in., 2003, 17: 1043–1054.
[19] Ogo Y, Itai R N, Nakanishi H, Kobayashi T, Takahashi M, Mori S, Nishizawa N K. The rice bHLH proteinis an essential regulator of the genes involved in Fe uptake under Fe-deficient conditions., 2007, 51: 366–377.
[20] Li Z X, Liu C, Zhang Y, Wang B M, Ran Q J, Zhang J R. The bHLH family memberregulates drought tolerance in maize by promoting root development and abscisic acid synthesis., 2019, 70: 5471–5486.
[21] Bailey P C, Martin C, Toledo-Otriz G, Quail P H, Huq E, Heim M A, Jakoby M, Werber M, Weisshaar B. Update on the basic helix-loop-helix transcription factor gene family in., 2003, 15: 2497–2501.
[22] Li X, Duan X, Jiang H X, Sun Y J, Tang Y P, Yuan Z, Guo J K, Liang W Q, Chen L, Yin J Y, Ma H, Wang J, Zhang D B. Genome-wide analysis of basic/helix-loop-helix transcription factor family in rice and., 2006, 141: 1167–1184.
[23] Zhang T T, Wei L, Zhang H S, Ma L, Li P H, Ge L, Li G. Genome-wide analysis of the basic Helix-Loop-Helix (bHLH) transcription factor family in maize., 2018, 18: 235.
[24] Yoo S D, Cho Y H, Sheen J.mesophyll protoplasts: a versatile cell system for transient gene expression analysis., 2007, 2: 1565–1572.
[25] Livak K J, Schmittgen T D. Analysis of relative gene expression data using real-time quantitative PCR and the 2–∆∆CTmethod., 2001, 25: 402–408.
[26] Clough S J, Bent A F. Floral dip: a simplified method for Agrobacterium mediated transformation of., 1998, 16: 735–743.
[27] Chen J Q, Meng X P, Zhang Y, Xia M, Wang X P. Over-expression ofgenes lead to enhanced drought tolerance in rice., 2008, 30: 2191–2198.
[28] Rozenn L H, Mathieu C, Dipankar C, Thomas M, Catherine B. Attranscription factor contributes to the regulation of ABA homeostasis and drought stress tolerance in., 2017, 160: 312–327.
[29] Yao P F, Li C L, Zhao X R, Li M F, Zhao H X, Guo J Y, Cai Y, Chen H, Wu Q. Overexpression of a tartary buckwheat gene,, Enhances drought/oxidative stress tolerance in transgenic., 2017, 8: 625.
[30] Li F, Guo S Y, Zhao Y, Chen D Z, Chong K, Xu Y Y. Overexpression of a homopeptide repeat-containing bHLH protein gene () from Dongxiang wild rice confers freezing and salt tolerance in transgenic., 2010, 29: 977–986.
[31] Zhou J, Li F, Wang J L, Ma Y, Chong K, Xu Y Y. Basic helix-loop-helix transcription factor from wild rice () improves tolerance to salt and osmotic stress in., 2009, 166: 1296–1306.
[32] Liu W W, Tai H H, Li S S, Gao W, Zhao M, Xie C X, Li W X. bHLH122 is important for drought and osmotic stress resistance inand in the repression of ABA catabolism., 2014, 201: 1192–1204.
[33] Xu W R, Zhang N B, Jiao Y T, Li R M, Xiao D M, Wang Z. The grapevine basic helix-loop-helix (bHLH) transcription factor positively modulates CBF-pathway and confers tolerance to cold-stress in., 2014, 41: 5329–5342.
[34] Zhao Q, Xiang X, Liu D, Yang A, Wang Y. Tobacco transcription factorconfers tolerance to cold stress by regulating thepathway and reactive oxygen species homeostasis., 2018, 9: 381.
Cloning and functional analysis ofgene in maize
YANG Meng-Ting1,2,**, ZHANG Chun2,**, WANG Zuo-Ping2, ZOU Hua-Wen1,*, and WU Zhong-Yi2,*
1College of Agriculture, Yangtze University, Jingzhou 434023, Hubei, China;2Beijing Agro-Biotechnology Research Center, Beijing Academy of Agriculture and Forestry Sciences / Beijing Key Laboratory of Agricultural Gene Resources and Biotechnology, Beijing 100097, China
bHLH transcription factors are the second largest family of transcription factors in plants and play an important role in regulating plant growth and development, signal transduction, and stress response. In order to study the function of maize bHLH family genes in response to stress,(AC: NC_AQK75074) gene from maize root tissue was cloned in this study. Bioinformatic analysis showed that this gene contains 3 exons, the full-length of its cDNA is 1460 bp, coding sequence is 1059 bp in length, encoding 352 amino acids. It exists as a single copy in the maize genome and its function is unknown. The molecular weight of ZmbHLH161 protein is 37.1 kD, and its theoretical isoelectric point is 6.10, with a conserved domain unique to the bHLH transcription factor family, but does not have a transmembrane structure or signal peptide. It is a hydrophilic protein, and the secondary structure of the protein has a maximum proportion of 42.05%. Transient expression experiments in maize protoplasts showed that ZmbHLH161 was localized in the nucleus. Real-time quantitative PCR (qPCR) analysis showed that under normal growth conditions,was mainly expressed in roots and immature embryos, while under dehydration and drought treatment,was up-regulated in maize seedling leaves. After treated with different concentrations of NaCl, the root length oftransgenic heterologousstrains was not significantly different from that of wild type, and their root was longer than that of wild type after being treated with different concentrations of mannitol. It is speculated thatgene may be involved in the response of maize to osmotic stress.
maize;; transcription factor; protoplast; qPCR; osmotic stress
本研究由北京市农林科学院青年基金项目(QNJJ201724), 北京市农林科学院科技创新能力建设专项(KJCX20200204, KJCX20200205, KJCX 20200407)和国家自然科学基金项目(31971839, 31471510)资助。
This study was supported by the Beijing Academy of Agricultural Youth Fund (QNJJ201724), the Beijing Academy of Agricultural and Forestry Sciences (KJCX20200204, KJCX20200205, KJCX20200407), and the National Natural Science Foundation of China (31971839, 31471510).
邹华文, E-mail: zouhuawen73@hotmail.com; 吴忠义, E-mail: zwu22@126.com
**同等贡献(Contributed equally to this work)
杨梦婷, E-mail: yangmengting213@163.com; 张春, E-mail: spring2007318@163.com
2020-03-28;
2020-06-02;
2020-06-22.
URL: https://kns.cnki.net/kcms/detail/11.1809.S.20200622.1447.016.html
10.3724/SP.J.1006.2020.03022

