EMS合并EP性不孕患者的VCAM-1、Bcl-2表达
赵岷慧,柯慧芳
(武汉仁爱医院妇科,湖北武汉 430030)
子宫内膜异位症(EMS)及子宫内膜息肉(EP)均属于雌激素依赖性疾病[1]。两者均可能造成月经紊乱及不孕症,严重影响患者生命健康。有研究显示,EMS及EP的发生均与炎性反应、细胞凋亡异常有关[2],而血管细胞黏附因子-1(VCAM-1)属于免疫球蛋白超家族,可参与免疫应答[3],B细胞淋巴瘤-2(Bcl-2)蛋白又称白血病基因-2蛋白,在调节细胞凋亡中发挥重要功效[4]。本研究分析了VCAM-1与Bcl-2蛋白在EMS合并EP性不孕患者中的表达及其与疾病的相关性,现报道如下。
1 资料与方法
1.1一般资料 将本院2018年1月至2019年1月收治的56例EMS合并EP性不孕患者纳为研究A组,54例EP性不孕患者纳为研究B组。EMS合并EP性不孕患者纳入标准:(1)患者符合《2015年子宫内膜异位症的诊治指南》[5]中EMS相关诊断标准,并经手术后病理检查确诊为EMS;(2)术中发现子宫腔内赘生物,经病理检查证实为EP,均为单发息肉;(3)患者婚后性生活正常,且未避孕,同居两年及以上但未受孕,符合不孕症诊断标准[6]。EP性不孕患者纳入标准:患者经宫腔镜检查、手术取子宫内赘生物,病理检查证实为EP,均为单发息肉,且EP是其不孕的唯一病因。研究对象排除标准:合并其他内科并发症者,男方因素不孕者,合并恶性肿瘤者,收集标本前3个月使用过甾体类激素药物治疗者。两组一般资料比较,差异无统计学意义(P>0.05),见表1。
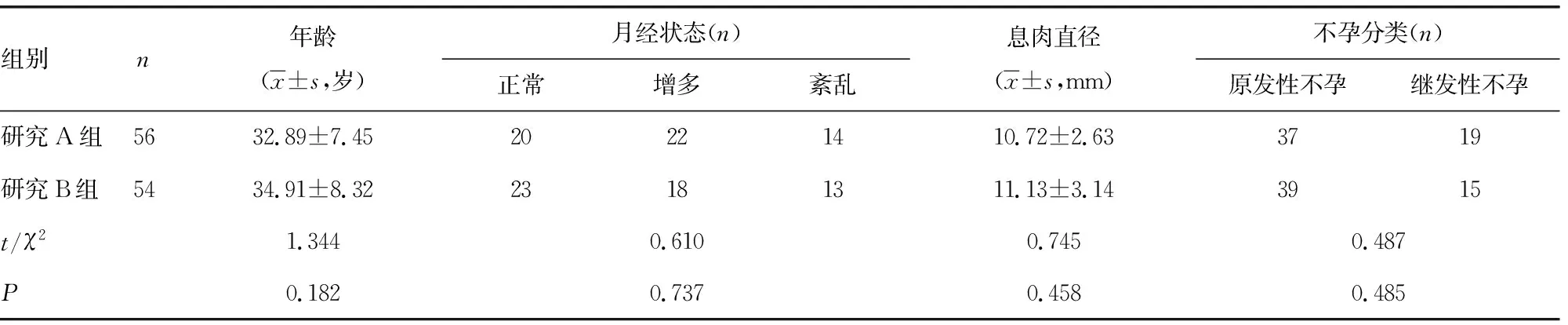
表1 两组一般资料比较
1.2方法
1.2.1标本采集 于患者月经干净后3~7 d内行手术,使用0.9%氯化钠溶液作为膨宫介质,在电镜下完全抓取EP组织,同时采集研究A组患者异位内膜组织,快速放入RNA-guard中,4 ℃过夜,-80 ℃保存待用。
1.2.2免疫组织化学法检测 (1)标本采用10%甲醛溶液固定,石蜡包埋,每份标本连续切片5 μm×5片。(2)切片常规二甲苯脱蜡,梯度乙醇复水化,蒸馏水中洗10~15 min。(3)应用30%氧化氢甲醇液室温下孵育切片15 min后,使用自来水冲洗5 min,蒸馏水冲洗10~15 min。(4)0.01 mol/L磷酸盐缓冲液(PBS)冲洗5次,每次2 min,并吸干切片边缘水滴。(5)将切片置于微波炉中加热3次,每次5 min,以恢复抗原。(6)使用5%正常羊血清室温孵育20 min,减少非特异性反应背景。(7)加一抗37 ℃孵育1 h。(8)PBS冲洗5次,每次2 min,吸干切片边缘水滴。(9)滴加二抗37 ℃孵育1 h。(10)PBS冲洗5次,每次2 min,吸干切片边缘水滴。(11)每张切片滴加50 μL即用型Max VisionTM试剂,37 ℃孵育10~15 min。(12)PBS液洗5次,每次2 min,吸干切片边缘水滴。(13)加二氨基联苯胺(DAB)H2O2显色液,室温下显色15 min。(14)自来水冲洗1 min。(15)苏木素复染。(16)梯度乙醇脱水,二甲苯透明。(17)中性树胶封片。
1.2.3免疫组织化学法检测结果的判断 VCAM-1及Bcl-2主要表达于细胞质内,呈棕褐色或棕色颗粒表达,染色结果根据SinicroPe改良法判断[7]。染色细胞计数<5%、5%~<25%、25%~<50%、50%~<75%、≥75%分别记为0、1、2、3、4分;染色强度为淡黄色、棕色、深棕色时分别记为1、2、3分。每份切片记分=染色细胞计数得分×染色强度得分,切片记分0~<2分为阴性(-),2~<4分为弱阳性(+),4~6分为中等阳性(++),>6分为强阳性(+++)。免疫组织化学法检测结果由同一位观察者判断。
1.3观察指标 (1)比较研究A组与研究B组EP组织内VCAM-1及Bcl-2蛋白表达结果。(2)将息肉最大径<3 mm的息肉判定为小息肉,息肉最大径≥3 mm的息肉判定为大息肉,比较研究A组大息肉及小息肉组织中的VCAM-1及Bcl-2蛋白表达结果。(3)比较研究A组异位内膜与息肉组织中VCAM-1及Bcl-2蛋白表达结果。(4)分析研究A组患者EP组织内VCAM-1蛋白表达与Bcl-2蛋白表达间的关系。

2 结 果
2.1研究A组与研究B组EP组织内VCAM-1及Bcl-2蛋白表达量比较 研究A组EP组织中VCAM-1及Bcl-2蛋白表达量明显高于研究B组,差异均有统计学意义(P<0.05)。见表2。

表2 研究A组与研究B组EP组织内VCAM-1及Bcl-2蛋白表达量比较分)
2.2研究A组大息肉及小息肉组织内VCAM-1及Bcl-2蛋白表达量比较 研究A组中大息肉组织中VCAM-1及Bcl-2蛋白表达量明显高于小息肉组织,差异有统计学意义(P<0.05)。见表3。

表3 研究A组大息肉及小息肉组织内VCAM-1及Bcl-2蛋白表达量比较分)
2.3研究A组异位内膜与息肉组织内VCAM-1及Bcl-2蛋白表达量比较 研究A组息肉组织内VCAM-1及Bcl-2蛋白表达量明显低于异位内膜组织,差异有统计学意义(P<0.05),见表4。

表4 研究A组患者异位内膜与息肉组织VCAM-1及Bcl-2蛋白表达量比较分)
2.4研究A组患者EP组织内VCAM-1与Bcl-2蛋白表达的相关分析 EMS合并EP性不孕患者息肉组织中VCAM-1及Bcl-2蛋白表达无相关(r=0.078,P=0.654)。
2.5免疫组织化学法检测图片结果 免疫组织化学法检测典型图片结果见图1。
3 讨 论
EP由子宫局灶性内膜增生过盛所致,是一种瘤样性病变,EP可引起不孕、月经增多、子宫内膜炎及子宫出血等,严重影响患者生活质量。EMS指子宫内膜组织出现在子宫体以外部位,相关研究显示,EMS合并不孕患者EP发生率较高,探讨EMS合并EP性不孕的致病机制,对改善患者妊娠结局有重要意义[8]。
目前,EP的致病机制尚不明确,一般认为EP的发生与炎性反应关系密切。子宫内膜在长期反复的机械刺激与生物致炎因子的作用下,将出现基因突变,并通过自分泌或旁分泌促进内膜细胞增生及分化,形成肿瘤样赘生物[9]。VCAM-1属于免疫球蛋白超家族,是重要的细胞黏附分子,很大程度上白细胞在炎性反应组织的浸润程度由局部产生的VCAM-1等黏附分子介导。有研究发现,VCAM-1能促进单核细胞在动脉内膜中的聚集,进而参与动脉粥样硬化,并能与T细胞上活化的VLA-4结合,进而介导T、B细胞间的接触,促进免疫细胞增殖,参与免疫应答[10-11]。
本研究比较了单纯EP性不孕患者(研究B组)及EMS合并EP性不孕患者(研究A组)EP组织中VCAM-1的表达情况发现,研究A组患者EP组织内VCAM-1阳性表达量更高,提示EMS合并EP患者息肉组织内存在免疫异常,此外,随着息肉体积的增大,研究A组患者EP内VCAM-1蛋白表达量上升,提示EP中VCAM-1与息肉组织生长及EMS发展间关系密切[12]。
有研究显示,EP的发生与细胞凋亡机制密切相关[13]。Bcl-2是一种原癌基因,在调节细胞凋亡中具有重要作用。Bcl-2的过度表达可抑制细胞的程序性死亡,延迟正常细胞分化,进而延长细胞寿命,增加基因突变概率,促使肿瘤等增殖性疾病的发生[14]。本研究发现,EMS合并EP性不孕患者息肉组织中Bcl-2蛋白阳性表达量明显高于EP性不孕患者,提示EMS合并EP者息肉组织凋亡程序紊乱情况更为严重,息肉组织难以像正常子宫内膜组织一样脱落。此外,大息肉组织中Bcl-2表达量也较小息肉组织中高,这从另一方面证实了Bcl-2表达量高可能促使息肉组织成长。
4 结 论
EMS合并EP性不孕患者EP组织中VCAM-1及Bal-2蛋白表达量明显高于单纯EP性不孕患者,但在EMS合并EP性不孕患者异位内膜组织中VCAM-1及Bcl-2蛋白表达量高于息肉组织,推测异位内膜组织可能会导致息肉组织增生,但其中的具体机制尚不明确。

