L-岩藻糖对大鼠肝癌射频消融术后乏氧微环境中HIF-1α、MMP-2、VEGF表达的影响*
史传文 贾成功 张 燕
1.山东省泰山医院外科 (山东 泰安, 271000) 2.山东省阳谷县人民医院普外科
原发性肝癌是我国最常见的恶性肿瘤之一,治疗方法尚无突破性进展,局部射频消融治疗已成为肝癌治疗的3大主要手段之一,临床应用较广泛,使无手术机会及复发转移的肝癌患者受益。但在患者随访过程中也发现,治疗一段时间后往往在残余病灶边缘或远处器官又出现浸润转移灶,不可否认,这是射频消融治疗中的常见情况,也是限制其疗效的重要原因。大量的临床观察和动物实验均表明射频消融术后极易造成肿瘤微环境出现缺氧状态,因缺氧而产生的乏氧诱导因子1-α(HIF-1α)可通过多途径间接促进肿瘤细胞的侵袭及转移,使得肿瘤细胞和间质细胞合成血管内皮生长因子(VEGF) 、基质金属蛋白酶-2(MMP-2)增加,促进肿瘤新生血管生成。降解细胞外基质(ECM),从而促进肿瘤浸润与转移[1]。本研究探讨肝癌模型大鼠射频消融术后L-岩藻糖对肝癌组织中HIF-1α、VEGF、MMP-2表达的影响。
1 材料与方法
1.1 材料
1.1.1 动物和细胞株 Wistar大鼠,雄性,230 g±45 g,购于山东省医学科学院试验动物中心。合格证号:28050615;Walker-256瘤株购于上海医药工业研究所,细胞库目录编号:QK10956。
1.1.2 药品和试剂 L-岩藻糖标准品,批号:20080526 规格:0.1 g/粒;上海西宝生物科技有限公司。HIF-1α抗体及MMP-2抗体(浓缩型)、VEGF抗体,ZLI-9052浓缩型DAB试剂盒,购自北京中杉金桥生物技术有限公司;SP7042免疫组化染色试剂盒(美国Zymed公司)。
1.2 造模及分组 复苏癌株后注射于大鼠腹腔内,2周后抽取腹水进行离心,得癌组织悬液,将癌组织洗涤后接种于Wistar大鼠后肢皮下,1周后待皮下长出瘤结节,无菌条件下取出实体瘤,取近瘤体边缘的新鲜组织,切成1 mm3大小的瘤组织块。体重220 g左右Wistar雄性大鼠100只,2%戊巴比妥钠腹腔麻醉后固定,安尔碘消毒,剖腹选近腹壁体积较大肝叶作为种植床,鈍头穿刺针刺破包膜,于肝表面30度刺入,形成深约3 mm隧道,将瘤块植入,明胶海绵覆压创口,无持续出血后关腹消毒腹壁切口[2-6]。术后将大鼠取侧卧位,置于饲养箱,保持室温25℃~30℃。80只大鼠造模成功。将80只模型大鼠随机分为5组:非射频消融组(简称空白对照组)、射频消融+生理盐水组(简称盐水对照组)、射频消融+L-岩藻糖小剂量组(简称小剂量组)、射频消融+L-岩藻糖中剂量组(简称中剂量组)、射频消融+L-岩藻糖大剂量组(简称大剂量组),每组16只。L-岩藻糖按照人推荐量的5、10、20倍设定3个给药剂量,即低剂量0.08 g/kg、中剂量0.16 g/kg、大剂量0.33 g/kg。于射频消融术后次日开始对3组L-岩藻糖大鼠,分别以3种剂量灌胃,1次/d,灌胃量为20 ml/kg;空白对照组和盐水对照组大鼠采用相同体积生理盐水灌胃,1次/d。连续灌胃20 d后,于21d处取大鼠,取标本备用。
1.3 射频消融治疗方法 采用美国RITA 1500X型消融仪,单极电针单点消融。在戊巴比妥钠腹腔麻醉下,切开穿刺点皮肤2 mm,经超声定位引导下将电极针经皮穿刺进入肿瘤结节内,消融范围覆盖整个癌灶及周围0.5~1 cm的癌旁组织。消融仪设置输出功率150 W,开始消融后针尖逐渐升温,达到靶温度105℃后维持10 min。消融结束后将消融仪设定为针道消融模式,逐步退针。
1.4 血样及标本收集 于射频消融术后第21d处死动物,于大鼠腹主动脉取血4ml,收集血样存于试管中,室温静置30 min后低温离心( 3000 r/min,10 min),分离所得血清,于-70℃冰箱保存。大鼠肝脏经10%甲醛固定,将消融癌灶中心凝固型坏死组织及消融癌灶周围0.5mm残留及癌旁组织整体进行石蜡包埋,5 μm连续切片。
1.5 免疫组化染色及判定 采用免疫组化染色法检测肿瘤组织中HIF-1α、MMP-2、VEGF表达水平。一抗分别为兔抗大鼠HIF-1α、兔抗大鼠MMP-2、兔抗大鼠VEGF, 工作浓度均为1∶100)。用已知阳性切片在同条件下染色作为阳性对照,用PBS替代一抗作阴性对照,染色步骤严格按试剂说明书进行。计数表达HIF-1α、MMP-2、VEGF的瘤细胞数,每组20个视野计算阳性细胞表达百分率。[7-9]
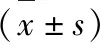
2 结果
2.1 5组大鼠射频消融术后癌旁组织HIF-1α表达情况 见表1。免疫组化染色显示,HIF-1α在瘤体边缘中普遍表达,主要位于肿瘤细胞核中,细胞质中表达较弱。在正常肝组织中呈低表达;在癌旁组织中表达不均匀,部分区域中心表达增强;其在坏死组织中不表达,术后肿瘤坏死组织周围及含纤维素较多的肿瘤细胞条索中其表达最强。

表1 5组大鼠术后癌旁组织HIF-1α表达结果比较
2.2 5组大鼠术后癌旁组织MMP-2表达情况 见表2。免疫组化染色显示,MMP-2阳性细胞较多见于肿瘤及其瘤周肝组织中,阳性呈淡黄色颗粒多见于瘤体边缘细胞胞浆中和靠近细胞膜处,细胞核几乎不染色。瘤体实质中央部分阳性细胞呈黄染,且着色多见于胞浆部分,少量细胞间质亦有浅染;在正常肝组织中MMP-2无表达;癌旁组织中常见其表达,呈浅黄色颗粒,多见于癌边缘细胞的胞浆中和细胞膜周围,细胞核几乎不染色;3个L-岩藻糖组大鼠癌旁组织中MMP-2表达较两对照组明显减少,在有炎性细胞浸润的癌旁组织细胞中及有纤维组织包绕的瘤细胞条索内,呈均匀的黄褐色染色颗粒。

表2 5组大鼠术后癌旁组织MMP-2表达比较
2.3 5组大鼠术后癌旁组织VEGF表达情况 见表3。免疫组化染色显示VEGF表达主要集中在癌旁坏死区周围及消融后残存癌组织的细胞膜和细胞质中,可见灶状分布的VEGF强阳性染色细胞,与瘤体附近新生血管的分布较为一致; 在瘤周正常肝细胞为弱染色。

表3 5组大鼠术后癌旁组织VEGF表达结果比较
3 讨论
L-岩藻糖是糖蛋白中糖链的组成成分,由于其在第六碳原子上缺一个羟基,疏水性强,故存在于各类细胞表面的质膜上,在抗癌靶向新药研发中,抗体-药物偶联物和胞外药物偶联系统都运用了卡博(CarboConnect)技术[10,11],即利用L-岩藻糖+氨基将抗体和药物联接,用于筛选不同的活性药物。L-岩藻糖广泛地存在于海藻及树胶中,具有多种生物学活性。本研究中所用L-岩藻糖标准品,是提取后经酸处理中和后,以苯腙析出,除去苯肼后所得的α-L-岩藻糖结晶[12,13]。
多项研究表明, L-岩藻糖能促进小鼠T细胞增殖反应,对细胞具有免疫调节、抗肿瘤、诱导细胞分化等多种功效。近年肿瘤研究领域对L-岩藻糖生物活性的研究越来越重视,张祺等[12]研究显示L-岩藻糖具有可抑制移植肿瘤生长,抗血管生成作用,董磊等13发现其可以降低皮肤中蛋白水解酶MMP-2与MMP-9活性。
正常生理条件下,人体组织平均氧分压为40 mmHg,当环境氧分压小于或等于14 mmHg时,被称为乏氧环境。肝脏为富血供器官,肿瘤细胞在肝脏,尤其在肝血窦的微环境中生长迅速。肿瘤增殖过程中氧耗量增加,导致生长环境局部乏氧,这是多数实体肿瘤的特征。在射频消融术后,肿瘤发生凝固性坏死,理论上可灭活肿瘤及其周边2 cm以上的正常组织。本研究中大鼠造模成功20d后,大鼠肝脏肿瘤已达1~2cm,我们观察到,射频消融术后,局部肿瘤组织发生不可逆性的凝固性坏死、缺血,继而触发炎症反应,使肿瘤坏死灶边缘出现成纤维细胞和炎性细胞,并逐渐包围坏死区,形成2~3mm厚的增生带, 此区域内有成纤维细胞, 纤维细胞,部分肿瘤细胞及多核巨细胞,即肿瘤相关巨噬细胞(TAMs)。在乏氧环境中,HIF-1α信号通路、TAMs和肿瘤细胞均可通过诱导VEGF表达刺激血管生成,TAMs还可通过释放MMP-2等细胞因子改变微环境,提高细胞的侵袭性和运动性[14]。
金属蛋白酶是细胞外基质代谢的主要调节者,肿瘤细胞依靠金属蛋白酶降解细胞外基质从而促进其浸润与转移。现已发现MMPs有20余种,几乎可降解细胞外基质的所有成分。射频消融术可造成术后肿瘤微环境的乏氧状态,进一步诱导HIF1-α的产生。而HIF1-α的产生与肿瘤细胞及间质细胞MMP-2的合成有着密切关系。MMP-2降解基质胶原,有利于快速增殖的肿瘤细胞摆脱ECM的束缚,进而加速迁移,这是肿瘤细胞向周围组织浸润的生化基础。进一步了解这个过程,对肿瘤的治疗有积极意义[15]。在本实验中,我们建立了大鼠移植性肝癌模型,并对模型大鼠进行射频消融术,从肿瘤乏氧的角度观察L-岩藻糖对术后肿瘤局部微环境乏氧状态下与肿瘤侵袭相关的HIF-1α、MMP-2、VEGF表达的影响,结果显示术后HIF-1α表达增高,提示射频消融术后可能加重肿瘤局部微环境的乏氧状况,而L-岩藻糖显著降低肿瘤局部尤其是瘤体边缘的HIF-1α的表达,说明L-岩藻糖对于术后肿瘤乏氧环境具有改善作用;L-岩藻糖还显著降低肿瘤局部微环境中MMP-2的合成,提示L-岩藻糖可能通过改善术后肿瘤乏氧,抑制肿瘤细胞运动,而起到间接抑制肿瘤侵袭转移的作用。我们认为这与改善肿瘤乏氧状态关系密切,其机制可能与疏水性强的L-岩藻糖通过细胞膜途径改善细胞代谢有关。需要在后续研究中深入探讨。结果表明L-岩藻糖并没有明显改善模型大鼠预后,这可能与该模型的生存时间短及给药时间也相对较短有一定关系,在后续研究中,我们将设法延长模型动物生存期以延长给药时间。综上所述,L-岩藻糖可通过改善肿瘤乏氧内环境,抑制VEGF、MMP-2的合成而抑制肿瘤的发生发展。

