不同病原菌化脓性脑膜炎患儿的临床特点对比分析
陈志卿 周 丹 林芳芳
福建省妇幼保健院新生儿科,福建福州 350001
新生儿化脓性脑膜炎(neonatal purulent meningitis,NPM)是指新生儿化脓性细菌(出生至28 d)引起的中枢性感染,这是新生儿期的一种重要疾病,具有高发病率、高残疾率和高死亡率等特点[1]。尽管发达国家的死亡率已大大降低,但长期并发症如残留癫痫、认知障碍、听力损失、视力障碍和痉挛瘫痪仍然是引起人们关注的主要原因[2]。不同地区、甚至同一地区不同时期NPM的细菌流行谱可能不同。笔者对过去3年在本院新生儿救护中心收治的NPM的临床表现、相关实验室检查、病原体分布和耐药细菌分析进行了回顾性研究,旨在了解本地区不同病原菌的NPM的临床特征,使抗生素应用更加合理有效,为临床经验性治疗NPM 提供依据。
1 资料与方法
1.1 一般资料
回顾性分析2014年1月1日~2016年12月31日福建省妇幼保健院新生儿科收治的符合入选条件的化脓性脑膜炎患儿的病例资料。本研究符合《赫尔辛基宣言》要求。纳入标准:①具有新生儿感染和NPM临床表现;②脑脊液(cerebrospinal fluid,CSF)常规、生化检查符合化脓性脑膜炎脑脊液改变(白细胞计数>20×106/L,蛋白含量早产儿>1.5 g/L 和足月儿>1.0 g/L,葡萄糖浓度低于外周血血糖的50%,足月儿<1.7 mmol/L 或早产儿<1.1 mmol/L);③血培养或者脑脊液培养检出病原菌,并除外可能污染的病原菌[3-5];④诊断日龄≤28 d。排除标准:①合并先天性神经系统发育畸形如脊柱裂、脑脊膜膨出以及先天性遗传代谢病;②住院时间短,诊断未明确前自动出院,或者资料不完整。根据血培养或CSF培养结果,将研究对象分为三组,具体如下。①无乳链球菌(Streptococcus agalactiae,GBS)组15例:培养为GBS;②其他细菌组14例:培养为GBS 以外的细菌;③病原菌不明组105例:血培养和脑脊液培养均阴性组。研究期间纳入符合标准的NPM患儿总共134例,其中GBS组15例,其他细菌组14例,病原菌不明组105例。134例NPM患儿中,男86例,女48例;胎龄28~41周,平均(38.04±2.73) 周;早产儿24例,足月儿110例;出生体重1.10~4.32 kg,平均(3.08±0.61)kg;入院日龄1~28 d,平均(12.64±8.27)d;住院时间为4~70 d,平均(23.42±11.05)d。GBS组、其他细菌组及病原菌不明组的性别、出生体重、胎龄、发病日龄、住院时间比较,差异无统计学意义(P>0.05)(表1),具有可比性。
1.2 研究方法
收集符合标准的NPM患儿的资料,比较各组的临床资料,包括性别、出生体重、出生胎龄、发病日龄、住院时间、临床表现、并发症、血液和脑脊液培养结果、脑脊液检查结果、发病时血常规结果、抗菌药物使用、总抗菌药物疗程及临床转归情况。
细菌性脑膜炎早发型是指出生后7 d 内获得感染,8~28 d 获得感染为晚发型[3];并发症(硬膜下积液、脑室膜炎、脑脓肿、脑积水)的诊断[3]主要根据临床表现及头颅MRI 异常结果。临床转归中,治愈是指疗程足够,临床症状及体征消失,血液和CSF 阴性,CSF 白细胞数、葡萄糖、蛋白浓度均恢复至正常水平;好转是指疗程足够,临床症状、体征消失,血液和CSF培养阴性,CSF 白细胞和血液感染指标恢复正常,仅蛋白和(或)葡萄糖水平尚未恢复正常。足疗程是指革兰阳性菌感染至少2周,革兰阴性菌感染至少3周。
1.3 统计学方法
采用SPSS 19.0 统计软件进行数据分析,计量资料中连续变量呈正态分布者用均数±标准差(±s)表示,采用单因素方差分析,两两比较采用t 检验;非正态分布者采用Kruskal Wallis H 秩和检验。计数资料以频数或百分率表示,组间比较采用χ2检验或Fisher 精确概率法检验,以P<0.05 为差异有统计学意义。
2 结果
2.1 三组临床表现的比较
三组均以发热、呼吸急促、黄疸反复为主要临床表现,神经系统多表现为抽搐、意识障碍(激惹、嗜睡)、前囟紧张、肌张力和原始反射异常,三组临床特征比较,差异无统计学意义(P>0.05)(表2)。
2.2 三组外周血常规、CSF常规结果比较
三组外周血白细胞计数、血小板比较,差异无统计学意义(P>0.05);69例(51.49%)患儿C反应蛋白(C-reactive protein,CRP)>8 mg/L。GBS组、其他细菌组的CRP 高于病原菌不明组,差异有统计学意义(P<0.05)。其他细菌组、GBS组的脑脊液白细胞计数高于病原菌不明组,GBS组的脑脊液多核细胞百分比高于其他细菌组、病原菌不明组,差异均有统计学意义(P<0.05)。三组CSF 的葡萄糖、氯化物、蛋白、乳酸脱氢酶水平比较,差异无统计学意义(P>0.05)(表3)。
表1 三组患儿一般资料的比较(±s)
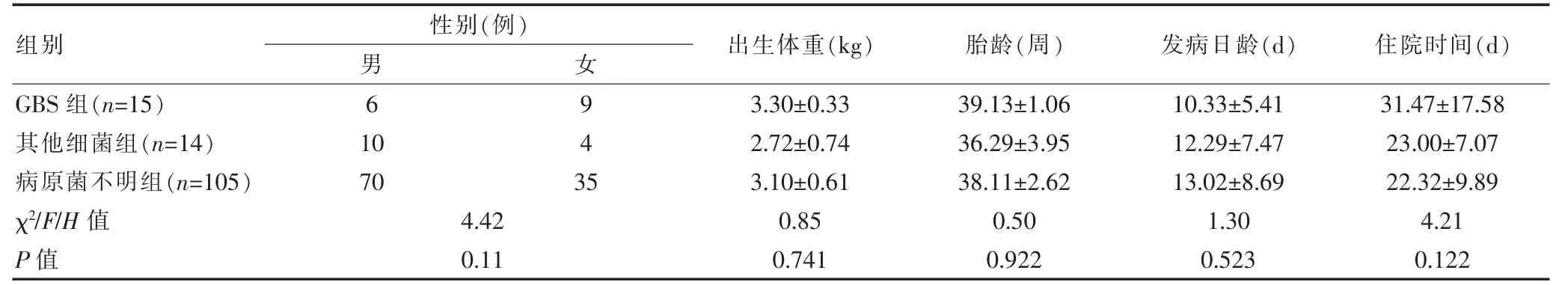
表1 三组患儿一般资料的比较(±s)
组别 出生体重(kg) 胎龄(周) 发病日龄(d) 住院时间(d)性别(例)男女GBS组(n=15)其他细菌组(n=14)病原菌不明组(n=105)χ2/F/H值P值6 10 70 943 5 4.42 0.11 3.30±0.33 2.72±0.74 3.10±0.61 0.85 0.741 39.13±1.06 36.29±3.95 38.11±2.62 0.50 0.922 10.33±5.41 12.29±7.47 13.02±8.69 1.30 0.523 31.47±17.58 23.00±7.07 22.32±9.89 4.21 0.122
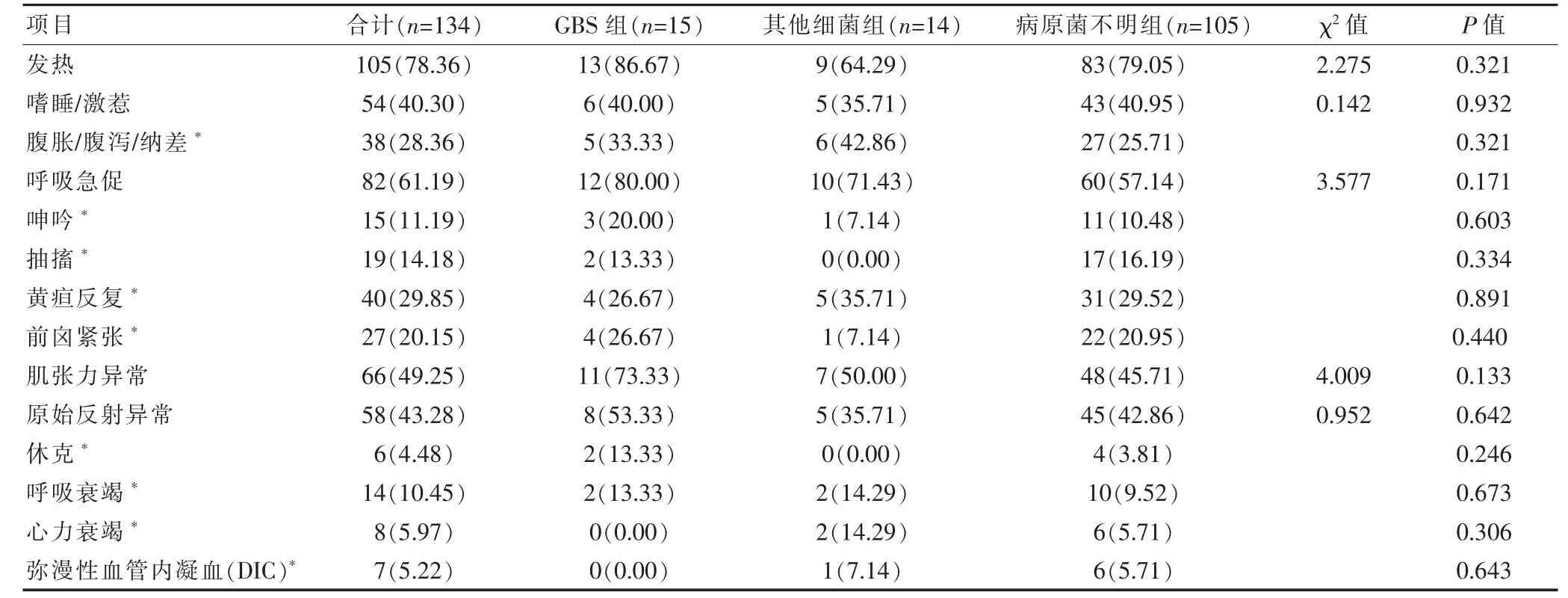
表2 三组NPM 临床特征比较[n(%)]
CSF蛋白数超过1.88 g/L 有30例,其中出现并发症13例。GBS组5例(1.90~3.78 g/L,1例并发硬膜下积液),其他细菌组4例(3.29~12.93 g/L,并发硬膜下积液1例,脑室膜炎、硬膜下积液并脑积水1例,脑积水1例),不明原因组21例(1.95~10.65 g/L,并发脑积水5例,脑积水并脑软化2例,硬膜下积液1例,硬膜下积液并脑软化1例)。
2.3 血培养、CSF培养及药敏情况
血培养阳性26例(阳性率19.40%),其中GBS 14例(53.84%),大肠埃希菌6例(23.08%),肺炎克雷伯菌3例,人葡萄球菌、表皮葡萄球菌、解没食子酸链球菌各1例。CSF培养阳性7例(5.22%),其中GBS 3例,大肠埃希菌2例,解没食子酸链球菌、粪场球菌各1例。血液和CSF培养均阳性(均为同一种细菌)共3例,分别为GBS、大肠埃希菌和解没食子酸链球菌各1例。药敏结果显示,GBS 对多西环素、克林霉素耐药性达100%,对红霉素、阿奇霉素耐药性达50%以上,对青霉素、氨苄青霉素、阿莫西林、头孢美唑、万古霉素敏感。大肠埃希菌对氨苄青霉素、阿莫西林、头孢一代、头孢二代耐药性高,主要对头孢他啶、头孢哌酮舒巴坦、头孢四代、哌拉西林/他唑巴坦、碳氢酶烯类敏感性高。
2.4 治疗及转归
因患儿发病时常以败血症为首发表现,入院时存在明显中毒症状,病程初期一般联用抗生素,再根据血培养或CSF 细菌培养报告、临床表现及实验室检查结果调整抗生素。入院一般选用的抗生素为青霉素或美洛西林舒巴坦联合头孢三代抗生素,再根据临床表现、辅助检查报告及治疗效果调整为哌拉西林他唑巴坦、美罗培南、利奈唑胺、万古霉素。有13例使用激素。治愈83例,好转44例,2例并发硬膜下积液转神经外科进一步治疗,5例因严重合并症/并发症放弃治疗,其中1例CSF培养为GBS,合并颅内出血、房间隔缺损;1例血、CSF培养均为大肠埃希菌,合并坏死性小肠结肠炎、DIC,出院当天死亡;1例并发脑软
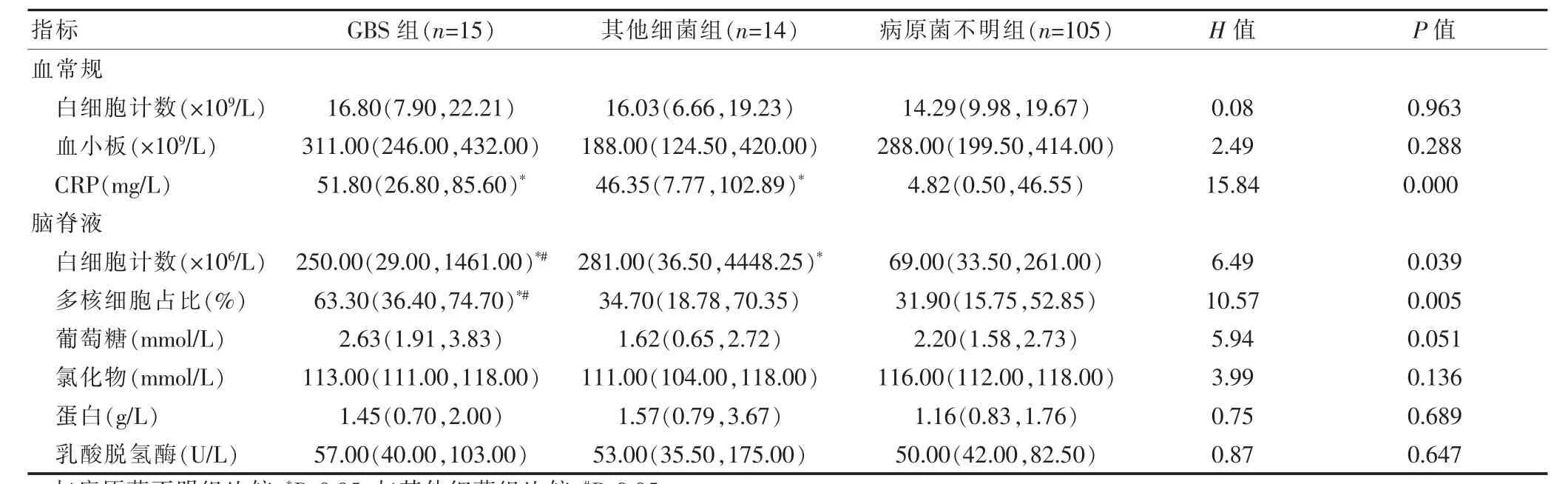
表3 三组NPM 实验室检查结果的比较[M(Q1,Q3)]
化、脑积水,2例并发硬膜下积液、脑积水、脑室膜炎,出院不久即死亡。并发症15例(11.2%),其中GBS组并发硬膜下积液1例;其他细菌组中,并发硬膜下积液1例(解没食子酸链球菌),脑室膜炎、硬膜下积液并脑积水1例(大肠埃希菌),脑积水1例(大肠埃希菌);阴性组中,并发脑积水6例,硬膜下积液2例,脑积水并脑软化2例,硬膜下积液并脑软化1例。
3 讨论
化脓性脑膜炎是由于细菌入侵、细菌产物释放以及宿主在体液和细胞免疫中的局部免疫反应而引起的脑膜感染。新生儿时期细菌性脑膜炎的发病率要高于其他年龄段[6]。本病病死率在不同国家及医院报道范围较大,据新生儿细菌性脑膜炎多中心研究协作组报道,纳入的838例细菌性脑膜炎新生儿中,共死亡13例,病死率为1.6%[7]。本研究纳入134例,共死亡4例,病死率为3.0%,低于印度报道的11.2%[8]。
新生儿脑膜炎的临床表现可能是隐匿的、微妙的和非特异性的,通常与败血症中所见相似,温度不稳定,呼吸窘迫,黄疸和呼吸暂停。中枢神经系统症状如嗜睡、惊厥、呕吐、烦躁不安、前囟饱满和颈项强直在晚期败血症中更常见[9]。本研究中,化脓性脑膜炎以发热、呼吸急促、黄疸反复为主要临床表现,发热是最常见的症状,占78.36%,与相关文献报道[7,10]类似。神经系统多表现为抽搐、意识障碍(激惹、嗜睡)、前囟紧张、肌张力和原始反射异常,这些症状、体征并非特异性,在不同病原体感染的细菌性脑膜炎中的表现无明显区别。
脑膜炎的诊断仍然具有挑战性,因为最初的症状通常很微妙,并且与败血症重叠[11]。因此,对化脓性脑膜炎的诊断和治疗进行实验室检测和病原体培养具有重要的指导意义。通过腰穿检查脑脊液是确认脑膜炎的唯一方法[9,12],CSF培养是诊断化脓性脑膜炎的金标准,对NPM 预后预测也有较好的价值[13]。本研究化脓性脑膜炎血培养阳性率为19.40%,低于国外报道的31%[14],但与刘梦迪等[10]的报道一致;CSF培养阳性率仅为5.22%,低于文献报道中的22.5%[15],考虑原因如下。①NPM 临床表现不典型,与败血症等感染相似,早期诊断困难,并且目前国内没有形成常规对所有怀疑新生儿败血症的患儿进行腰穿脑脊液检查,常在抗生素应用后出现神经系统异常表现后才进行脑脊液检测;②脑脊液到实验室的运输延迟和脑脊液中细菌密度低,尤其是在早发型新生儿脑膜炎中,导致CSF 细菌检出率较低。此外,CSF常规及生化也是化脓性脑膜炎的诊断依据。本研究显示,GBS感染或其他细菌感染(如大肠埃希菌感染),CSF 白细胞数显著增加,GBS 化脓性脑膜炎多核细胞百分比也会增高。有研究表明,预测不良结局的最佳临界值是CSF蛋白浓度为1.88 g/L(敏感性70.8%,特异性86.2%)[13]。本研究结果显示,脑脊液蛋白>1.88 g/L 有30例,13例出现脑积水、硬膜下积液、脑软化等并发症,其中4例死亡,预后不良的发生率高。因此,CSF蛋白>1.88 g/L,可预测新生儿脑膜炎的不良预后。本研究结果还显示,51.49%化脓性脑膜炎患儿外周血CRP 升高,且GBS组、其他细菌组的CRP 较病原菌不明组显著增高,GBS组的CRP 中位数为51.80 mg/L。众所周知,CRP 是一种非特异性炎症指标,在早期细菌感染中显著增加,在感染控制后迅速下降,提示在化脓性脑膜炎的诊断中应注意CRP 的检测。
目前的文献报道,NPM的病原菌分布存在地区性差异,不同国家地区及不同年代有所不同,在每家医院都不一致[6,13]。GBS 是新生儿败血症和脑膜炎的主要原因[16]。Whittaker 等[17]报道,早发型脑膜炎中发现的最常见细菌是GBS、大肠埃希菌、单核细胞增生性李斯特菌和革兰阴性肠细菌。我国华南部分地区细菌性脑膜炎培养阳性前4位细菌依次为GBS、大肠埃希菌、凝固酶阴性葡萄球菌和肺炎克雷伯菌[7]。本研究中,最常见的细菌是GBS、大肠埃希菌、肺炎克雷伯菌,与Zhao 等[18]的报道不同。许多发达国家,例如美国、加拿大和欧洲大部分地区已经采取了GBS 预防策略,该策略基于对孕妇进行GBS携带的普查,并在阳性时提供产前抗生素的预防[19],尽管产时抗生素可以预防早发性GBS的发生,但对晚发性疾病无效[20]。
考虑到可能导致细菌性脑膜炎的病原体数量众多,对于可能患有脑膜炎的新生儿,静脉注射抗生素的最初选择必须同时覆盖革兰阳性和革兰阴性菌。适当的抗生素治疗是管理的关键方面。在根据脑脊液分析结果进行微生物学诊断之前,应首先根据经验选择抗生素,并且应基于发病年龄、可能的病原体和抗生素敏感性。青霉素和头孢菌素可有效对抗GBS、大肠埃希菌、肺炎克雷伯菌和单核细胞增生李斯特菌,这是发达国家新生儿中所有常见的脑膜病原体(单核细胞增生李斯特菌除外)[2]。本研究培养结果为革兰阴性杆菌者的哌拉西林他唑巴坦和美罗培南使用率较高;培养结果为革兰阳性球菌者选用青霉素、万古霉素、利奈唑胺。对于培养阴性者,选择三代头孢、青霉素和哌拉西林他唑巴坦。美罗培南具有良好的CSF 渗透性,且对革兰阳性和革兰阴性细菌具有广泛的活性,对大肠杆菌、克雷伯菌属、肠杆菌属具有杀菌作用[21],可能在改善结局方面发挥作用,对于大肠埃希菌、肺炎克雷伯杆菌感染的病情严重患儿应优先选择美罗培南。
综上所述,NPM 临床表现缺乏特异性,发热为最常见症状;病原菌以GBS、大肠埃希菌为主;CRP 明显升高,脑脊液白细胞数及多核细胞百分比升高者应考虑GBS感染。本研究存在一定局限性,为单中心研究,个别病情较危重患儿未能及时行腰椎穿刺检查,未能纳入研究,影响了对NPM 病死率的评估;对于存在并发症病例也未能进一步随访观察其远期结局,希望在下一步的前瞻性多中心研究中开展。

