甘草素对小鼠早期胚胎体外发育影响的初步研究
朱纯宇, 尹 月, 李钟淑, 方南洙
(延边大学农学院,吉林 延吉 133002)
卵母细胞体外成熟培养是体外生产胚胎的一个重要环节,已广泛用于哺乳动物胚胎的体外培养,在人工辅助生殖技术及胚胎工程中起着不可替代的作用[1]。然而,体外生产胚胎存在很强的困难性和复杂性,其原因是卵母细胞在体外没有完全成熟。为提高体外胚胎生产的质量,目前主要的方法是在体外培养液中加入抗氧化剂来改善和优化体外培养体系,旨在将卵母细胞体外培养(IVM)和体外受精(IVF)技术科学、有效、系统地建立起来,目前IVM和IVF技术生产出的体外胚胎仍然存在胚胎率低、质量差的缺点[2]。
ROS是有氧代谢的副产物,当ROS过量生成时会产生氧化应激[3],ROS引起的氧化应激是胚胎体外培养过程中卵母细胞成熟抑制和胚胎凋亡的重要原因[4]。有研究表明,氧化应激与胚胎质量之间有着密不可分的关联性[5],对哺乳动物生殖细胞质量产生影响的主要因素就是ROS[6]。研究表明在线粒体中可以产生ROS,线粒体还参与氧化应激导致的胚胎凋亡过程,并调节胚胎氧化应激[7]。ROS生成量取决于线粒体的代谢平衡,当线粒体的功能发生异常和突变时会导致三羧酸循环或电子传递链的功能障碍,从而产生过量的ROS。有研究发现,抗氧化剂能够阻止过量ROS导致的氧化应激反应,或者能够直接清除过量的ROS[8],维持细胞内氧化还原体系的动态平衡,保护细胞和内环境免受破坏[9]。此外,抗氧化剂在蛋白质和脂质分子抗氧化过程中的发挥着不可忽视的作用[10]。在体外培养过程中,胚胎容易受到氧化应激,从而影响其生长发育[11-12],因此,保护胚胎免受氧化应激,对于提高体外胚胎生产质量至关重要[13]。研究发现,通过将某些适宜浓度的抗氧化剂添加到体外培养液中,能够使胚胎内ROS水平大幅度降低[14-15]。
甘草素是一种黄酮类化合物,常见于蔬菜、坚果、水果、草药中[16],具有多种生化和药理特性,包括抗高脂血症、抗炎、抗过敏[17-20]。研究表明,LQ可以降低哺乳动物生殖细胞的凋亡率[21-23],同时也有研究证实LQ对谷氨酸诱导的海马神经元细胞凋亡具有保护作用[24],对ROS诱导的细胞损伤也具有保护作用[25]。LQ被认为是一种有效的ROS清除剂,可以有效地防止ROS介导的细胞损伤。LQ的抗氧化活性来源于酚羟基,与氢发生反应,氢原子被转移并与活性氧结合以终止ROS介导的链式反应,从而阻止自由基的产生[26]。
虽然甘草素应用广泛,但在哺乳动物生殖系统中,特别是在雌性配子和早期胚胎发育过程中的具体作用机制尚不清楚。该试验通过将适宜浓度的甘草素添加到体外培养基中,探讨甘草素对小鼠早期胚胎体外发育的影响,旨在为甘草素进一步开发利用提研究思路。
1 材料与方法
1.1 试验动物
该试验使用的小鼠购自延边大学动物实验中心(SYXK2020-0009),品种为昆明系小白鼠。其中,雌性小白鼠7周龄,体重30 g以上;雄性小白鼠8周龄以上,活泼健康,单笼饲养,种用寿命为半年;雌雄小鼠均达到性成熟。
1.2 主要试剂
甘草素购自上海源叶生物科技有限公司;KSOM培养液、M2培养液均购自南京爱贝生物公司;透明质酸酶(Hy)、二甲基亚砜(DMSO)、磷酸盐缓冲溶液(PBS)均购自Sigma公司;ROS(DCFH-DA)荧光染色剂、GSH(CMF2HC)荧光染色剂和线粒体JC-1荧光染色剂均购自Thermo Fisher公司;孕马血清促性腺激素(PMSG)、人绒毛膜促性腺激素(hCG)均购自宁波第二激素厂。
1.3 试验设计
1.3.1 胚胎的收集
小鼠第1天下午17:00进行PMSG(10 IU)腹腔注射,每只小鼠0.1 mL PMSG。第3天下午17:00对同一批雌鼠于进行hCG(10 IU)腹腔注射,每只小鼠0.1 mL hCG。注射 hCG 后立即与成年公鼠进行1∶1合笼交配,在合笼22 h后用颈椎脱臼法处死雌鼠,无菌手术摘取输卵管膨大部,然后将其放入已经预平衡的M2培养液中。在体视显微镜下划破输卵管膨大部,收集卵丘卵母细胞复合物,将其移入含有0.1% Hy的KSOM小滴中处理2 min,同时轻轻吹打几次,以去除颗粒细胞,将拣出的合子在KSOM培养液中洗涤5次,然后收集合子。
1.3.2 胚胎的体外培养
将收集的合子放入已经预平衡的KSOM培养基中,对照组用KSOM清洗3次,5个试验组分别用含有0、10、20、30、40、50 μmol/L甘草素的KSOM清洗3次,然后置于预平衡的培养液中培养至囊胚,通过剂量反应研究,囊胚率最高的LQ浓度为该试验的最适浓度。
1.3.3 胚胎内ROS水平的检测
取不同处理组发育状态良好的胚胎,用移液枪吸取适量PVA洗液,制作3个微滴,依次洗涤;用捡卵针将洗涤好的胚胎转移至事先准备好的DCFH-DA染色液微滴中,5% CO2、37 ℃条件下孵育20 min;孵育后的囊胚经PVA洗液洗涤3次后,再用KSOM培养液洗涤3次,然后将洗过的的囊胚分别单独放在KSOM微滴中,最后移至荧光显微镜下观察并照相记录。
1.3.4 胚胎内GSH水平的检测
取不同处理组发育状态良好的胚胎,用移液枪吸取适量PVA洗液,制作3个微滴,依次洗涤;用捡卵针将洗涤后的胚胎转移至事先准备好的CMF2HC染色液微滴中,5% CO2、37 ℃条件下孵育20 min;孵育后的囊胚经PVA洗液洗涤3次后,再用KSOM培养液洗涤3次,然后将洗过的的囊胚分别单独放在KSOM微滴中,最后移至荧光显微镜下观察并照相记录。
1.3.5 胚胎线粒体膜电位的检测
取不同处理组发育状态良好的胚胎,放置于含有10 μg/mL JC-1的IVC培养液中,5% CO2、37 ℃条件下孵育20 min;染色后的囊胚期胚胎在PBS-PVA 中洗涤3~5次,放置在含有10 μL 的PBS的载玻片上;在荧光显微镜下分别利用红色荧光和绿色荧光滤镜观察并照相记录。
1.3.6 统计分析
数据使用 SPSS(17.0版)进行单因素方差分析,均为“平均值±标准误”的形式。差异有统计学意义:P<0.05 表示差异显著,P<0.01 表示差异极显著,P> 0.05 表示差异不显著,每组数据至少重复 3 次。ROS、GSH、JC1染色图片用Image J软件进行分析量化,其结果用相对平均荧光强度表示,然后对3次重复数据采用 SPSS 软件分析处理。
2 结果与分析
2.1 不同浓度LQ对小鼠早期胚胎体外发育的影响
该试验用浓度为0、10、20、30、40、50 μmol/L的甘草素(LQ)处理小鼠早期胚胎,体外培养至2-细胞、4-细胞和囊胚阶段,观察并记录各试验组不同时期胚胎的发育率(表1)。
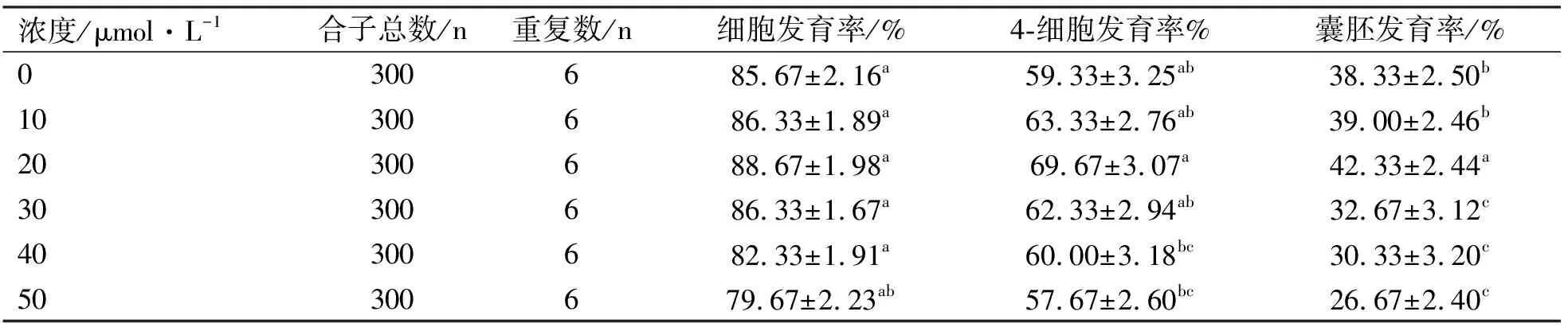
表1 不同浓度甘草素处理体外培养小鼠早期胚胎的发育率
6个不同浓度LQ处理组,比较2-细胞发育率时,0~40 μmol/L的LQ处理组无显著性差异(P>0.05),但50 μmol/L的LQ处理组2-细胞发育率显著降低(P<0.05);比较4-细胞发育率时,20 μmol/L的LQ处理组4-细胞发育率显著高于0、10和30 μmol/L的LQ处理组(P<0.05),且极显著高于40、50 μmol/L的LQ处理组(P<0.01),0、10和30 μmol/L的LQ处理组之间4-细胞发育率无显著性差异(P>0.05),但显著高于40、50 μmol/L的LQ处理组(P<0.05),40和50 μmol/L的LQ处理组之间4-细胞发育率无显著性差异(P>0.05);比较囊胚发育率时,20 μmol/L的LQ处理组囊胚发育率显著高于0和10 μmol/L的LQ处理组(P<0.05),且极显著高于30、40和50 μmol/L的LQ处理组(P<0.01),0和10 μmol/L的LQ处理组之间囊胚发育率无显著性差异(P>0.05),但显著高于30、40和50 μmol/L的LQ处理组(P<0.05),30、40和50 μmol/L的LQ处理组之间囊胚发育率无显著性差异(P>0.05)。为了更直观性、形象性地表示不同浓度的LQ处理对 IVC 昆明小白鼠早期胚胎体外发育的影响,将表1整理汇成折线图(图1)。
从图1可以清晰地看出,不同浓度LQ处理组的2-细胞发育率、 4-细胞发育率和囊胚发育率变化趋势均呈山峰形,且20 μmol/L LQ处理组的2-细胞发育率、 4-细胞发育率和囊胚发育率均处于峰值状态,该本试验最终采用 LQ的浓度为20 μmol/L,并用于后续试验。
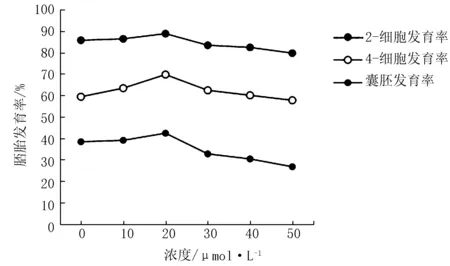
图1 不同浓度甘草素处理体外培养小鼠早期胚胎发育率的变化趋势图
2.2 LQ对早期胚胎ROS水平的影响
由于ROS的过量产生会导致氧化应激,从而使胚胎凋亡,所以ROS水平对体外培养胚胎至关重要。为检测LQ在早期胚胎中的抗氧化作用,检测对照组和甘草素处理组的ROS水平(图2)。对该结果进行量化分析,试验结果显示对照组ROS水平显著高于甘草素处理组(P<0.05)。表明LQ可以降低小鼠胚胎内部的ROS水平,减少氧化应激带来的损伤。
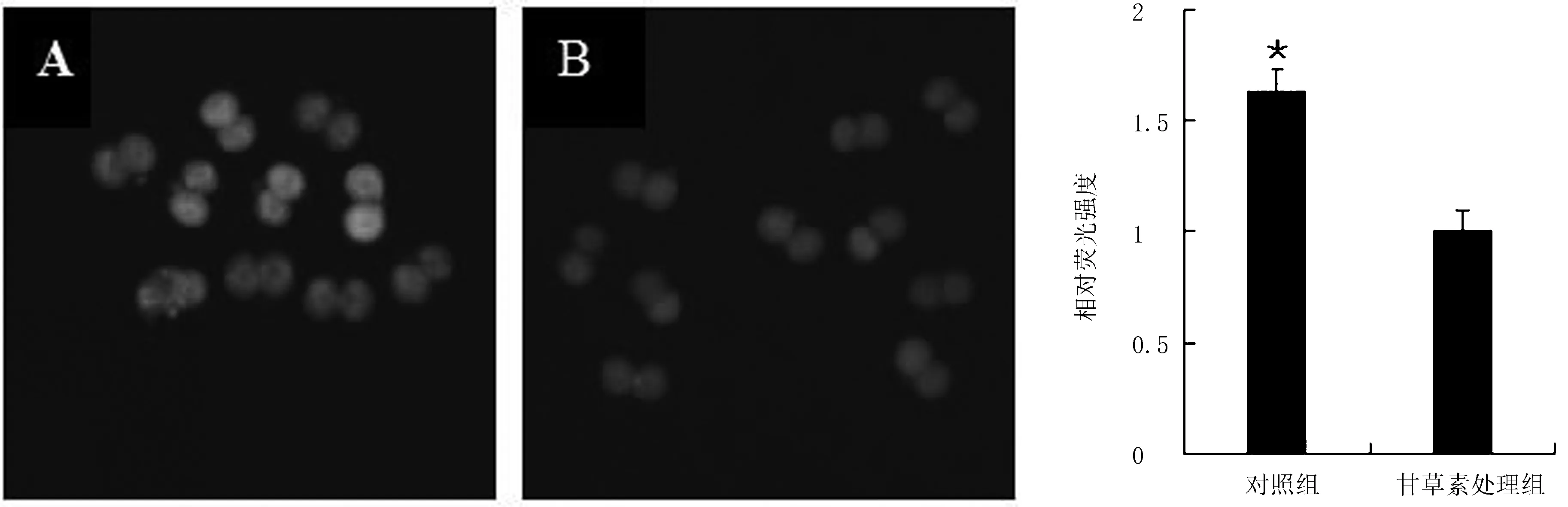
A.对照组;B.甘草素处理组
2.3 LQ对早期胚胎GSH水平的影响
在哺乳动物胚胎中,GSH作为清除因子可以降低氧化应激带来的损伤,同时也是影响胚胎质量的重要因素。为检测LQ对早期胚胎质量的影响,检测对照组和甘草素处理组中的GSH水平(图3)。对该结果进行量化分析,结果表明甘草素处理组GSH水平显著高于对照组(P<0.05)。表明LQ可以提高小鼠胚胎内部的GSH水平,促进小鼠胚胎的后续发育。
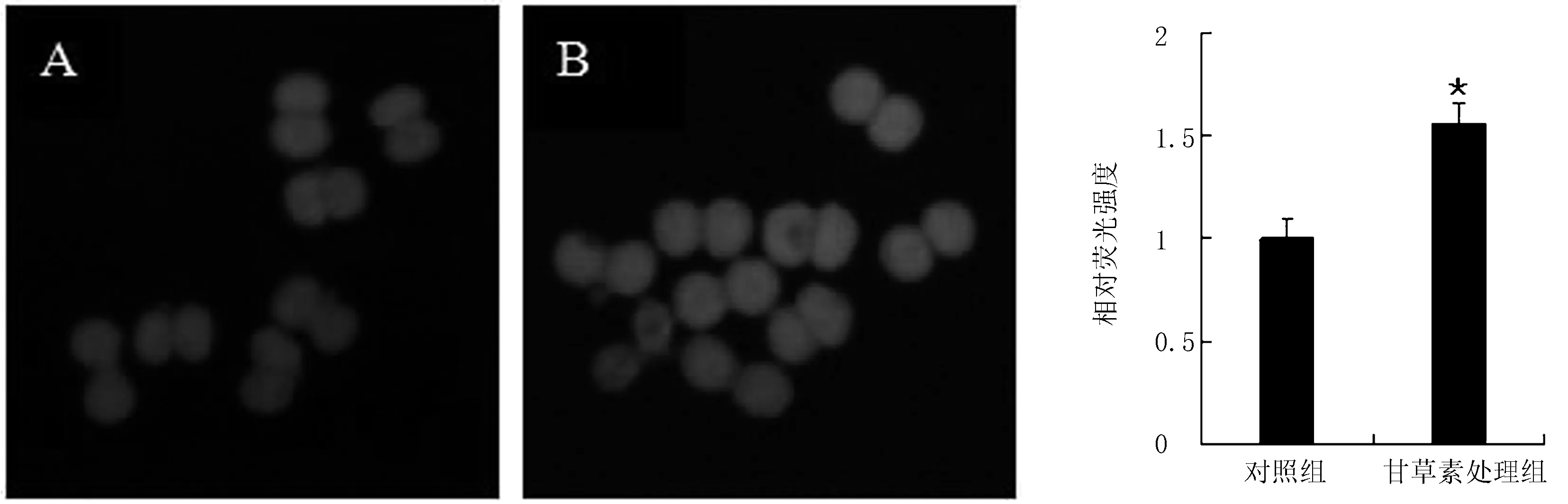
A.对照组;B.甘草素处理组
2.4 LQ对早期胚胎中线粒体膜电位的影响
采用JC1荧光染色法检测早期胚胎中的线粒体膜电位的变化,线粒体膜电位通过红色与绿色荧光的比值得到,红色荧光较强表明胚胎线粒体膜电位较强,绿色荧光较强表明线粒体膜电位较弱(图4)。对该结果进行量化分析,试验结果显示甘草素处理组的红绿荧光强度比率显著高于对照组(P<0.05)。表明LQ可以提高小鼠胚胎线粒体膜电位极性,保护小鼠胚胎免受氧化应激所致的凋亡。
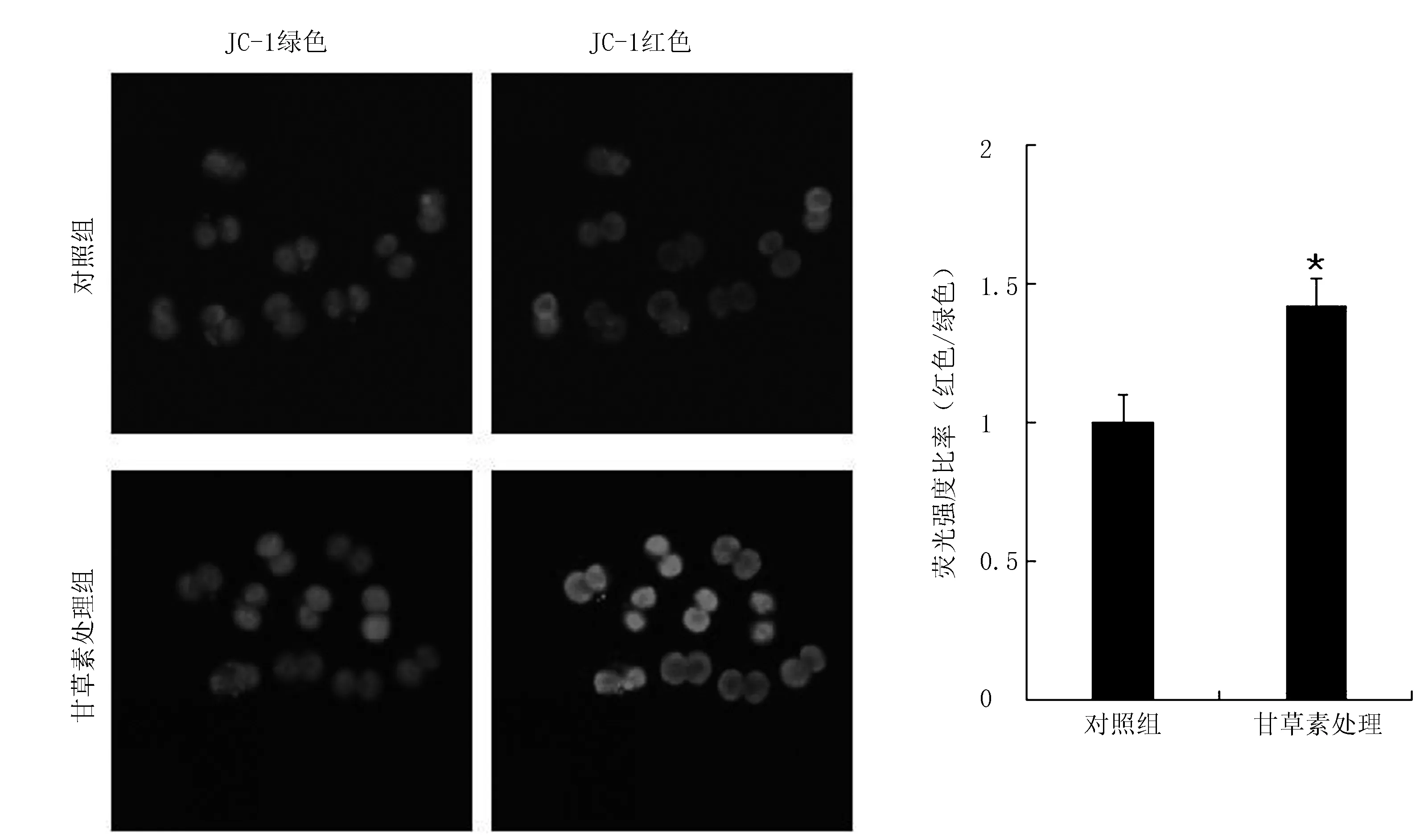
A.对照组;B.甘草素处理组
3 讨论与结论
LQ是天然的抗氧化剂,通过添加LQ可以缓解小鼠胚胎发育过程中产生的氧化应激。在该试验中,当LQ浓度为20 μmol/L 时,小鼠囊胚率最高,且在折线图中处于峰值状态,但是当LQ浓度为30 μmol/L 时,囊胚率反而呈现下降趋势,出现这一结果的原因可能是过高浓度的LQ本身会对胚胎产生不利影响;另一方面,也可能是出现ROS过量清除现象,很大程度上破坏ROS动态平衡机制,可能还会将许多不良影响传递给胚胎。通过后者可以得出,在胚胎正常生长发育过程中,ROS也起到一定作用,过量的清除ROS也会对胚胎产生不利影响,这与 Rajasekaran NS等[27]人的研究一致。
如果ROS过量增加,会使细胞内氧化还原失衡,同时ROS会对DNA以及脂质等重要分子结构产生破坏[28]。当细胞产生的ROS超过细胞氧化还原系统时,可能会引发细胞凋亡和损伤。为证实LQ通过清除过量的ROS提高胚胎的质量,该试验选用能够与ROS反应产生特定荧光信号的染料DCFHDA进行染色标记,结果发现,甘草素处理组的ROS水平显著低于对照组,因此认为LQ可以清除胚胎发育过程中产生过量的ROS,同时减轻胚胎内部的氧化损伤,这与Huang等[29]人的研究结果一致。
还原型谷胱甘肽(GSH)是哺乳动物细胞内的巯基化合物[30],具有普遍性和低分子量的特点,同时能够调节细胞内氧化还原平衡相关通路[31]。在体外培养胚胎过程中,哺乳动物胚胎对ROS水平的变化非常敏感,其中,GSH水平是影响胚胎质量的重要因素[32]。Ozawa M等[33]人的研究证实,在啮齿类动物和猪胚胎中GSH具有清除ROS的作用,并且胚胎内GSH水平与胚胎发育和细胞增殖等过程有着密不可分的关联性。该试验研究发现,甘草素处理组的GSH水平显著高于对照组,因此,LQ可以提高GSH水平,对减少胚胎自身产生氧化应激具有缓解作用。
线粒体是卵母细胞发育所需的主要细胞器,其完整性是卵母细胞胞质成熟的关键指标之一[34]。在胚胎早期发育的过程中,线粒体起着至关重要的作用,线粒体功能异常可以直接影响早期胚胎的发育,导致胚胎发育阻滞和胚胎凋亡。该试验中对照组红绿荧光比率明显低于甘草素处理组,此结果表明,在体外培养过程中加入LQ可显著增强线粒体膜电位,同时缓解氧化应激引起的线粒体膜电位降低,进而真正意义上促进早期胚胎的发育。
通过对上述试验结果进行分析探讨,可以发现将适宜浓度的LQ添加到小鼠早期胚胎体外培养基中,可以提高囊胚率,降低胚胎内ROS水平,提高GSH水平,改善早期胚胎线粒体功能,从而提高小鼠早期胚胎的发育能力。

