原发性肝癌伴门静脉癌栓患者预后的术前预测模型建立
陈涵波 王恒武 陈夫军
原发性肝癌伴门静脉癌栓发生率有上升趋势,且其肿瘤生物学特性强,易发生肝外侵袭,并发门静脉高压,导致消化道出血或肝衰竭,引起死亡[1]。肝切除联合门静脉取栓术后复发和并发症是威胁患者生命安全的重要因素,患者预后仍不甚乐观[2]。因而,优化手术方案,改善患者预后备受临床关注,既往多认为肿瘤分期和分化程度等肿瘤病理特征直接影响预后[3],但缺乏对患者预后因素综合分析,故开展本研究。
资料与方法
一、 基本资料
2015年1月至2018年1月新沂市中医院原发性肝癌伴门静脉癌栓患者86例。纳入标准:①经病理检测[4],且在超声下可见门静脉内充盈或半充盈低回声;②均接受原发性肝癌切除术联合肝断面取栓术。排除标准:①心肺功能严重不全者;②病历资料不全或拒绝参与者。
二、 研究方法
以患者死亡为随访终点,记录术后2年总生存率。所有肿瘤病理资料和实验室指标数据均以术前检查结果为准,以患者死亡为不良预后,采用logistic回归分析原发性肝癌伴门静脉癌栓患者不良预后影响因素,构建预测模型。
三、 统计学方法
以SPSS 20.0录入,计量资料行t检验,计数资料行χ2检验。以受试者工作特征曲线下面积评估预测模型的价值。P<0.05为差异有统计学意义。
结 果
一、 基本资料
86例患者中,死亡18例,存活68例(79.07%)。死亡组男11例,女7例,年龄32~64岁,平均(43.16±7.88)岁,Child-Pugh分级A级12例,B级6例。对照组男40例,女28例,年龄31~65岁,平均(44.96±8.03)岁,Child-Pugh分级A级45例,B级23例。两组患者Child-Pugh分级差异有统计学意义(P<0.05)。
二、 肿瘤病理资料
两组患者病理资料比较见表1。
三、 两组患者实验室指标比较
两组患者实验室指标比较见表2。
四、 多因素分析预后的影响因素
logistic分析结果显示Child-Pugh分级、肿瘤直径、肿瘤分期及Alb与预后相关(P<0.05)。见表3。
五、 预后模型
建立判断不良预后的术前预测模型,对独立因素赋值:X1=Child-Pugh分级,X2=肿瘤直径,X3=肿瘤分期,X4=Alb。患者预后Y=1.682X1+2.279X2+1.231X3-0.712X4。ROC分析显示肿瘤直径、Alb判断不良预后的AUC分别为0.714、0.752,最佳截断值分别为5.25 cm、27.50 g/L。对影响因素赋分,见表4,并根据赋分结果纳入预后模型,以患者预后模型Y得分为检验变量,以患者预后为状态变量,进一步行ROC分析,显示术前预测模型判断预后的AUC为0.810,最佳截断值为7.500分。

表1 两组患者肿瘤病理资料比较[例(%)]
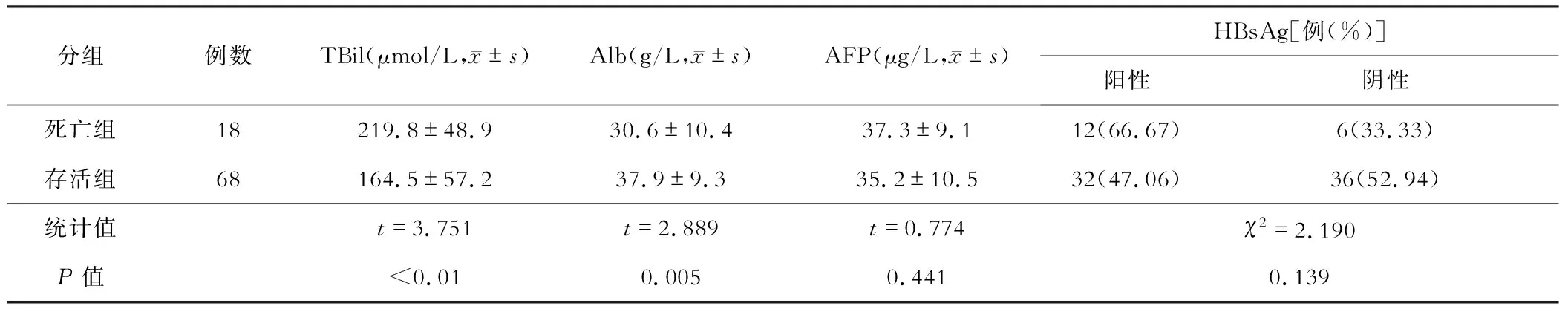
表2 两组实验室指标比较
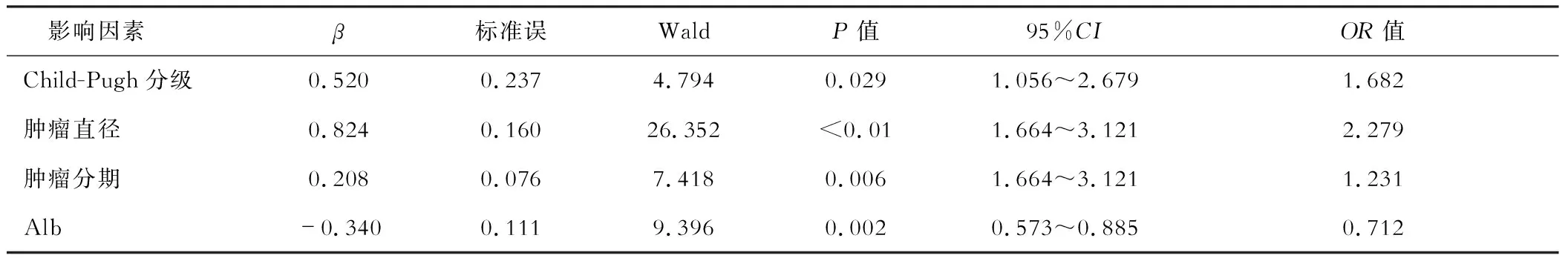
表3 患者预后的影响因素

表4 患者预后影响因素赋分
讨 论
门静脉癌栓与肝癌血管侵犯程度、生长速度相关,门静脉癌栓的形成还可能导致癌细胞随门脉系统发生微转移,Child-Pugh分级能全面反映肝脏储备功能,随着患者肝功能持续恶化,增加门静脉高压和上消化道出血风险,进而增加死亡概率[5,6]。Chan等[7]报道Child-Pugh分级与患者预后具有显著相关性。
Pokhrel等[8]报道,肿瘤直径超过5.75 cm的原发性肝癌患者,不良预后风险增加1.588倍。郭晓迪等[9]报道,原发性肝癌肿瘤直径与肿瘤血管生长速度相关。但肿瘤直径>5.25 cm时,应充分考虑肿瘤病理特点和肝功能水平,以优化手术方案,改善预后。肿瘤生长可导致机体能量消耗,进而增加营养不良风险,因而Alb可在一定程度上反映肿瘤病理[10]。Oladapo等[11]认为Alb可抑制Rb磷酸化,并降低p57水平,达到抑制肿瘤增殖效果。随着肿瘤进展,肿瘤浸润深度和直径逐渐增加。本研究建立术前判断患者预后的预测模型,结果显示其预测预后的AUC达0.810,提示预测模型对判断预后具有较高的准确性,这对于指导临床,优化手术时机具有重要意义。
综上,肝癌伴门静脉癌栓预后与肿瘤直径、肝功能及Alb水平相关,术前监测Alb与肿瘤病理特点可为优化手术方案提供参考,以改善预后。

