三种预防肝硬化食管胃静脉曲张再出血方法的对比研究
林雪燕 林志辉
食管胃静脉曲张出血(esophageal gastric varices bleeding,EGVB)是肝硬化严重并发症,死亡率高达15%~20%[1]。超过60%的患者在首次出血后1-2年内会再次发生静脉曲张出血,病死率高达33%[2]。因此,预防再出血的二级预防是改善预后的关键。现就我院收治的101例肝硬化EGVB患者临床资料进行回顾性分析,比较药物联合内镜治疗、TIPS治疗及外科断流术治疗这三种二级预防措施的疗效,从而为EGVB患者的二级预防选择合适的治疗方案。
资料与方法
一、研究对象
根据纳入与排除标准,选取2013年1月—2016年1月在福建省立医院因肝硬化急性EGVB收住院的患者。纳入标准:①符合肝硬化急性食管胃静脉曲张出血诊断的患者;②经药物保守治疗(如补液、制酸、降门脉压力等药物)出血停止5 d后在我院行NSBB联合内镜下硬化剂治疗(endoscopic injection sclerotherapy,EIS)或 TIPS 或外科断流术(贲门周围血管离断+脾切除术治疗)治疗;③术前均未行内镜治疗、TIPS及外科断流术治疗。排除标准:①排除患有恶性肿瘤性疾病、布加综合征、合并严重心肺疾病及肾功能衰竭的患者;②排除实验室、影像学及内镜资料不完整的患者。根据纳入及排除标准选取符合条件的病历共 101例,根据治疗方式分为内镜组(NSBB联合EIS)、介入组(TIPS治疗)及外科组(贲门周围血管离断+脾切除术治疗)。
二、 材料与器材
内镜组:Olympus电子胃镜,聚桂醇注射液(陕西天宇制药有限公司),α-氰基丙烯酸正丁酯(北京康派特医疗器械有限公司),23G注射针(日本Olympus公司),组织胶注射针(北京康派特医疗器械有限公司)。
介入组:RUS-100穿刺系统(美国Cook公司),球囊扩张导管(PTA-pro,美国Cook公司),Amplaz导丝(美国Cook公司),造影导丝及导管(泰尔茂,美国 Cook 公司),10.00 mm×80.00 mm覆膜 Fluency支架(美国巴尔德公司),裸支架(Zilver,美国Cook 公司)。
三、治疗方法
入院后均立即进行补液、制酸、降门脉压力等综合治疗,并密切监测患者生命体征,完善血常规、肝肾功能、电解质、血氨、上腹部增强CT、胃镜等检查,待出血停止5 d后进一步行下述治疗。
(一)内镜组 内镜下治疗均由熟练的操作者实施,曲张的食管静脉给予内镜下硬化剂治疗(endoscopic injection sclerotherapy,EIS),曲张的胃底静脉曲张给予内镜下组织胶注射。初次内镜下治疗成功后,给予NSBB,且每2~4周复查胃镜,对残留曲张静脉再次行内镜下治疗直至静脉曲张消失或基本消失。之后每6~12个月复查胃镜,如发现静脉曲张再次行内镜下治疗。
(二)介入组 TIPS术由熟练的操作者实施,超声引导下行颈内静脉穿刺后进入导丝,进入导管测定下腔静脉及肝静脉压力,RUS-100 穿刺系统弯曲成型后进入肝静脉,并选择合适的穿刺平面及角度穿刺进入门静脉,予球囊扩张定位后置入覆膜支架或双支架(覆膜支架 + 裸支架),术后给予抗凝药物应用,根据情况予降低血氨药物。术后第1月、第3个月及以后每6个月复查彩超,如发现分流道狭窄或闭塞则行球囊扩张支架成型术或再次置入覆膜金属支架。术后每6~12个月复查胃镜了解静脉曲张情况。
(三)外科组 术前禁食24 h,并行肠道准备,手术方式选择贲门周围血管离断+脾切除术。术后每6~12个月复查胃镜了解静脉曲张情况。
四、随访及疗效观察
根据电话随访直至研究终点,随访时间为3年。研究终点包括患者死亡、并发恶性肿瘤、转换治疗方式及到达随访时间。无法与患者及家属取得联系者视为失访。主要随访内容为早期再出血、远期再出血、曲张静脉消失情况、死亡情况和并发症等。治疗后30 d内出血定义为早期再出血;治疗后30 d以上至随访终点的出血定义为远期再出血;曲张静脉完全消失是指治疗内镜下完全看不到静脉曲张,消化道黏膜呈现其基本色泽;曲张静脉基本消失是后内镜下仍可见残留的细小血管。本研究中曲张静脉消失例数=曲张静脉完全消失例数+曲张静脉基本消失例数。
五、统计学方法
采用SPSS 23.0软件进行数据管理及统计学分析。计数资料采用χ2检验;计量资料,若满足正态分布和方差齐性采用t检验,以平均值±标准差(x±SD)表示,否则采用Mann-Whitney秩和检验;绘制Kaplan-Meier生存曲线图,比较三组远期生存情况;检验标准P<0.05则差异有统计学意义。
结 果
一、 研究对象基本情况
本研究一共纳入病例101例,其中内镜组38 例,介入组32 例,外科组31例。内镜组平均年龄(52.1±11.9)岁;男28例,女10例;其中乙型肝炎肝硬化28例,丙型肝炎肝硬化1例,酒精性肝硬化4例,其他原因肝硬化5例;其中Child-pugh分级A级17例,B级19例,C级2例。介入组平均年龄(51.4±10.2)岁;男22例,女10例;其中乙型肝炎病毒肝硬化26例,丙型肝炎病毒肝硬化1例,酒精性肝硬化2例,其他原因肝硬化3例;其中Child-pugh分级A级14例,B级16例,C级2例。外科组平均年龄(51.24±9.6)岁;男20例,女11例;其中乙型肝炎肝硬化24例,丙型肝炎肝硬化0例,酒精性肝硬化3例,其他原因肝硬化4例;其中Child-pugh分级A级17例,B级14例,C级0例。三组在年龄、性别、肝硬化病因及初始肝功能情况上的差异无统计学意义(P>0.05),具有可比性。
二、三组患者治疗效果比较
(一)三组患者治疗后转归情况:内镜组3例因EGVB死亡,1例因肝癌死亡,1例在远期出血后转介入治疗;介入组2例均因肝衰竭死亡,1例因远期出血转内镜治疗;外科组2例因EGVB死亡,1例因肝癌死亡,1例因早期出血转内镜治疗,1例因远期出血转内镜治疗。
(二)再出血情况:分别统计各组术后30 d内、30 d以上再出血情况,比较三组的早期再出血率、远期再出血率,结果如下表1、表2所示。
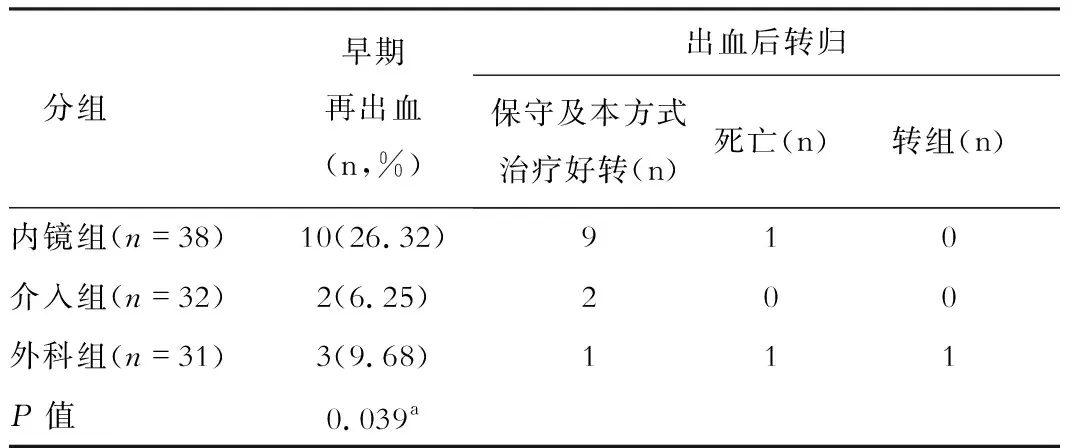
表1 三组早期再出血率比较
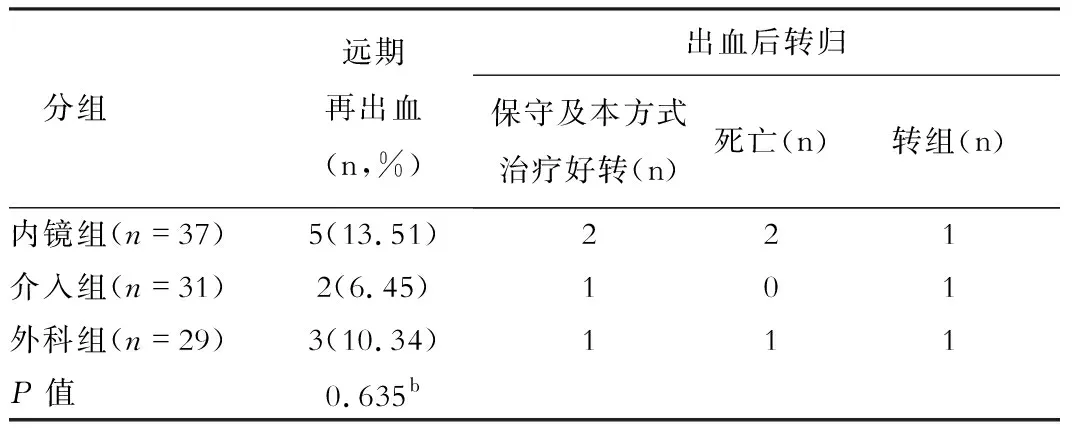
表2 三组远期再出血率比较
(三)曲张静脉消失率情况:内镜组27例曲张静脉消失,曲张静脉消失率达71.05%;介入组24例曲张静脉消失,曲张静脉消失率达75%;外科组19例曲张静脉消失,曲张静脉消失率达61.29%,三组比较P值0.460,无统计学差异。
三、并发症
内镜组:术后1例(2.63%)出现肝性脑病,4例(10.53%)出现新发腹水,17例(44.74%)术后第7~14 d复查胃镜提示溃疡形成。介入组:术后5例(15.63%)出现肝性脑病,0例出现新发腹水。外科组:1例(3.23%)出现肝性脑病,1例(3.23%)出现新发腹水。
四、远期生存情况
至随访终止,内镜组共4例(10.53%)死亡;介入组共2例(6.25%)死亡;外科组共3例(9.68%)死亡;绘制Kaplan-Meier生存曲线图,结果提示P=0.384>0.05,无统计学差异,表明三组在远期生存上无明显差异。见图1。
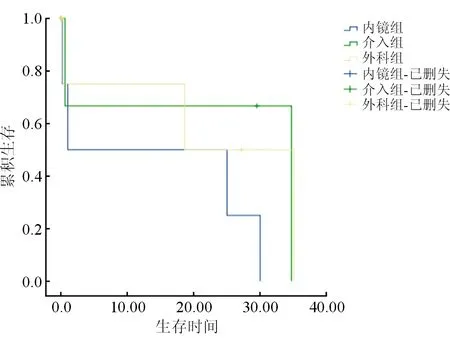
图1 三组病人生存曲线的比较
讨 论
本研究致力于为EGVB患者选择最佳的二级预防方案,对于我院接受药物联合内镜、TIPS或贲门周围血管离断+脾切除术进行EGVB二级预防的101例患者进行回顾性分析,以进一步评价上述二级预防措施的利弊。本研究中三种治疗方式的EGVE再发生率均较未进行二级预防患者明显下降,故提示药物联合内镜治疗、TIPS与外科手术治疗均能有效预防食管胃静脉曲张再出血。
本研究中内镜组早期再出血率(26.32%)明显高于介入组(6.25%)及外科组(9.68%),以上差异具有统计学意义,提示在EGVB二级预防方面,介入及外科治疗近期疗效优于药物联合内镜治疗。EIS的原理是在内镜直视下将硬化剂注入曲张静脉内及静脉周围组织内,使曲张静脉内血栓形成,血管硬化闭塞,血管周围组织发生纤维化,达到止血和防止再出血的作用[3-4]。其原理决定了其可导致食管黏膜坏死、糜烂及溃疡形成,在溃疡愈合期和结痂期(7-10d)容易发生早期再出血[5-6]。本研究中内镜治疗组中有17例(44.74%)患者术后第7-14d复查胃镜提示溃疡形成,考虑内镜组早期再出血原因主要是EIS术后溃疡形成伴出血所致。对于内镜组出现的早期再出血大多经内科保守治疗或再次内镜下治疗即可止血,较少出现因EGVB死亡患者,本研究中38例内镜组患者中仅1例因早期再出血而死亡。随着内镜水平提高,对于内镜治疗早期再出血的弊端也在不断改进,近年内镜下精准食管胃静脉曲张断流术被提出,其核心是选择静脉曲张来源支精准断,来源支血管即为血管刚从胃食管腔外进入腔内的部分,来源支是否充分闭塞是胃食管曲张静脉治疗后是否复发和再出血的重要原因[7]。Romero-Castro等研究均提示精准治疗方式的硬化剂使用量及再出血率明显低于传统内镜下治疗方式[8-9]。
本研究中内镜组(13.51%)、介入组(6.45%)及外科组(10.34%)在远期再出血率上不存在显著性差异;内镜组、介入组及外科组在曲张静脉消失率方面亦无显著性差异;以上提示在远期疗效方面三种治疗方式无明显差异。EGVB二级预防后的远期再出血多由曲张静脉复发所致,还包括门脉高压性胃病[10]。TIPS 能直接将门静脉血流分流至腔静脉系,达到降低门静脉压力的目的,较好的预防EGVB发生。但TIPS仍无法改变肝硬化的病理生理及内脏高血流动力学状态,故仍存在曲张静脉复发及出血的风险。贲门周围血管离断+脾切除术能阻断占门静脉血流60%~70%的脾动脉,从而有效地降低门静脉的压力,起到改善静脉曲张的效果;但离断术始终无法彻底截断食管周围与黏膜下的静脉网,且未能解决门静脉系统的高压淤血状态;内镜治疗同样不能完全闭塞食管壁间的交通支,且无法改变门静脉压力、血流,无法从源头根除EGV,因此外科及内镜治疗仍存在复发、再出血问题[11],本研究中内镜组术后新发腹水4例(10.53%)亦提示内镜治疗后可能存在门脉压力不降反升而导致腹水产生。但内镜治疗可通过反复多次治疗使曲张食管胃静脉基本消失,故静脉曲张进展缓慢,与外科手术治疗相当。以上原因导致三种治疗方式在远期再出血率、曲张静脉消失率方面无显著差异。但在更长时间的随访中三者的差异是否会越来越显著仍需进一步研究。
本研究中三种治疗方式在远期生存上亦无显著差异,考虑与内镜、介入、外科治疗均不能从根本上阻止肝硬化疾病的进展有关。D’Amico等[12]分析了118篇肝硬化患者预后的文献,发现肝功能Child—Pugh分级是肝硬化患者预后的独立影响因子,提示患者生存期与治疗方式关系不大,而肝硬化病程及治疗时机的选择可能是影响预后的关键因素。
早期多部指南及多项高质量临床研究证明,NSBB联合内镜治疗是二级预防食管静脉曲张出血首选的标准方案。但随着介入技术及质量提高,肝性脑病发生率较前下降,TIPS地位逐渐上升,多项研究数据亦显示,早期TIPS在控制出血及预防出血、患者无肝移植生存率及肝性脑病发生率等方面均有优势[13]。本研究中介入组肝性脑病发生率15.63%,均经内科保守治疗好转,并未发生严重后果。根据本研究所示,介入治疗在近期及远期治疗效果上有优势。近年来,关于肝硬化门静脉高压症的外科手术应用及地位的讨论争议不断[14],在多数国外指南中外科手术地位逐渐下降[15],但这些国外指南存在外科专家参与少、我国专家参与少等情况,存在不能充分表达外科医生意见、不能全面结合我国国情等情况。本研究中在近期及远期治疗效果上外科组并未劣于内镜组。内镜、介入、外科手术治疗在EGVB二级预防疗效中各有优点,但在改善患者远期生存上并无差异,故在临床实践中应根据患者及所在医疗机构具体情况为患者选择合理的治疗方案。并且应进一步寻找新的降门静脉压力及改善肝硬化病理生理的措施。

