纤维素在深度共熔溶剂中的溶解性能*
杨靖雪,郎金燕,王 娜,王欣辉,杨鸿燕,吴逊谦,王鸣宇,王 铱,薛雨欣,张 恒,2**
(1.青岛科技大学 海洋科学与生物工程学院,山东 青岛 266042;2.浙江大学 生物质化工教育部重点实验室,浙江 杭州 310027)
近年来,随着化石燃料的枯竭和人们对气候变化的关注,基于可再生的生物质资源的高效利用已成为研究重点所在。纤维素作为地球上储量最丰富的生物质资源,已广泛用于纺织、化工、医药、能源等行业[1]。研究表明,纤维素是一种具有巨大潜力的可再生燃料和化工原料,可以转化为高质量的液体生物燃料和高附加值的化学品[2]。纤维素的转化利用是建立在纤维素的均相溶解前提下,但是纤维素的高结晶度和超分子结构致使其溶解非常困难,常规溶解纤维素的溶剂包括硫酸、磷酸、氯化锂/N、N-二甲基乙酰胺、氢氧化钠/尿素和四丁基氟化铵三水合物/二甲基亚砜等[3],会造成严重污染,因此,纤维素的溶解需要寻找更“绿色”的溶剂。
Abbott[4]等人首次提出深度共熔溶剂这一概念。任何一种深度共熔溶剂都是氢键受体(Hydrogen bond acceptor,HBA)与氢键供体(Hydrogen bond donor,HBD)按照一定的物质的量比通过氢键作用结合在一起而形成的熔点低于任一反应组分的盐溶液。深度共熔溶剂(Deep Eutectic Solvents,DESs)通常是由2种或者3种便宜安全的氢键受体与氢键供体按照一定物质的量比合成的液态混合物[5]。目前一般用季铵盐类作为氢键受体,而氢键供体可以和季铵盐的阴离子之间形成坚固的氢键,最常用的季铵盐是氯化胆碱。DESs易制备、纯度高、可生物降解等独特优点使其逐渐成为离子液体和有机溶剂的替代品,在无机物和有机物的分离和合成中得到了广泛的应用[6-7]。DESs中氢键受体和氢键供体的独特结构已被证明有利于纤维素的溶解[8]。而且,氯化胆碱基DESs具有溶解软木、淀粉和微晶纤维素的能力[9-11]。
在以往研究基础中[12],发现在所选取的4种氢键供体原料(草酸、柠檬酸、丙三醇和尿素)中,草酸和柠檬酸与氯化胆碱合成的DESs对纤维素的溶解效果优于丙三醇和尿素与氯化胆碱合成的DESs,因此,猜测酸性氢键供体原料与氯化胆碱合成的DESs对纤维素的溶解效果要优于不呈酸性的氢键供体原料。所以,在仍以草酸和尿素为原料的基础上,作者选择了2种呈酸性的氢键供体原料——丙二酸和对甲苯磺酸。以氯化胆碱为氢键受体合成了草酸/氯化胆碱(Oxalic acid/Choline chloride,O-DES)、尿素/氯化胆碱(Urea/Choline chloride,U-DES)、对甲苯磺酸/氯化胆碱(Toluene-4-sulfonic acid/Choline chloride,T-DES)和丙二酸/氯化胆碱(Malonic acid/Choline chloride,M-DES)4种DESs,对这4种DESs物理性质进行了测定并考察了微晶纤维素(Microcrystalline cellulose,MCC)在其中的溶解情况,筛选出溶解纤维素的最佳溶剂。
1 实验部分
1.1 试剂与仪器
氯化胆碱、草酸、丙二酸、对甲苯磺酸、尿素:分析纯,国药集团化学试剂有限公司;微晶纤维素:药用级,成都市科龙化工试剂厂;去离子水:自制。
Aida离心机:TD5G,湖南凯达科学仪器有限公司;X-射线衍射测试仪:DX-2700,布鲁克光谱仪器有限公司;冷冻干燥机:FD-1A-50,上海比朗仪器制造有限公司;电导率仪:DDS-307A,上海仪电科学仪器股份有限公司;熔点测试仪:RD-1,天津国铭医药设备有限公司。
1.2 4种基于氯化胆碱的DESs的制备
进行DESs合成实验之前,将原料在55 ℃的真空干燥箱内干燥24 h进行除水。按照n(HBA)∶n(HBD)=1∶2用电子天平准确称量原料并加入四口烧瓶中,然后将四口烧瓶置于事先调好温度的油浴锅内,通入氮气保护反应,n≈300 r/min,持续反应一段时间。当得到均一透亮的溶液时再反应20 min,使形成的溶液再进一步稳定,停止反应。将DESs溶液倒入烧杯中置于真空干燥箱内干燥24 h,然后放入干燥器内备用。合成的4种DESs结构式见图1。

图1 4种基于氯化胆碱的DES结构式
1.3 纤维素的溶解及再生
准确称量一定质量制备好的4种DESs加入四口烧瓶中,将四口烧瓶置于80 ℃的油浴锅内,当DESs变成黏度较低的液体时,再将温度升至120 ℃,然后加入0.5 g微晶纤维素进行反应。反应一定时间后停止,倒出反应液,将四口烧瓶中残留的反应液用蒸馏水洗涤干净,过滤分离反应液。将分离得到的固体在70 ℃下干燥至质量恒定,用分析天平称量其质量并记录数据。
称量10 g O-DES加入四口烧瓶中,在60 ℃油浴锅中加热,当O-DES变成黏度较低的液体时,将温度升至80 ℃,然后加入少量的微晶纤维素(纤维素尽量不要沾在瓶壁上),反应3 h。当反应完成后,将反应液放在离心管中5 000 r/min下离心15 min,将收集得到的上层纤维素清液至烧杯中,取出纤维素热溶液迅速用玻璃棒涂抹在水平放置的玻璃板上,用另一块玻璃板压在上面,尽量将气泡赶净。用大量的蒸馏水进行冲洗浸泡,抽去模板,自然风干1 h后放入50 ℃的真空干燥箱中干燥24 h,即可得到再生纤维素。将再生纤维素装袋放入干燥器中备用。同理使用T-DES、M-DES、U-DES 3种溶剂也可得到再生纤维素。
纤维素在DESs中溶解率计算公式见式(1)。
(1)
式中:W为微晶纤维素的溶解率,%;m0为微晶纤维素的初始用量,g;m为反应完成后微晶纤维素剩余质量,g。
1.4 DESs物理性质测定
(1)含水量的测定
用电子天平准确称量一定质量制备好的DESs先置于105 ℃的鼓风干燥箱中烘干若干小时,再转移至70 ℃的真空干燥箱中继续烘干直至质量恒定。用电子天平称量DESs烘干后质量并记录数据。
DESs中水分含量的计算公式见式(2)。
(2)
式中:X为DESs的含水量,%;m0为DESs初始质量,g;m为DESs烘干至质量恒定后质量,g。
(2)黏度的测定
将适量体积的DESs滴加到流变仪台面上,以15 ℃/min的速率升温至105 ℃并保温0.5 h,将DESs中残留的极少量水分除去,再以同样的速率将温度降低至20 ℃。然后以5 ℃/min速率将温度升高至所需温度。用流变仪测定黏度并记录数据。
(3)电导率的测定
量取适量体积的DESs于锥形瓶中,将锥形瓶置于提前设置好温度的水浴槽内恒温20 min,使DESs受热均匀,然后用电导率仪测定DESs的电导率并记录数据。
(4)熔点的测定
将少量的DESs置于玻璃皿上,将样品熔点管的开口端插入DESs中,然后将熔点管竖立起来,在实验台面上轻轻磕几下,使试样落入管底。重复取样几次,试样高度为2~3 mm时,将熔点管从一根长约40~50 cm高的玻璃管中自由落到表面皿上,重复若干次,使试样紧聚在管底,填充必须均匀、结实。然后将装好样品的熔点管插入油浴管中,测定DESs的熔点。
由于DESs熔点未知,在测定熔点时,先快速升温得到DESs一个不精确熔点,第2次在快接近前一次测的熔点时选择0.5 ℃/min缓慢升温,记录初熔和终熔的温度,重复3次求平均值。
1.5 DESs的表征
将原生微晶纤维素和再生微晶纤维素研成粉末后进行XRD射线衍射测试,分析再生纤维素经溶解后的结构及其结晶度的变化。
纤维素的结晶度指数计算公式见式(3)。
(3)
式中:CrI为纤维素的结晶度指数,%;I002为002面峰的强度,即结晶区的衍射强度,s-1;Iam为2θ=18°时峰的强度,即无定形区的衍射强度,s-1。
2 结果与讨论
2.1 DESs的物理性质
DESs的物理性质见表1。

表1 DESs的物理性质
由表1可知,O-DES、M-DES与T-DES的含水量较高,U-DES的含水量较低。这是因为草酸、丙二酸和对甲苯磺酸自身都带有结晶水,因此,一般干燥时,并不能将结晶水除去。但是有研究表明,少量水的存在会降低DESs的黏度,从而提高DESs对纤维素的溶解度。另外,水分子既可作为氢键供体也可作为氢键受体,因此可能会与DESs发生强烈的相互作用,参与某些离子的配位作用,干扰某些离子的配位范围[14],促进其形成氢键。而且也可能会参与DESs与纤维素之间氢键的形成,促进纤维素自身氢键的断裂,提高纤维素在DESs中的溶解度。
对比任一种DESs的HBA熔点、HBD熔点和DESs的熔点都不难发现,由n(HBA)∶n(HBD)=1∶2合成的DESs的熔点远远低于任一组分的熔点。像离子液体一样,液态DESs的形成取决于各组分的熔点,也取决于阳离子和阴离子之间的相互作用[5]。氯化胆碱以及4种HBD的键能以及在形成DESs过程中产生的熵变都对最终DESs的熔点起着至关重要的作用[15]。4种DESs的熔点都显著低于任一组分的熔点,这是由于HBD分子和氯化胆碱的卤素离子之间的相互作用[16]。电荷越小且阴离子的尺寸越大,破坏化学键所需要的能量就越小[17]。因此,可以认为HBD是一种与阴离子物质相互作用以增加其有效尺寸的特殊试剂,从而降低了与阳离子的相互作用,导致熔点降低。
2.2 DESs种类对纤维素溶解率的影响
不同种类DESs对纤维素的溶解能力是不同的。通过实验研究了4种DESs对微晶纤维素的溶解情况。
在四口烧瓶中加入10 g O-DES,再加入0.5 g微晶纤维素,在120 ℃下反应2 h,计算纤维素溶解率;
在四口烧瓶中分别加入10 g M-DES或者T-DES,再加入0.5 g微晶纤维素,在120 ℃下反应5 h,记算纤维素溶解率;
在四口烧瓶中加入10 g U-DES,再加入0.5 g微晶纤维素,在120 ℃下反应8 h,计算纤维素溶解率。实验结果见表2。

表2 微晶纤维素在4种DESs中的溶解率
由表2可知,在4种DESs中,O-DES对纤维素的溶解率最高,达到了10.54%,其次是T-DES,溶解率为6.49%,再者是M-DES,溶解率与T-DES相差不大,为5.97%,对纤维素溶解能力最差的是U-DES,对纤维素的溶解率仅为1.54%,而且在4种DESs中反应时间最长。这是因为溶解纤维素的关键是破坏纤维素分子内和分子间的氢键,当DESs与纤维素形成的氢键数目越多,氢键的强度越大,纤维素的溶解度就越大[18]。DESs自身形成氢键之后剩余形成氢键的能力越大,对纤维素的溶解能力也就越大。对于O-DES来说,其剩余形成氢键的数目是最多的[18],因此,对纤维素的溶解效果最好。除此之外,合成O-DES、M-DES与T-DES原料中的草酸、丙二酸和对甲苯磺酸自身是带有结晶水的,致使其合成的DESs黏度比U-DES的黏度小,因此,在反应过程中,传质传热速率比U-DES快。综上所述,O-DES对纤维素的溶解效果是最好的,U-DES对纤维素的溶解效果是最差的。
2.3 DESs黏度对纤维素溶解率的影响
黏度是任何流体的一个重要性质,因为其影响离子流体的质量输运现象和导电性,从而影响其在特定应用中的适用性。因此,考察DESs黏度对纤维素溶解度的影响是非常必要的。
以O-DES为溶剂,在30~70 ℃测定温度对其黏度的影响。并加入1 g微晶纤维素,反应2 h,测出其对纤维素的溶解率。
分别以M-DES和T-DES为溶剂,在30~70 ℃测定温度对其黏度的影响。然后加入1 g微晶纤维素,反应5 h,测出其对纤维素的溶解率。
以U-DES为溶剂,在30~70 ℃测定温度对其黏度的影响。然后加入1 g微晶纤维素,反应8 h,测出其对纤维素的溶解率。实验结果见图2。
由图2可知,DESs的黏度随着温度的升高逐渐降低,纤维素的溶解度随着温度的升高、黏度的降低而升高。表明这些溶剂的黏度对温度的敏感性很高。纤维素整体的溶解度很低,这可能是因为加入的初始纤维素质量太大,选择的实验温度太低,不利于纤维素溶解。对于O-DES、T-DES和M-DES,黏度在80 ℃之后几乎不再变化。U-DES在30~70 ℃时黏度下降很快,在70~90 ℃时黏度下降速度明显变慢。在相同的温度下,O-DES表现出了最低的黏度和对纤维素最高的溶解度。出现以上现象的原因是低黏度有助于溶剂DESs与纤维素中氢键之间的可接触性[19-20]。DESs的黏度不仅受合成DESs组分的化学性质、黏度和含水量的影响,更重要的是取决于两组分之间的氢键、范德华力和静电作用[21]。随着温度的升高,分子迁移速率加快,两组分之间的范德华力和静电作用力降低,DESs的表面张力也随之降低,从而造成DESs的黏度显著降低,因此促进了纤维素在DESs中的溶解度增大。O-DES、T-DES和M-DES在温度升高至80 ℃,黏度几乎不随温度的升高而降低,这是因为,当温度高于80 ℃,范德华力和静电作用力对黏度的影响非常小,随着温度的变化,范德华力和静电作用力的降低已经不足以改变DESs的黏度,此时,DESs的黏度达到了一个极小值,即使再升高温度,变化也会非常小,可以忽略。

图2 黏度与温度的关系及其对纤维素溶解度的影响
2.4 DESs电导率对纤维素溶解率的影响
以O-DES为溶剂,在30~60 ℃测定温度对其电导率的影响。并加入0.5 g微晶纤维素,反应2 h,测出其对纤维素的溶解率。
分别以M-DES和T-DES为溶剂,在30~60 ℃测定温度对其电导率的影响。然后加入0.5 g 微晶纤维素,反应4 h,测出其对纤维素的溶解率。
以U-DES为溶剂,在30~60 ℃测定温度对其电导率的影响。然后加入0.5 g微晶纤维素,反应6 h,测出其对纤维素的溶解率。实验结果见图3。

图3 电导率与温度的关系及其对纤维素溶解度的影响
由图3可知,电导率对温度变化很敏感,随温度的升高而增大。随着温度的升高,电导率的增大,纤维素的溶解度一直在增大。决定溶剂电导率的不是电荷载体的数量,而是离子的迁移率。而限制离子迁移率的是适当尺寸空穴的可用性以及体系的黏度[5]。当溶剂具有较大空隙,而溶剂中的离子半径较小,离子可以在溶剂体系中自由移动,增加离子的迁移率,进而增加DESs体系的电导率,同样的,纤维在DESs中的溶解度也会增加。电导率跟黏度的倒数呈线性关系,即黏度越小,DESs的电导率越大。随着温度的升高,溶剂体系中离子的运动速度加快,碰撞几率变大,分子之间的范德华力和静电作用力减弱,导致体系的黏度降低,而黏度的降低又会加快离子的运动速度,增加离子的迁移率,增大溶剂体系的电导率。从图3可以看出在相同温度下,O-DES具有最大的电导率,而U-DES具有最小的电导率,因此,微晶纤维素在O-DES中的溶解度最高,在U-DES中的溶解度最低。
2.5 原生纤维素与再生纤维素的XRD分析
将原生纤维素和经再生得到的纤维素利用XRD射线衍射仪进行晶型分析,实验结果见图4。
由图4可知,原生纤维素显示出纤维素Ⅰ的特征衍射曲线,在15.32°、22.51°和34.73°出现了很强的结晶峰。原生纤维素的结晶度很高,表明晶体结构占主导。通过纤维素结晶度指数的计算公式可以得到原生纤维素的结晶度指数为64.28%,而再生纤维素的结晶度指数为56.31%,而且,再生纤维素的XRD谱图中出现了比原生纤维素较宽较弱的衍射峰,这都表明O-DES不仅溶解了纤维素的无定形区,还溶解了部分结晶区,破坏了纤维素的氢键结构。对比分析原生纤维素与再生纤维素的衍射曲线走向基本一致,趋势基本相同,这说明O-DES在溶解纤维素的过程中没有产生其他的副产物。因为O-DES在溶解纤维素的过程中,只是破坏了纤维素的无定形区,以及将分子内和分子间的氢键变成游离的羟基,而纤维素的晶体结构并没有发生变化,仍然是完整的。因此,可以选择O-DES作为溶解纤维素的溶剂。
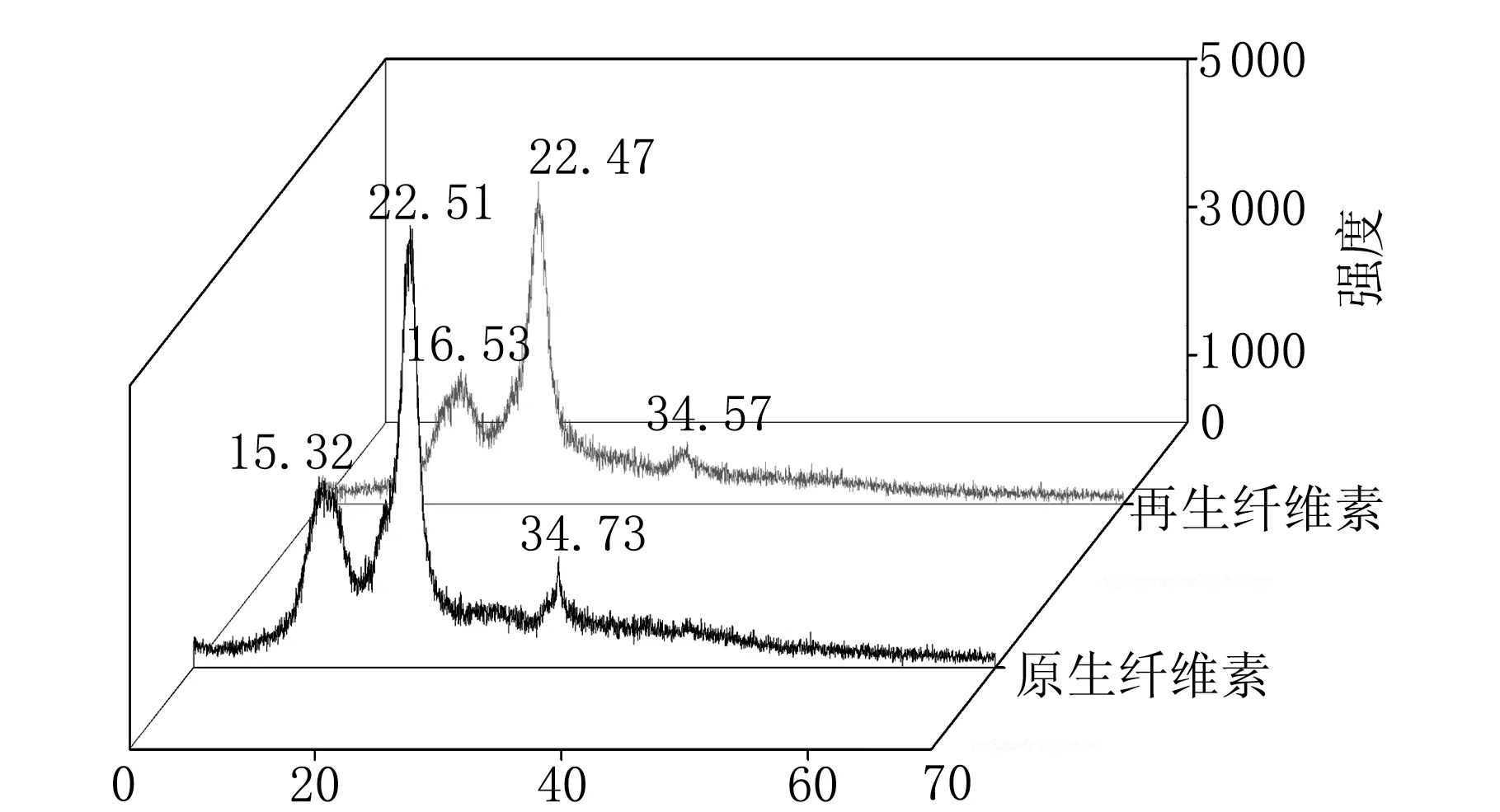
2θ/(°)图4 再生纤维素和原生纤维素的XRD图
3 结 论
作者合成了4种DESs并测定了其主要性质。以合成的DESs为溶剂溶解纤维素并考察了DESs种类、黏度及电导率等特性对纤维素溶解度的影响。在4种DESs中,O-DES含水量最高,其次是T-DES和M-DES;O-DES对纤维素的溶解度是最高的;DESs黏度与纤维素溶解度成反比,黏度越小,溶解度越大;DESs电导率与纤维素溶解度成正比,电导率越大,纤维素溶解度越大。通过XRD测试方法探究了DES对纤维素的溶解机制,为纤维素的溶剂体系的研究提供了参考数据。

