棉铃虫双重氧化酶HaDuox的序列特征和表达及病原诱导分析
宗召莉,郭 巍,赵 丹
(1.北京农学院 植物科学技术学院,北京 102206;2.中国农业科学院 研究生院,北京 100081;3.河北农业大学 植物保护学院,河北 保定 071001)
昆虫肠道是最易接触到微生物的部位,昆虫肠道菌群与昆虫的生长发育息息相关。肠道微生物参与宿主各项生理活动,包括提供营养物质,促进宿主生长发育,降解有害物质,保护宿主抵抗不利因子等[1]。然而,昆虫在取食过程中也会摄入包括病原微生物在内的复杂多样的外来微生物,这可能会影响昆虫正常的生命活动。维持肠道微生物菌群稳定、抵抗外来病原菌对昆虫生理生态的影响是至关重要的。为了保障宿主的正常存活,昆虫肠道进化出多种防御机制抵御外来微生物的入侵,其中双重氧化酶(dual oxidase,Duox)介导的免疫机制是调节昆虫肠道微生物稳态的重要防御系统[2-3]。
双重氧化酶是烟酰胺腺嘌呤二核苷酸磷酸氧化酶家族成员之一,在猪和人类的甲状腺组织中首次得到鉴定[4-5]。Duox蛋白主要由过氧化物酶结构域、钙离子结合域、铁还原结构域、黄素腺嘌呤二核苷酸结合域和烟酰胺腺嘌呤二核苷酸结合域组成[6-7]。Duox与生物体的多种生理功能相关,参与人体甲状腺激素的合成与释放[8];果蝇(Drosophilamelanogaster)Duox基因参与翅的合成和发育,在维持果蝇翅表面结构稳定中发挥重要作用[6]。在冈比亚按蚊(Anophelesgambiae)中肠Duox与过氧化物酶结合形成一层由共价键连接的二酪氨酸网络结构,能降低免疫效应因子对肠道的渗透[9]。斑马鱼(Daniorerio)肠道Duox可以清除伤口炎症,帮助组织恢复完整性和稳态[10]。
Duox具有调控肠道菌群的作用。斑马鱼中Duox基因在其肠道上皮细胞中高度表达,敲除基因后肠道失去对沙门氏菌感染的控制作用[11]。Duox基因敲除型果蝇在感染条件下肠道中细菌无限增殖,表现出较高的易感性[12]。Ha等[13]研究表明,外来病原菌进入果蝇肠道会分泌尿嘧啶,细胞膜上分布有G-蛋白偶联受体,能识别尿嘧啶,并通过Ca2+把信号传送到细胞内激活Duox表达,释放适量的ROS杀灭细菌。只有外来病原菌才能够分泌尿嘧啶,而经过长期协同进化的宿主肠道共生菌丧失分泌尿嘧啶能力[14],此种机制能保证宿主肠道很好的识别肠道共生菌和病原菌。Duox的基础表达和活性对于昆虫肠道防御机制至关重要。
棉铃虫属于鳞翅目,夜蛾科,是一种世界性分布的多食性害虫,也是中国棉田的主要害虫,对多种农作物造成巨大损失[15]。苏云金杆菌作为应用最广泛的生物农药,在防治农业、林业和病原媒介昆虫等方面发挥重要作用,此外,转苏云金杆菌作物也是目前种植最广泛的转基因作物[16],系统研究昆虫肠道免疫机制可为促进苏云金杆菌等生物农药的防治效果提供策略。笔者对棉铃虫HaDuox编码区基因进行克隆与表达,并分析其序列特征和该基因在不同发育阶段及不同组织中的表达,并对棉铃虫在苏云金杆菌诱导下HaDuox基因的免疫响应进行研究,分析HaDuox基因在棉铃虫抵御病原入侵中的作用,为进一步揭示昆虫肠道免疫机制奠定基础,为寻找一种新的生防靶标提供理论依据。
1 材料与方法
1.1 材料和试剂
1.1.1 供试材料 供试棉铃虫为北京农学院植物保护农药实验室人工饲养种群,幼虫以人工饲料饲养,成虫饲喂10%白糖水。饲养条件为温度27 ℃±1 ℃,湿度70%,光周期14 L∶10 D。苏云金杆菌菌株SY80为北京农学院植物保护农药实验室保存菌株,含有cry2Ah7和cry1Ia37基因。棉铃虫初孵第2天幼虫饲喂4.8×1011CFU/mL的苏云金杆菌SY80菌液72 h死亡率能达到70%,具有较高的杀虫活性。pET-30a载体菌株为北京农学院植物保护农药实验室保存。大肠杆菌EscherichiacoliDH5α,BL21感受态细胞购于北京华佰泰生物有限公司。
1.1.2 主要试剂 RNA提取试剂盒、PLB零背景快速克隆试剂盒、凝胶回收试剂盒购自TIAGEN公司;反转录试剂盒购自Thermo公司;SYBR Premix Ex TaqTM、限制性核酸内切酶购自Takara公司;TransTaq®DNA Polymerase High Fidelity购自TransGen公司;T4 DNA连接酶购自Progema公司。所用引物均由北京六合华大基因科技有限公司合成。
1.2 方 法
1.2.1 RNA的提取与cDNA的合成 棉铃虫幼虫不同组织(头部、表皮、前肠、中肠、后肠、马氏管、脂肪体)和不同发育时期(卵、1龄到5龄幼虫、蛹)总RNA参照RNAprep Pure Tissue Kit说明书提取,琼脂糖凝胶电泳和Nanodrop微量分光光度计检测RNA的质量和浓度。利用Thermo Scientific ReverAid First Strand cDNA Synthesis Kit,反转录获得cDNA。
1.2.2 棉铃虫HaDuox编码区基因的克隆 从NCBI(https://www.ncbi.nlm.nih.gov/)下载获得棉铃虫HaDuox基因序列,利用DNAMAN设计RT-PCR引物,由于该基因序列过长,设计2对引物分别扩增基因前后两段(1到2 248 bp、2 249到4 497 bp),引物名称为Duox1F & Duox1R和Duox2F & Duox2R,序列见表1,并通过overlap PCR技术拼接序列。利用设计的引物,以棉铃虫5龄幼虫表皮cDNA为模板扩增目的基因,PCR反应体系(50 μL)为5×PCR buffer 10 μL,dNTP Mix(10 μmol/mL)1 μL,上游引物2 μL、下游引物2 μL,模板cDNA 2 μL,High Fidelity DNA Polymerase 1 μL,ddH2O补足体系。PCR反应程序为94 ℃,3 min;94 ℃,30 s;55 ℃,15 s;72 ℃,3.5 min;30个循环;72 ℃,10 min。扩增产物经琼脂糖凝胶电泳检测正确后纯化回收,连接到PLB零背景克隆载体并转入大肠杆菌DH5α感受态细胞。筛选阳性克隆经菌落PCR鉴定正确后送北京六合华大基因科技有限公司测序。
1.2.3 棉铃虫HaDuox基因序列分析 利用DNAMAN软件分析HaDuox基因开放阅读框及氨基酸序列,蛋白分子量(MW)及等电点(pI)。TMHMM 2.0(http://www.cbs.dtu.dk/services/TMHMM-2.0/)软件进行跨膜域预测,SignalP 4.1 Server(http://www.cbs.dtu.dk/services/SignalP/)软件进行信号肽预测,SMART (http://smart.embl-heidelberg.de/)进行功能域分析,MEGA5.0软件对棉铃虫及多种昆虫双重氧化酶基因进行系统发育分析,并构建系统发育树。
1.2.4 HaDuox蛋白膜外部分编码基因的原核表达 棉铃虫HaDuox蛋白为多次跨膜蛋白,选择HaDuox蛋白膜外1 117到1 770 bp编码基因进行克隆及原核表达。根据原核表达载体pET-30a的多克隆位点,分别在上游引物和下游引物中引入酶切位点NdeⅠ和NotⅠ,引物名称为YH-1F和YH-1R,序列见表1。以构建的重组质粒PLB-HaDuox为模板进行PCR扩增,PCR反应体系同1.2.2。PCR反应程序为94 ℃,3 min;94 ℃,30 s;55 ℃,15 s;72 ℃,30 s;30个循环;72 ℃,10 min。产物连接到pET-30a载体,转化大肠杆菌BL21感受态细胞。筛选构建成功阳性菌株,并送北京六合华大基因科技有限公司测序。测序正确的重组菌株,用终浓度为0.8 mmol/L的异丙基-β-D-硫代半乳糖苷(Isopropyl-β-D-thiogalactoside,IPTG)在37 ℃,220 r/min条件下分别诱导1、2、4和6 h,以未加IPTG的菌体作为对照。SDS-PAGE检测重组蛋白的诱导表达情况,以小鼠抗6×His单克隆抗体(Mouse anti-6×His tag monoclonal antibody)(1∶5 000)为一抗,山羊抗小鼠IgG(Goat Anti-Mouse IgG)(1∶20 000)为二抗,进行Western blot分析。
1.2.5 棉铃虫HaDuox的表达模式分析 利用荧光定量PCR分析棉铃虫不同发育时期和不同组织中HaDuox基因的转录水平。选择棉铃虫β-actin基因作为内参基因(GenBank登录号:NW_018395562.1),设计内参基因引物Actin-F、Actin-R和目的基因引物qPCR-F、qPCR-R,引物序列见表1。PCR反应体系(20 μL)为SYBR Premix Ex TaqTM 10 μL,上游引物0.4 μL、下游引物0.4 μL,目的基因cDNA 2 μL,加ddH2O补足体系至20 μL。反应程序为95 ℃,30 s;95 ℃,15 s;65 ℃,30 s;39个循环;65 ℃,10 min;每个反应进行3次重复。利用2△△Ct=2-[(Ct目的基因-Ct内参基因)]处理组-[(Ct目的基因-Ct内参基因)]对照组公式计算相对表达量。用SPSS软件进行统计学分析,置信度95%时比较显著性。
1.2.6HaDuox基因的病原诱导表达分析 LB固体平板划线培养苏云金杆菌SY80甘油菌,取单菌落接种于LB液体培养基,37 ℃过夜振荡培养。第2天取新鲜菌液按1∶100的比例接种于400 mL 1/2 LB液体培养基中,继续培养直到大部分的晶体产生后收集孢晶混合物,-80 ℃冰箱保存备用。选取长势一致的棉铃虫3龄2 d幼虫,停止喂食12 h使之处于饥饿状态。涂布100 μL苏云金杆菌SY80菌液(1.2×109CFU/mL)于饲料表面,风干后进行喂食。将供试昆虫接种在涂布菌液的饲料上,以表面涂布等体积ddH2O的饲料为对照。每组接种30头棉铃虫幼虫,每个处理设置3组重复。饲喂1、3、6、12、18、24、36和48 h解剖收集棉铃虫肠道,分别提取RNA,反转录获得cDNA,进行荧光定量PCR分析,反应体系和反应程序同1.2.5。

表1 引物信息
2 结果与分析
2.1 棉铃虫HaDuox基因的克隆及序列分析
以棉铃虫5龄幼虫表皮cDNA为模板,分别以Duox1F & Duox1R和Duox2F & Duox2R为引物进行PCR扩增,得到HaDuox基因的前后两段,产物大小分别为2 248 bp和2 249 bp。DNA纯化试剂盒回收2个片段作为模板,以Duox1F和Duox2R为引物进行重叠PCR,得到大小为4 497 bp的编码区基因,命名为HaDuox(GenBank登录号:MT150138)。HaDuox共编码1 498个氨基酸,预测蛋白分子量为171.91 kD,等电点为8.90,为碱性蛋白;带负电荷残基总数(Asp+Glu)160个,带正电荷残基总数(Arg+Lys)183个;稳定性系数计算为41.71;亲水性平均值为-0.221,表明该蛋白为亲水性蛋白。SMART分析结构域表明HaDuox与家蚕、橘小实蝇、意大利蜜蜂等昆虫的Duox结构域类似,含有过氧化物酶结构域,钙离子结合域,铁还原结构域,黄素腺嘌呤二核苷酸结合域和烟酰胺腺嘌呤二核苷酸结合域。TMHMM 2.0分析显示有7个跨膜区,SignalP 4.1 Server预测显示在第29个和第30个氨基酸位点之间存在一个信号肽切割位点,见图1。
2.2 棉铃虫HaDuox系统发育分析
根据HaDuox编码的氨基酸序列,利用NCBI中的Blast功能搜索其他昆虫的氨基酸序列进行比对,发现棉铃虫H.armigeraHaDuox与鳞翅目夜蛾科的斜纹夜蛾SpodopteralituraSlDuox编码的(GenBank登录号:XP_022813998)氨基酸相似性最高,达98.84%;其次是鳞翅目夜蛾科粉纹夜蛾Trichoplusiani的TnDuox(GenBank登录号:XP_026735041.1),序列相似性为97.91%;再之后是亚洲玉米螟OstriniafurnacaliOfDuox(GenBank登录号:XP_028176585.1),序列相似性为95.05%;与烟草天蛾ManducasextaMsDuox(GenBank登录号:XP_030030662.1),家蚕BombyxmoriBmDuox(GenBank登录号:XP_021207538.1),夏威夷红蛱蝶VanessatameameaVtDuox(GenBank登录号:XP_026499659.1)和金凤蝶PapiliomachaonPmDuox(GenBank 登录号:XP_014367406.1)的序列相似性分别为94.81%、94.43%、94.74%、93.81%。
从NCBI数据库中搜索来自鳞翅目、鞘翅目、双翅目的14种昆虫的Duox基因的氨基酸序列,与棉铃虫HaDuox的氨基酸序列进行同源性比对,利用MEGA 5.0软件构建系统发育树(图2)。棉铃虫H.armigera与鳞翅目昆虫斜纹夜蛾S.litura、粉纹夜蛾T.ni、海波斯莫科马属蛾Hyposmocomakahamanoa、亚洲玉米螟O.furnacalis、水稻二化螟Chilosuppressalis、烟草天蛾M.sexta、家蚕B.mori、金凤蝶P.machaon聚为一支,亲缘关系较近,其中棉铃虫与斜纹夜蛾的亲缘关系最近,与鞘翅目和双翅目昆虫亲缘关系较远。
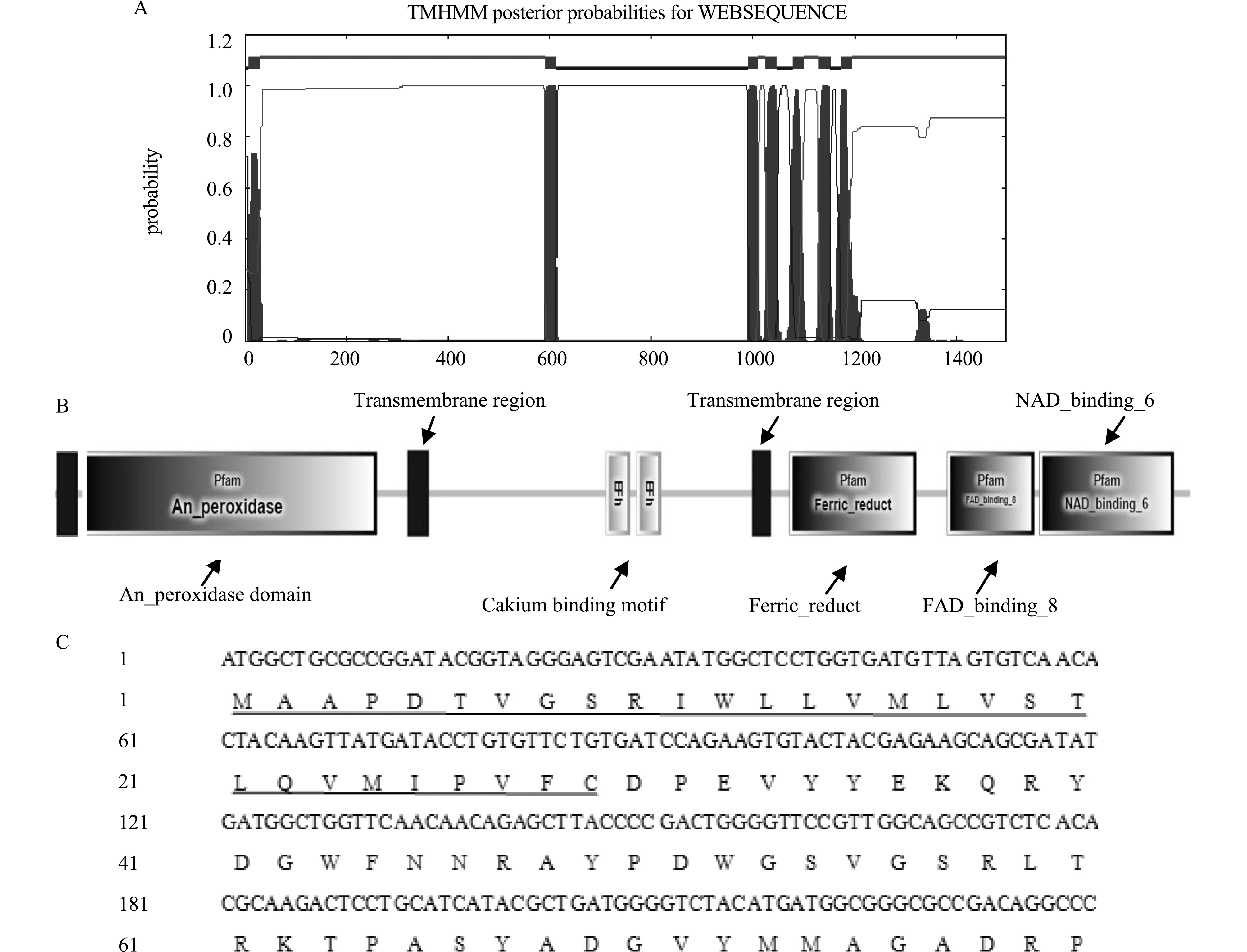
注:A代表HaDuox蛋白含有7个跨膜域;B为HaDuox蛋白结构域分析;C中下划线表示信号肽
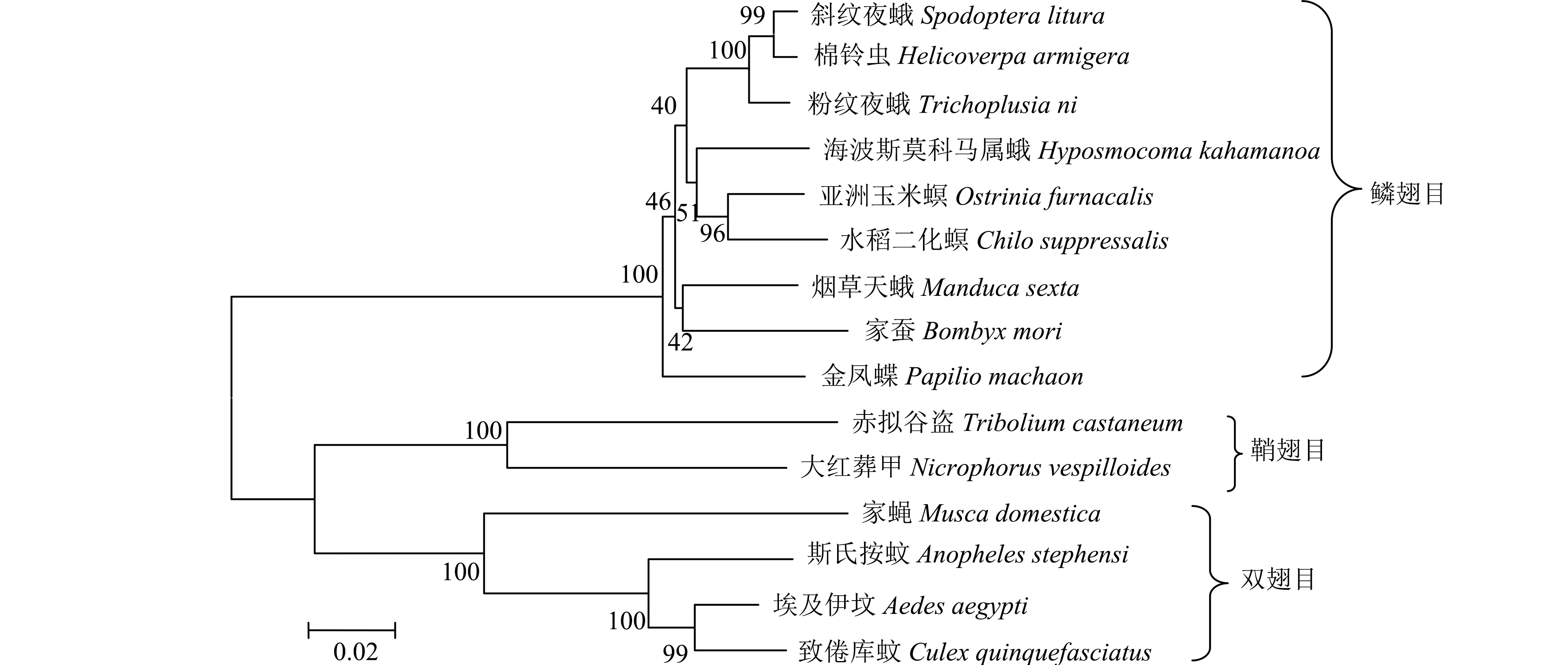
图2 基于氨基酸序列构建的昆虫Duox系统进化树
2.3 棉铃虫HaDuox蛋白膜外部分编码基因的原核表达
HaDuox膜外1 117到1 770 bp编码基因与pET-30a载体连接,构建重组原核表达载体,经双酶切验证重组载体构建成功(图3),重组表达载体转入大肠杆菌BL21感受态细胞,验证正确的重组菌经0.8 mmol/L的IPTG诱导,在37 ℃,220 r/min进行目的蛋白的表达。
取诱导0、1、2、4和6 h的菌液进行检测。SDS-PAGE和Western blot分析结果显示,诱导1、2、4和6 h均有约25.26 kD大小的蛋白表达,结果见图4。
2.4 棉铃虫HaDuox的表达模式分析
实时荧光定量PCR分析HaDuox在棉铃虫5龄幼虫不同组织和棉铃虫不同发育时期的相对表达量。HaDuox在棉铃虫各组织中均有转录,其中马氏管中的表达量最高,表皮中的表达量仅次于马氏管,头部的表达量最低(图5-A)。HaDuox在棉铃虫不同发育时期均有转录,其中卵期表达量较高,幼虫期表达量较低(图5-B)。
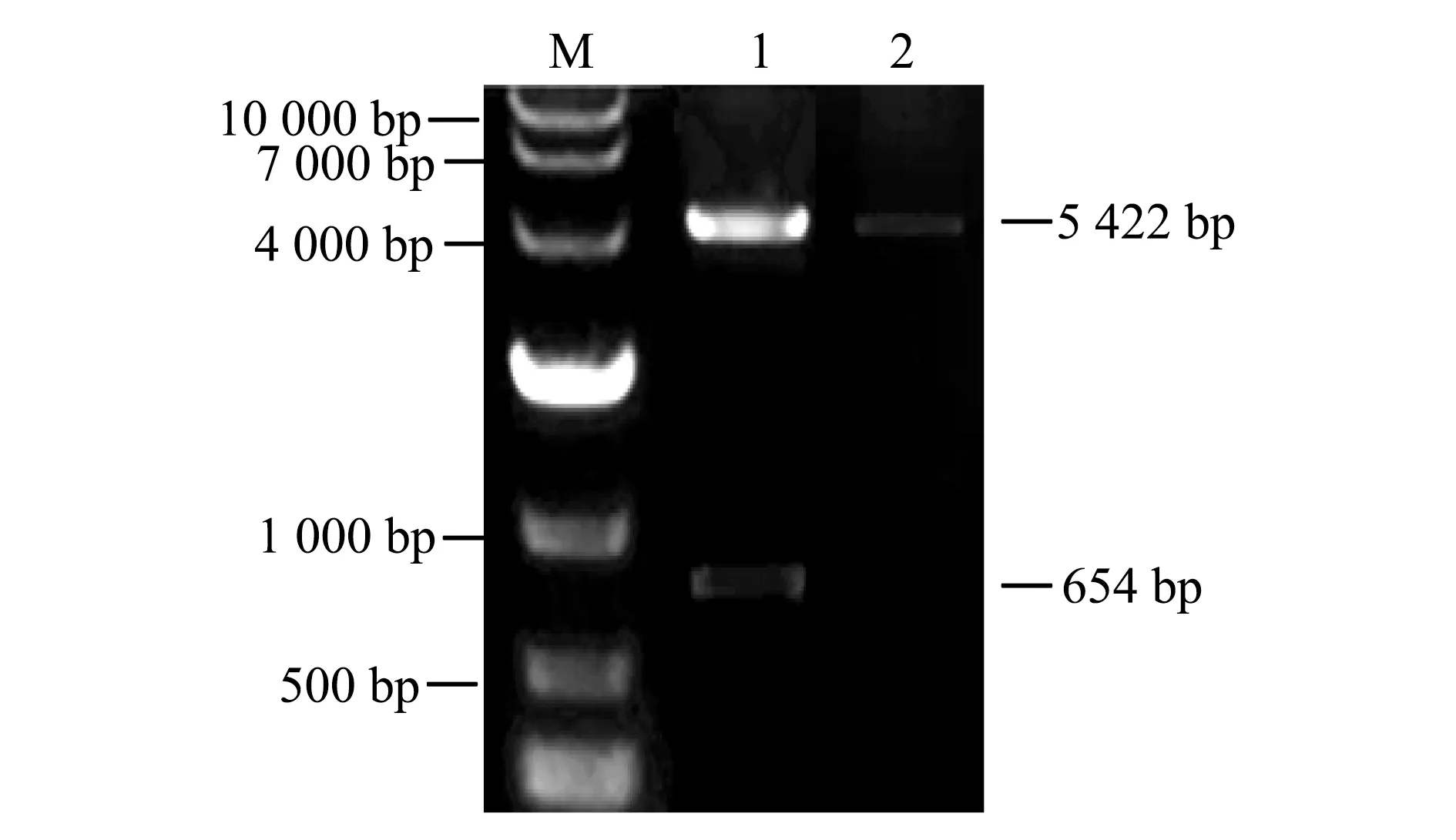
注:M是DL10000 DNA marker;1是pET-30a-HaDuox-p质粒双酶切;2是pET-30a载体双酶切

注:M是蛋白Marker;1是未经IPTG诱导的菌液;2-5是菌液经IPTG分别诱导1、2、4和6 h
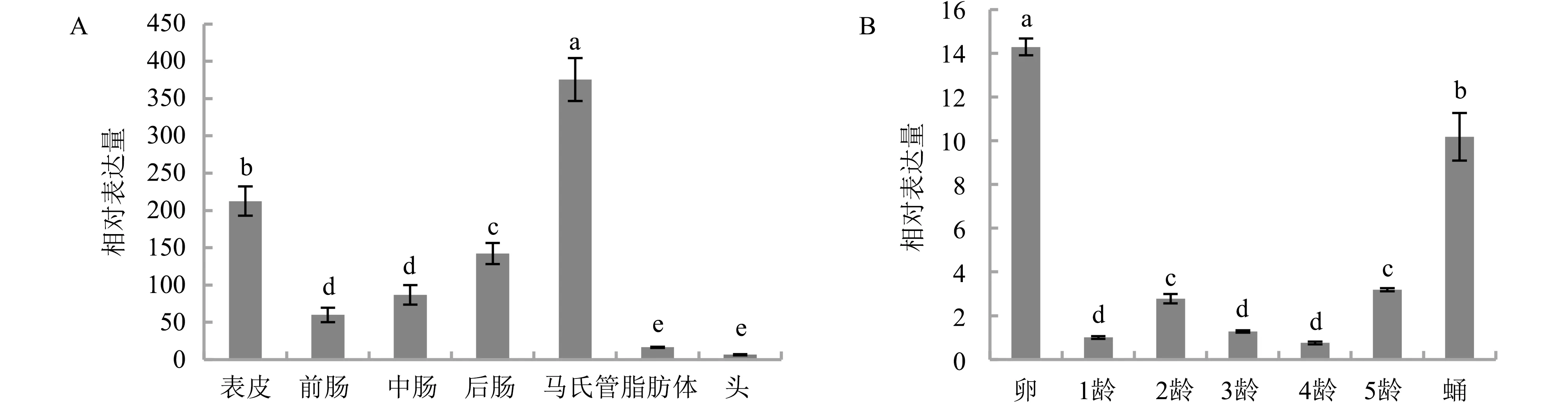
注:A为HaDuox在棉铃虫不同组织中的表达量;B为HaDuox在棉铃虫不同龄期的表达量;图中的不同字母表示显著差异(P<0.05)
2.5 棉铃虫HaDuox的病原诱导分析
利用实时荧光定量PCR分析苏云金杆菌SY80菌液对棉铃虫HaDuox相对表达量的影响。棉铃虫取食该苏云金杆菌菌株后,与对照组相比,其肠道中HaDuox的表达量6 h时保持稳定,取食12、18和24 h后,HaDuox表达量显著增加,18 h和24 h较之前稍有下降,直至36 h恢复正常水平(图6)。这表明苏云金杆菌SY80菌液可以经口进入棉铃虫体内通过肠道感染昆虫,入侵宿主后能诱导宿主肠道HaDuox表达水平增加,推测棉铃虫通过产生肠道免疫响应以抵抗苏云金杆菌的侵染。
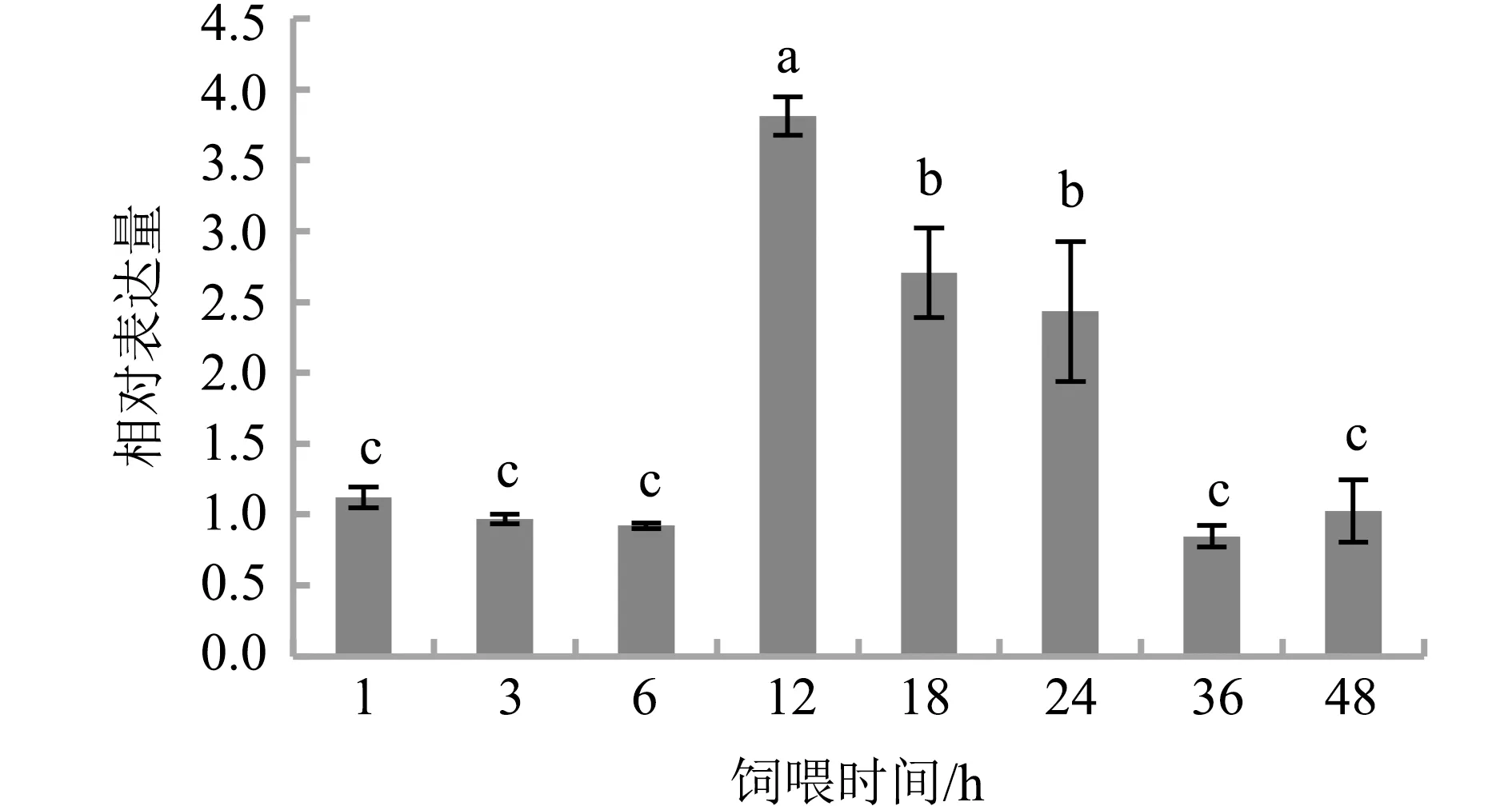
注:图中的不同字母表示样品存在显著差异(P<0.05)
3 讨 论
本研究通过RT-PCR技术成功克隆棉铃虫Duox基因编码区序列,命名为HaDuox。其开放阅读框大小为4 497 bp,编码1 498个氨基酸。相似性分析发现HaDuox与鳞翅目昆虫斜纹夜蛾、粉纹夜蛾和亚洲玉米螟的相似性较高,达到了95%以上。功能域预测表明HaDuox蛋白含有过氧化物酶结构域,钙离子结合域,铁还原结构域,黄素腺嘌呤二核苷酸结合域和烟酰胺腺嘌呤二核苷酸结合域,与家蚕、橘小实蝇、意大利蜜蜂和斑马鱼等多种物种相似,说明这类结构在物种间十分保守[11,17-19]。HaDuox共有7个跨膜区,其数量又与果蝇、橘小实蝇等Duox完全相同[13,19],Duox在物种间高度保守,推测其行使的功能也是非常保守的。马振刚等[18]研究表明,家蚕BmDuox可以帮助抵御家蚕微孢子虫;橘小实蝇BdDuox基因的沉默可导致宿主肠道细菌菌群密度、结构及细菌群落多样性改变[19];果蝇敲除双重氧化酶基因在肠道感染条件下不能有效清除外来微生物,对于肠道感染高度敏感[20];斑马鱼Duox能抵抗沙门氏菌感染[10]。由此可见,棉铃虫HaDuox可能在抵御昆虫肠道病原微生物,维持肠道菌群平衡的过程中发挥作用。
完整的HaDuox基因开放阅读框(open reading frame,ORF)长为4 497 bp,编码1 498个氨基酸,全长基因的体外表达难度较大,试图利用原核表达系统、酵母表达系统和昆虫Bac-to-Bac杆状病毒表达系统表达完整的HaDuox蛋白,但均未取得成功。选择HaDuox基因N端膜外蛋白区1 117到1 770 bp的核苷酸序列进行原核表达,预测蛋白分子量为25.26 kD,表达的产物与预测蛋白大小一致。HaDuox蛋白的膜外片段在大肠杆菌中成功表达,有助于实现对蛋白的纯化,并为后续以其为抗原制备多克隆抗体研究蛋白在组织中的定位和功能分析奠定基础。
对HaDuox的表达模式研究,其在棉铃虫的不同组织中均有表达,表明棉铃虫双重氧化酶HaDuox可能在虫体中行使多种功能。HaDuox在马氏管的转录水平较高,推测其可能参与棉铃虫的排泄功能,这与在大鼠中的发现较为一致,在大鼠的结肠组织中发现Duox的较高表达[21]。从其整个发育阶段来看,在各个发育阶段均有表达,证明其参与棉铃虫整个生活史。棉铃虫受苏云金杆菌SY80侵染6 h之内,HaDuox的表达水平为基础水平,12 h mRNA的表达水平激增,提示苏云金杆菌侵染棉铃虫后宿主能够对其进行识别,并调控HaDuox表达量,从而形成棉铃虫肠道对苏云金杆菌入侵的防御机制。本研究采用的苏云金杆菌SY80菌株含有cry2Ah7和cry1Ia37基因,对棉铃虫具有较高的生物活性,是棉铃虫的重要病原,能诱导HaDuox对其进行响应,其他对棉铃虫活性较低的苏云金杆菌菌株是否具有相同的诱导效果,仍需进一步研究。
近些年来,已有多种害虫对苏云金杆菌产生抗性问题,抗性发展成为苏云金杆菌应用的潜在威胁,亟待找出新的办法延缓苏云金杆菌抗性。通过对Duox基因的序列特征、表达模式和病原诱导进行分析,深入理解Duox-ROS免疫在昆虫肠道免疫中的重要作用及昆虫响应苏云金杆菌侵染的分子机制,为后续利用RNAi技术沉默昆虫肠道防御关键基因结合苏云金杆菌杀虫剂的防治方法提供新的思路。

