二倍体草莓匍匐茎遗传转化体系的建立
谷晓娇,沈元月
(农业应用新技术北京市重点实验室/北京农学院 植物科学技术学院,北京 102206)
草莓(Fragaria×ananassa)是蔷薇科(Rosaceae)特色果树之一,其果实酸甜可口、营养丰富,深受消费者喜爱;尤其结合设施栽培,弥补了冬春季鲜果采摘淡季,经济效益十分显著。由于栽培草莓是一个具有复杂基因组的八倍体物种,因此传统育种方法费时费力[1-2]。二倍体森林草莓与栽培草莓具有高度的序列一致性,并且由于其基因组较小(240 Mb),世代时间短,易于遗传转化,是研究草莓基因功能和遗传改良的理想材料[3-5]。
目前研究草莓基因功能可以采用瞬时转化或稳定遗传转化进行。农杆菌介导草莓果实直接注射法,已证明是瞬时基因功能鉴定快速有效的方法[6-9]。该方法虽然快速方便,但外源基因瞬时表达时间短,在鉴定基因功能上存在不足。如果进行遗传改良或者研究关于果实成熟生长发育较为复杂的基因调控网络,需要建立稳定遗传体系来完成则需要建立稳定遗传体系来完成[10]。过去草莓常用的遗传转化方法是通过农杆菌介导叶盘侵染法[11-14]。农杆菌介导叶盘侵染法为草莓稳定遗传转化主要方法,但该方法费时费力且叶片容易褐化及转化效率低[13-14]。镁螯合酶H亚基 ( CHLH) 通过催化镁卟啉的生成而参与叶绿素合成,抑制其表达转基因植株呈现出失绿表型,易于观测和早期鉴定[15-17]。因此,本试验以二倍体草莓Hawaii-4的匍匐茎的茎段为试验材料,以FvCHLH为操纵基因,通过优化各种转化的条件,以建立一种有效的草莓遗传转化体系。
1 材料与方法
1.1 植物材料和培养基配制
以二倍体草莓(Fragariavesca)Hawaii-4匍匐茎为材料。将二倍体草莓的匍匐茎悬空放置,避免与土接触,防止灭菌不彻底。
共培养基成分:4.43 g/L MS盐,2%蔗糖,2 mg/L噻苯隆,0.2 mg/L吲哚-3-丁酸,0.8%琼脂。MS侵染液成分:4.43 g/L MS盐,2%蔗糖,200 μmol/L As。筛选培养基成分:4.43 g/L MS盐,2%蔗糖,2 mg/L噻苯隆,0.2 mg/L吲哚-3-丁酸,35 mg/L卡那霉素, 200 mg/L特美汀,0.8%琼脂。生根培养基成分:4.43 g/L MS盐,2%蔗糖,1 mg/L 吲哚-3-丁酸, 0.8%琼脂。MS培养基(Murashige Medium, M519)购自美国Sigma-Aldrich公司。所有培养基在加入琼脂之前pH调为5.8,之后高压灭菌121 ℃ ,20 min,灭菌之后抗生素在55 ℃左右加入,每个培养皿倒20 mL培养基,组培瓶倒40 mL生根培养基。
1.2 RNAi载体构建
利用 Gateway 系统构建RNAi 重组质粒。首先扩增并克隆了FvCHLH基因465-bp 的 cDNA 片段,并将其克隆到 pDONRTM221载体中,利用 Gateway LR Clonase II 酶组合技术将其克隆到pK7GWIWG2(II)RR载体中。pK7GWIWG2(II)RR载体含有DsRed报告基因和卡那霉抗性基因。
1.3 农杆菌的培养与侵染液的配制
将pK7GWIWG2 (II) RR+FvCHLH转化农杆菌GV3101,挑取单菌落放入含有抗生素Rif (20 μg/mL)、Gen (50 μg/mL)、Spe (100 μg/mL) LB培养基, 在28 ℃、180 r/min下过夜培养。6 000 r/min离心5 min收集菌体,使用MS侵染液悬浮,制成农杆菌侵染液。
1.4 转化方法
剪取草莓的匍匐茎,先用70%乙醇消毒1 min,再用1%的次氯酸钠消毒10 min,每隔2 min晃动1次,然后用无菌蒸馏水冲洗3次,之后将无菌的茎段用剪子横向剪成1 cm长的小段,将小段放置在上述农杆菌侵染液中,侵染液的OD600为0.6,0.8、1和1.2,之后真空渗透10、15、20和25 min,用无菌滤纸吸干多余的农杆菌侵染液后,再将茎段转移到共培养培养基上,在25 ℃条件下暗培养1、2、3 d和4 d之后再转移到筛选培养基上。为了达到筛选效果,将未转化的茎段培养在含有不同浓度的卡那霉素(25、30、35和40 mg/L)的筛选培养基上,以便确定最合适的抗生素筛选浓度。在转化过程中每个培养皿放置20个茎段外植体,3次重复。培养温度为(23±1) ℃,光暗周期为16 h/8 h,光照强度30 000 lx (250 μmol·m-2·s-1)。
1.5 确定侵染最佳条件和转化效率
在筛选培养基上培养外植体,每2周换1次培养基,培养7周后出现芽点,利用体视荧光显微镜,观察每个试验处理的DsRed芽点数,以确定最佳侵染条件并对侵染效率进行分析。转化效率=DsRed+的愈伤组织/总的愈伤组织个数。
1.6 转基因植物的再生,继代和生根
对于FvCHLH-RNAi的转基因芽点可以用DsRed进行初步筛选,然后将有荧光的芽点继续放置在选择培养基上单独培养,直至将芽培养到可以切除的大小,将切下的芽放置在生根培养基中培养2周,最后将植株移栽至草炭∶蛭石=2∶1的基质中。
1.7 PCR阳性植株的鉴定
采用 CTAB 法提取FvCHLH-RNAi植株的叶片基因组DNA。以野生型植物叶片为对照。 利用 PCR 技术扩增了卡那霉素(Kan)和DsRed基因片段。所用引物序列:
Kan-F:5′-CGATAGAAGGCGATGCGCTG-3′;Kan-R:5′-CGCTTGATCCGGCTACCTG-3′,
Red-F:5′-CGCCCTTGGTCACCTTCAGCTTCAC-3′;Red-R:5′-CAATGCAGTGGGACCCACGGTTC-3′。卡那霉素基因PCR产物条带大小为400 bp。DsRed的 PCR产物条带大小为964 bp。
1.8 qRT-PCR分析
使用OMEGA 公司的 Plant RNAKit 试剂盒提取FvCHLH-RNAi植物的叶片和野生型植物叶片的RNA。cDNA合成使用全式金生物技术有限公司生产的 TransScript One-Step gDNA Removal and cDNA Synthesis SuperMix。使用TransStart Top Green qPCR SuperMix(北京全式金生物技术有限公司)进行荧光定量分析,Actin作为内参基因,PCR反应体系为Mix 5 μL,上下游引物各0.25 μL,cDNA 2 μL,去离子水2.5 μL,共10 μL。PCR 反应程序为:95 ℃预变性10 min,95 ℃变性30 s,58 ℃退火30 s,72 ℃延30 s,45个循环。荧光定量引物如下:FvCHLH-F:5′-TGGGTCCCCTGATAAC-3′,FvCHLH-R: 5′-CCAAATCCCACTGTCC-3′;FvACTIN-F:5′-GCCAACCGTGAGAA GATG-3′;FvACTIN-R:5′-TCCAGAGTCAAGAACAATACCAG-3′。所有样品分析均进行3次生物学重复。
2 结果与分析
2.1 FvCHLH-RNAi载体的验证
挑取转化农杆菌的单克隆,进行PCR扩增。经琼脂糖凝胶电泳检测(图4-a),扩增出目的条带约为523 bp,符合重组载体的设计。
2.2 抗生素浓度的确定
通过在培养基上添加不同浓度的抗生素,以确定茎段外植体对卡那霉素的敏感性及其最适抗生素浓度。在没有选择压力的情况下,培养7周后观察到95%的茎段产生了芽器官(图1-a)。当选择压力增加到35 mg/L卡那霉素,所有外植体的芽再生都受到抑制(图1-b)。在本研究中,使用35 mg/L卡那霉素作为最终选择的转化子,以消除逃逸(图1-c)。

a. 95%的外植体在共培养-培养基上产生大量的不定芽;b. 添加35 mg/L卡那霉素的筛选培养基上进行筛选后,完全抑制了叶片外植体不定芽的发生;c. 不同卡那霉素的浓度下外植体不定芽再生率
2.3 最佳条件和侵染效率
利用体视荧光显微镜,观察每个试验处理的DsRed芽点数确定最适侵染条件(图2-a)。在OD600值为1时侵染效果最好(图2-b)侵染效率可以达到10%明显高于其他处理,真空渗透时间为20 min时侵染效率达到8%,侵染效果显著高于其他处理(图2-c),暗培养时间为3 d时侵染效率可达到10%以上显著高于暗培养时间为1 d和2 d的试验处理,与暗培养时间为4 d的无显著差异(图2-d)。综上所述,利用草莓匍匐茎茎段法其转化效率可以达到8%以上(图2-b~d)。
2.4 FvCHLH-RNAi的植株再生
草莓匍匐茎的茎段经过7周培养,在筛选培养基上出现愈伤组织并出现芽点(图3-a);经过2~3周时间愈伤组织分化(图3-b, c);再经过2周时间芽慢慢分化出叶片(图3-d)。分化出的小苗单独移到生根培养基中1周,然后再移栽至土壤中,由图可以看出转基因植株与对照植株相比,植株呈明显矮小、黄化的表型(图3-e)。
2.5 转基因植株的鉴定
通过DsRed(图4-b)和Kan抗性基因(图4-c)的PCR鉴定分析,转基因植株扩增出了964 bp的DsRed条带(图4-b, 泳道3)和400 bp的Kan条带(图4-c泳道2),而野生型植株未能扩增出相应条带(图4-b 泳道1,图4-c泳道1)。通过对转基因植株和野生型植株qRT-PCR分析表明,转基因植株CHLH
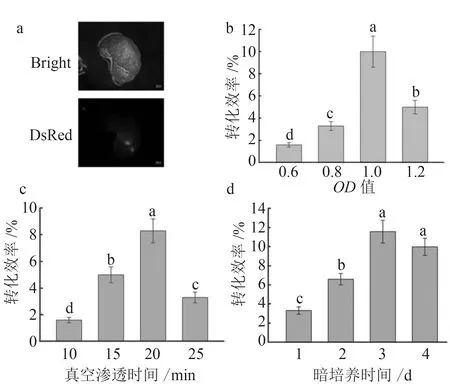
a. 愈伤组织中有DsRed荧光的芽点;通过对不同OD值(b)、真空渗透时间(c)或暗培养时间(d)进行评估。在做每一个侵染因素试验中,保持其他条件不变。对于不同的处理,小写字母表示样本均值之间的显著差异(P<0.05)

a. 匍匐茎茎段生成愈伤组织;b-d. 愈伤组织增殖、分化;e. 左边为移栽至土壤中的野生型植株,右边为转基因植株

a. FvCHLH-RNAi载体的琼脂糖凝胶电泳检测;b. DsRed 的PCR分析:泳道1为野生型植株叶片,泳道2为FvCHLH-RNAi重组载体的质粒,泳道3为转基因植株的叶片;c. Kan的PCR分析:泳道1为野生型植株叶片,泳道2为转基因植株的叶片;d. 转基因植株FvCHLH相对表达量
基因的表达量与对照相比显著被下调(图4-d)。这些结果在分子水平证明FvCHLH-RNAi载体已经成功转化。
3 讨 论
前人的草莓稳定遗传转化的外植体多用叶片:将草莓叶片剪成1 cm2的小块,然后放于农杆菌侵染液中浸泡6~8 min,然后通过叶片产生愈伤组织,进而诱导芽进行植物再生过程[2,13,18]。这种传统叶盘法叶片容易褐化,愈伤组织诱导不稳定、转化效率低。本研究利用二倍体草莓匍匐茎的无菌茎段,探讨一种新型高效的农杆菌介导的转化方法。为了获得最大的转化效率,研究并优化了一些转化参数,包括不同侵染液的OD值,不同的真空渗透时间,不同的暗培养时间(即共培养时间)。为了消除在转化过程中可能获得的大量嵌合体和逃逸物[19-20],还进行了抗生素浓度的选择。在此研究中,相比传统叶盘法主要优点有:草莓匍匐茎的茎段可稳定诱导大量的愈伤组织,利用真空渗透侵染草莓茎段,比单纯的浸泡更能使农杆菌侵入植物组织中[21]。
另外,为了转基因植株早期鉴定,还利用了有效简便检测的报告基因,如DsRed荧光基因。CHLH基因干扰后,由于叶绿素的合成受到抑制,叶片出现黄花现象,容易观测。总之,本试验通过优化一系列的转化条件,建立了一种利用匍匐茎的茎段稳定有效的转基因体系,为今后草莓的基因改良提供借鉴,对草莓果实发育和分子育种有一定的研究意义。

