基于“配伍-拼合”理论中药新药发现模式的构建与应用
崔鹤蓉 李磊 郭文博


摘要 药物研发在近几十年来虽然取得了许多技术进步,但是其研发过程依然缓慢、昂贵且风险高。日前,我国已把新药研究列入国家发展战略的重大专项,建立一套高效低耗的药物研发模式迫在眉睫。“配伍-拼合”系指将中药复方的配伍原则和化药设计中的结构拼合原理相结合,从经典药对中选择有效成分进行拼合,有机组合不同的药物单元,以达到增效、减毒的目的,进而发现可开发为临床新药的先导化合物,基于“配伍-拼合”的研究思路,国内外学者完成了诸多实践。本观察组以“配伍-拼合”理论为指导,长期致力于中药先导化合物的发现与开发研究,以临床经典方药中有效成分为先导,结合现代药学评价手段,筛选出多个高效、低毒、靶向中药先导化合物。基于此,在调研国内外相关研究的基础上,雷海民教授原创性地提出基于“配伍-拼合”理论的中药新药发现模式,以期为现代新药研发创制提供新的思路。
关键词 新药研发;配伍;拼合;研究模式;中药;新药;复方;先导化合物
Abstract Despite technological advances in recent decades,drug research and development remains slow,expensive and has high risks.Nowadays,our country has already included new drug research on the major special project of national development strategy,thus establishing a research mode for drug discovery with high efficiency and low consumption is extremely urgent.“compatibility and combination”refers to the combination of compatibility in Chinese compound medicines and the structural combination in the design of chemical drugs.The effective components are selected from the classical compatibility for combination,and different units are organically combined to achieve the purpose of enhancing efficacy and reducing toxicity,so as to discover the leading compounds that can be developed as new clinical drugs.Guided by the theory of“compatibility and combination”,our research group has long been committed to the discovery and development of leading Chinese compounds,taking the effective components of classic clinical medicine as the lead and combining with modern drug evaluation methods,to screen out a number of high-efficiency,low-toxicity and targeted leading compounds of Chinese medicine.Based on this,based on the investigation of relevant research at home and abroad,Prof.LEI creatively proposed a new drugs of Chinese medicine discovery mode in order to provide new ideas for modern drug research and development.
Keywords Drug discovery; Compatibility; Combination; Research mode; Traditional Chinese medicine; New drugs; Compound; Leading compounds
中圖分类号:R283文献标识码:Adoi:10.3969/j.issn.1673-7202.2020.18.029
药物研发在近几十年来虽然取得了许多技术进步,但是其研发过程依然缓慢、昂贵且风险高。从一个小分子筛选到成为候选药物通常需要4~5年时间,耗费成本14百万至25百万美元,损失率约50%或更高[1]。最近估算结果显示,从候选药物到推出商业化产品,损失率高达97%,药物开发的总成本(包括损失成本和资本成本)超过26亿美元[2]。生物靶标的选择是损失的关键来源。因此,全世界新药研发中心在转化科学方面进行了大量投资,以便更有效地验证生物靶点在人类疾病中的作用,并确定用于评估潜在药物的最合适的患者群体。为了寻找有效的治疗方法,新的药物研发模式已被成功地开发出来,最著名的是基于抗体的疗法。然而,一些具有强大生物学基础的靶点,包括各种转录因子和细胞内蛋白-蛋白相互作用,无论对目前的小分子药物发现技术还是大分子方法都是非常具有挑战性的。因此,建立一套高效低耗的药物研发模式迫在眉睫。
天然产物和中药是新药发现的重要来源,国家对中医药的研究投入逐渐增加,屠呦呦获得诺贝尔奖更表明了中医药对维护人类健康的深刻意义,国际医学界对中国医学研究的关注也更加深切,中药领域正在实现从跟跑、并跑、到领跑的跨越,发现创新药物有很大的潜力。因此,构建具有中国特色、时代特色的新药发现技术体系,结合中医药配伍理论,通过应用高内涵分析技术(HCA)、网络药理学、基因组学、功能基因组学等新方法、新技术进行新药多靶点筛选,发现并优化先导化合物作为候选药物,对现代新药研发创制和中医药国际化有重要意义。
“配伍-拼合”理论系指将中药复方的配伍原则和化药设计中的结构拼合原理相结合,从临床有效的经典药对中选择有效成分进行拼合,有机组合不同的药物单元,以达到增效、减毒的目的,进而发现可开发为临床新药的先导化合物[3]。我们以“配伍-拼合”理论为指导,长期致力于中药先导化合物的发现与开发研究,以临床经典方药中有效成分为先导,结合现代药物评价手段,筛选出多个高效、低毒、靶向中药先导化合物[4-10]。基于此,雷海民教授提出基于“配伍-拼合”理论的中药新药发现模式,将中医传统用药思想、现代药物设计的拼合原理及现代药物发现的其他相关方法应用到中药创新药物设计中,以期获得符合中药作用特点(多成分、多靶点、多途径)的先导化合物,以期为现代新药研发创制提供新的思路。
1 现状与问题
1.1 药物研发模式亟待创新
经典的药物研发流程在概念上可以分为两部分[1]。第一个组成部分是药物发现,通过初始筛选实现——通常是一种高通量的体外试验,可筛选多达106种化合物,设置和分析这样的筛选工作通常需要1年时间。第二部分是通过设计-制造-测试-分析循环(DMTA循环)确定候选药物。除了预期的生物活性之外,这种优化还必须考虑对候选药物至关重要的其他特性,包括药代动力学和安全性。大型制药公司的化学团队通常可以在1~2个先导序列上并行执行DMTA循环,每次循环需要4~6周。近年来药物研发基本策略的进展主要集中在初始筛选部分,使第一部分的药物发现并不完全依赖于大规模筛选(尽可能规避损失成本),探索更高效低耗的药物发现思路与新方法[11]。高通量的化学实验和分析工具的发展,使得在1 d内进行超过1 500次的微克级同步实验成为可能,能够快速识别合适的反应条件,探索化学空间,加速药物发现[12]。然而,预测化学合成领域仍处于起步阶段,通过机器学习过程构建预测算法的技术仍需在未来几年进一步提高[13],并且,上述这种主流的药物发现模式局限于多学科交叉背景的专业人才和科研平台,难以被广泛应用[14]。
1.2 亟需构建具有中国特色的新药发现研究模式
尽管我国的新药研究领域近年来有了长足的进步,从“仿制”阶段转向“仿创”阶段,然而,在研发思路、生物学技术等方面与西方国家仍存在较大差距[14]。我国从20世纪80年代开始,全国科研单位相继开展了基于动物模型的药物筛选工作,但是尚未形成规模化[15-17]。直到1996年,中国医学科学院药物研究所引进了国内第一台Biomek2000型实验室自动化工作站,标志着全国性的大规模药物筛选拉开序幕[18]。目前,我国各大科研机构引进以高通量药物筛选模式为主的相关新理论、新方法、新技术来发展我国的新药研发,缺乏源头创新[19-20]。
中医药学具有数千年的临床应用基础,其整体观、辨证论治思想、组方配伍理论与当今现代医学对诊治疾病的认识趋势一致,为我们提供了一个巨大的天然产物资源库,减少筛选的盲目性[21]。我国的药物筛选工作应该充分利用我国丰富的中医药临床经验、独特的理论和中药资源,借鉴国际先进的科学技术,开展高水平的符合国情的药物筛选工作,为推动中医药国际化作出贡献[21-24]。日前,我国已把新药研究列入国家发展战略的重大专项,建立一套高效低耗的药物研发模式迫在眉睫。见图1。
2 符合中医药特点的新药发现模式的提出
2.1 “配伍-拼合”理论
“配伍-拼合”理论属于中药化学学科范畴。“配伍-拼合”系指将中药复方的配伍理论和化药设计中的结构拼合原理相结合,从经典药对中选择有效成分进行拼合,有机组合不同的药物单元,以达到增效、减毒的目的,进而发现可开发为临床新药的先导化合物。配伍理论和拼合原理形式相似、目的相同,能相对高效快速地发现具有开发潜力的先导化合物[25-34]。
2.2 基于“配伍-拼合”理论的新药发现模式的提出
“配伍-拼合”理论提出之前,课题组主要从事传统中药化学研究模式为主的中药/复方物质基础发现、分离及结构修饰研究,在完成Ⅰ类治疗乙型肝炎新药海鞘醇的临床前研究过程中,认为传统中药化学研究模式存在从中药/复方中分离活性物质存在含量低、富集纯化困难、生物效价低存在安全性风险等问题,基于此,雷海民教授提出“配伍-拼合”理论,并以此为核心主持完成国家自然科学基金面上项目——基于川芎系列对药的先导化合物的发现研究(No.81173519),奠定了课题组创新中药新药研发模式(图2),旨在完善基于“配伍-拼合”理论为关键技术的中药复方新药创制研究平台,构建确有疗效的先导化合物库,建立符合中医药特点的新药创制新模式。
3 研究思路
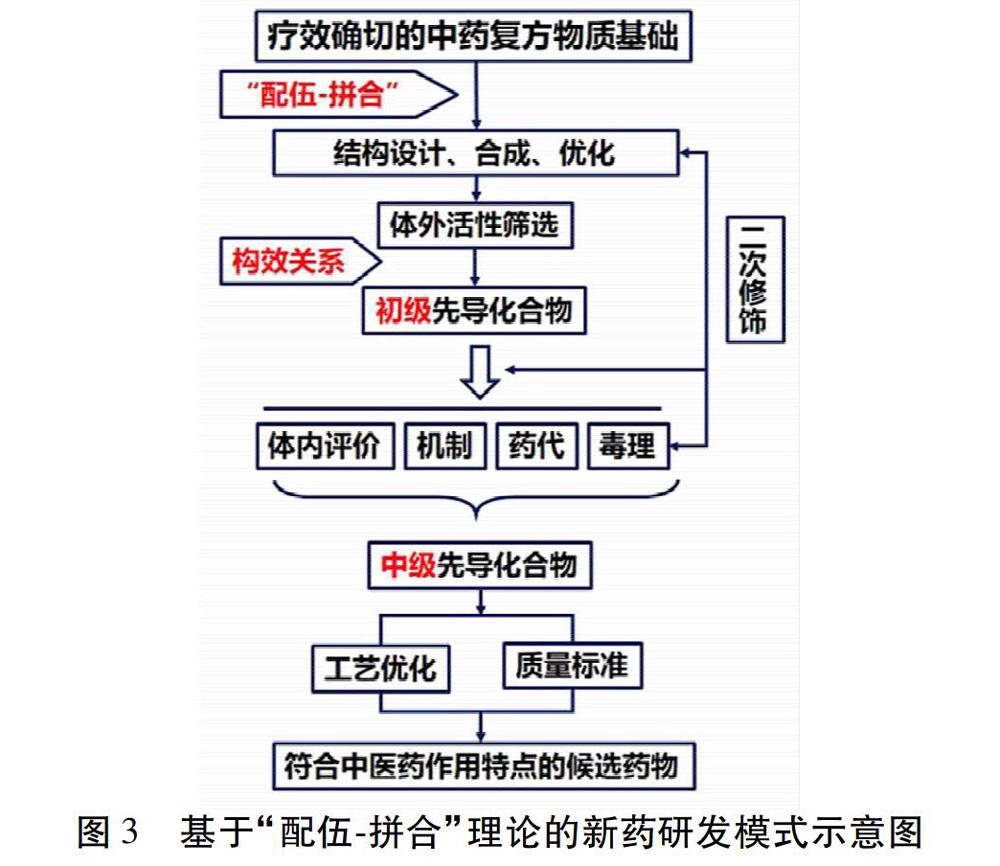
基于“配伍-拼合”理论的中药新药发现模式,旨在结合拼合原理,将经典方药中的功效组分拼合在一个分子中,以高效获得不良反应小、药理活性更好的创新药物。具体而言,研究思路(图3)可概括为:经典中医方药功效组分系统分析,结合现代药物设计和化学合成技术,现代药物体内外筛选方法(药效学、毒理学研究),现代药物代谢动力学研究,完成成药性评价等各项临床前研究工作,获得符合中医藥特点的先导化合物,开展临床试验研究,获得具有自主知识产权的国家Ⅰ类创新药物。基于上述研究思路所得到的系列新化学实体,无论是通过分离还是合成,其来源均是经典方药的功效成分,因此其药效评价建立在中药复方的临床应用基础上,以方药临床治疗疾病类型作为药理活性筛选模型选择的依据,不仅体现中药经典名方有效物质功能主治病/证特色,更能有效地减少药物前期筛选的盲目性,可以更加有的放矢的对得到的系列化合物的进行药效学评价。
4 应用示例
这部分以具有神经保护活性的候选药物,川芎嗪-安息香酸拼合物T-VA为例,详细介绍新药研发模式。川芎嗪-安息香酸系列拼合物的设计源于《太平惠民和剂局方》中收载的安息香圆,选择安息香中主要活性成分安息香酸及川芎中川芎嗪作为基本结构单元,在化药拼合原理的指导下,合成系列川芎嗪-安息香酸拼合物,并通过体外筛选、体内评价等环节,发现确有疗效的神经保护候选药物T-VA,该化合物有望实现成果转化。
4.1 川芎嗪-安息香酸系列拼合物的合成、结构及体外活性表征
川芎嗪-安息香酸系列拼合物都是通过图4A概述的路线合成的。2-溴甲基-3,5,6-三甲基吡嗪和3,5,6-三甲基吡嗪-2-甲酸是本研究的重要中间体。1a-5a的典型合成步骤包括在碱性条件下通过形成酯键和醚键,将溴-川芎嗪与其他羟基苯甲酸拼合,然后在20%(w/v)KOH水溶液中水解相应的川芎嗪氧基苯甲酸酯1a-5a,得到化合物1b-5b。上述拼合物的结构式如图4B所示。
基于CoCl2致PC12细胞损伤模型,采用MTT法,初步评价上述拼合物的保护作用。4C中列举了川芎嗪-安息香酸系列拼合物对PC12损伤细胞的EC50值,结果表明,合成的衍生物能有效保护CoCl2损伤的PC12细胞,大部分拼合物的活性高于川芎嗪(EC50=64.459 μmol/L)。其中,拼合物4a具有最强的保护活性(EC50=4.25 μmol/L),该化合物被命名为T-VA,待进一步评价其体内外神经保护作用。
4.2 T-VA的体内外神经保护活性评价及机制研究
本部分采用经典大脑中动脉闭塞SD大鼠模型及CoCl2致PC12细胞损伤模型,以尼莫地平(NMDP)为阳性对照药,研究T-VA的神经保护活性及主要机制。结果显示,T-VA能通过抑制损伤神经细胞的炎性反应,发挥体内外神经保护活性。
体内实验部分,雄性SD大鼠随机分组,用尼龙丝(直径0.25 mm)结扎颈总动脉导致脑缺血模型,采用神经功能缺损评分、握力试验等指标,评价T-VA的神经保护活性。结果显示,模型组大鼠出现了严重的神经系统损伤,而T-VA给药(60、120 mg/kg)能有效保护这种损伤。体外实验对T-VA的机制进行研究,采用免疫组织化学技术检测PC12细胞中核因子-κB/p65、COX-2表达,结果显示,模型组胞质中核因子-κB/p65、COX-2显著升高,而T-VA给药(60 μmol/L)能下调胞质中核因子-κB/p65、COX-2的异常表达,显示出良好的抗炎活性[10]。
4.3 T-VA的体内代谢产物及急性毒性研究
仪器采用Accela 600 pump高效液相色谱-LTQ-Orbitrap XL质谱联用仪,色谱柱为Agilent Zorbax SBC18(205 mm×4.6 mm×5 μm),电喷雾离子源(ESI)。色谱条件为流动相:A为0.1%甲酸水溶液,B为甲醇;梯度洗脱程序:0~20 min,70%B~85%B,流速1.0 mL/min;柱温25 ℃;进样量10 μL。质谱条件为ESI正离子模式,质量扫描范围50~1 000 m/z;喷雾电压30 kV;毛细管温度300 ℃;辅助气流速180 L/h;分析时,先采用高分辨傅里叶全扫描采集以及质谱,采用二维线性离子阱(LTQ)采集二级和三级质谱,自动选取上一级最强例子峰进行碰撞诱导解离裂解,碰撞能量为30%。雄性SD大鼠灌胃给药T-VA(120 mg/kg),腹主动脉采血,收集血浆,离心、沉淀蛋白、氮吹后以甲醇溶解,0.45 μm过滤后进样。根据裂解规律及代谢图谱[35],结果显示,给药大鼠血浆中除原型药(RT=6.25 min)外,还能检测到1种主要代谢产物M1(m/z 317.148 6)。
急性毒理学试验采用ICR小鼠雌雄各半,每组15只,12 h内3次以最大耐受剂量(45 mg/mL)的T-VA给药,0.4 mL/10 g,观察给药后14 d小鼠的行为学、毒理学及死亡情况。结果显示,给药后小鼠无毒性症状及异常行为,平均体质量和正常组小鼠没有差异。
5 基于“配伍-拼合”理论中药新药发现模式的意义及应用价值
本研究思路能体系中医药的作用特点,将中医传统用药思想、现代药物设计的拼合原理及现代药物发现的其他相关方法应用到中药创新药物设计中,以期获得符合中药作用特点(多成分、多靶点、多途径)的先导化合物,该研究思路和研究方法对中医药现代化和国际化有一定借鉴意义。本课题组以“配伍-拼合”理论为指导,依托北京市中药基础与新药研究重点实验室,长期致力于中药先导化合物的发现与开发研究,以临床疗效确切的经典方药中有效成分为先导,如异叶败酱、姜黄、人参、蜂胶、加味西黄丸、十全大补汤等中的抗肿瘤活性成分,进行结构拼合研究,并在初步的药理活性筛选工作基础上,合成化合物并进行结构修饰或改造,获得全新的化学实体,再结合现代药物评价手段,筛选出高效、低毒、靶向中药先导化合物。我们在长达7年多的实践中,共在国内外高水平杂志上发表论文200余篇,申请国家发明专利6项,获得国内外授权发明专利,并完成成果转化[4-10]。
其中,基于原创研发思路,本团队运用“中药复方配伍法则·拼合原理”对“西黄丸”抗癌先导化合物开发与发现研究,历时5年,完成千余新化合物设计、合成、活性筛选及成药性评价工作,具体包括全新的化学实体的合成及结构修饰或改造,综合多种体内外活性筛选模型评价其药效活性,最后,经过构-效关系分析,获得高效、低毒、选择性好的抗癌先导化合物TBA-X,并成功将其专利ZL201110055102.X转让于上海思路迪医药科技公司,有望成功研制成为抗肿瘤Ⅰ类新药。TBA-X的诞生正是源于传统中医药宝貴财富与和现代研究技术有机结合,也证实了“中药复方配伍法则·拼合原理”理论指导下中药创新药物发现模式具有较大潜力。从传统中医药中挖掘新药开发素材,运用多种手段进行中药创新药物开发研究,对中医药源头创新具有重要意义。
6 结语
人类基因组计划完成之后,生命科学的发展正面临着从还原分析向系统整合的转型[36-37],各类组学、系统生物学、系统医学、系统药学的结合和应用成为目前新药研发领域的重点发展方向[38-39]。然而,新药发现方法体系依然在知识整合、功能分析方面面临严峻的挑战[40-46]。中药学建立在中医药宏观认识的基础之上,采用“司外揣内”的分析和综合方法[47],与生物医学的对接将为现代新药研发带来具有引领性的学术发展方向[48-50]。在传承现代中药研发“理法方药,剂工质效”理论的基础上,结合系统科学动态分析和经典药物研发前沿技术[51-54],建立符合中国特色的药物发现技术体系,将为现代新药研发领域带来新的机遇。
參考文献
[1]Paul SM,Mytelka DS,Dunwiddie CT,et al.How to improve R&D productivity:the pharmaceutical industry′s grand challenge[J].Nat Rev Drug Disc,2010,9(3):203-214.
[2]DiMasi JA,Grabowski HG,Hansen RW.Innovation in the Pharmaceutical Industry:New Estimates of R&D Costs[J].J Health Econ,2016,47(5):20-33.
[3]李碧,褚福浩,龚晏,等.“配伍法则·拼合原理”在中药新药研发中的应用[J].中国科学:生命科学,2016,46(8):1001-1007.
[4]Wang P,She G,Yang Y,et al.Synthesis and biological evaluation of new ligustrazine derivatives as anti-tumor agents[J].Molecules,2012,17(5):4972-4985.
[5]Zhang CZ,Yan WQ,Li B,et al.A New Ligustrazine Derivative-Selective Cytotoxicity by Suppression of NF-κB/p65 and COX-2 Expression on Human Hepatoma Cells.Part 3[J].Int J Mol Sci,2015,16(7):16401-16413.
[6]绪扩,龚晏,徐冰,等.HPLC-HRMS鉴定抗癌先导物T-OA在鼠尿中的代谢产物[J].中国中药杂志,2014,39(5):911-915.
[7]绪扩,王鹏龙,徐昕,等.抗癌先导物T-OA在不同介质中的平衡溶解度及表观油水分配系数[J].北京中医药大学学报,2013,36(8):554-557.
[8]Hou P,Ni J,Cao S,et al.Preparation and evaluation of solid dispersions of a new antitumor compound based on early-stage preparation discovery concept[J].AAPS PharmSciTech,2013,14(2):629-638.
[9]Hou P,Cao S,Ni J,et al.In-vitro and in-vivo comparison of T-OA microemulsions and solid dispersions based on EPDC[J].Drug Dev Ind Pharm,2015,41(2):263-271.
[10]Wang P,Zhang Y,Xu K,et al.A new ligustrazine derivative--pharmacokinetic evaluation and antitumor activity by suppression of NF-kappaB/p65 and COX-2 expression in S180 mice[J].Pharmazie,2013,68(9):782-789.
[11]Davis AM,Plowright AT,Valeur E.Directing evolution:the next revolution in drug discovery?[J].Nat Rev Drug Discov,2017,16(10):681-698.
[12]Campos KR,Coleman PJ,Alvarez JC,et al.The importance of synthetic chemistry in the pharmaceutical industry[J].Science,2019,363(6424):eaat0805.
[13]Bostrm J,Brown DG,Young RJ,et al.Expanding the Medicinal Chemistry Synthetic Toolbox[J].Nat Rev Drug Discov,2018,17(10):709-727.
[14]Scott DE,Bayly AR,Abell C,et al.Small molecules,big targets:drug discovery faces the protein-protein interaction challenge[J].Nat Rev Drug Discov,2016,15(8):533-550.
[15]Rosenblatt M.The Large Pharmaceutical Company Perspective[J].N Engl J Med,2017,376(1):52-60.
[16]Bosworth N,Towers P.Scintillation proximity assay[J].Nature,1989,341(6238):167-168.
[17]Strunk G,Ederhof T.Machines for automated evolution experiments in vitro based on the serial-transfer concept[J].Biophys Chem,1997,66(2-3):193-202.

