益气化瘀散结方对胃癌SGC-7901细胞PI3K/AKt/Mtor信号通路的影响
裴俊文 魏丹丹 蒋立峰

摘要 目的:通过观察益气化瘀散结方干预后胃癌SGC-7901细胞PI3K/AKt/mTOR信号通路分子的表达变化,探讨益气化瘀散结方影响胃癌细胞增殖的作用机制。方法:体外培养SGC-7901细胞,采用益气化瘀散结方含药血清干预,细胞分为空白血清组及5%、10%、20%益气化瘀散结方含药血清组,药物干预后,MTT法检测细胞增殖情况,流式细胞术检测细胞周期变化,Western-blot、Real-time PCR技术检测PI3K、AKT、mTOR蛋白及mRNA的表达变化。结果:与空白血清组比较,不同浓度益气化瘀散结方含药血清均能不同程度抑制SGC-7901细胞的增殖,其中10%,20%更为明显,差异有统计学意义(P<0.05),时间上以48 h最为明显;与空白血清组比较,10%,20%益气化瘀散结方含药血清组G0/G1期细胞比例明显升高,S期细胞比例明显降低(P<0.05);与空白血清组比较,不同浓度益气化瘀散结方含药血清组PI3K、AKT、mTOR蛋白及mRNA表达水平明显降低,差异有统计学意义(P<0.05)。结论:抑制PI3K/AKt/mTOR信号通路可能是益气化瘀散结方抑制胃癌细胞增殖、调节胃癌细胞生长周期的重要作用机制之一。
关键词 胃癌;益气化瘀散结方;细胞增殖;细胞周期;PI3K/AKt/mTOR信号通路
Abstract Objective:To observe the expression changes of PI3K/AKt/mTOR signaling pathway molecule of gastric cancer cell line of SGC-7901,and to explore the mechanism of Yiqi Huayu Sanjie Decoction on affecting the proliferation of gastric cancer cells.Methods:SGC-7901 cells were cultured in vitro and treated with drug-containing serum of Yiqi Huayu Sanjie Decoction.Cells were divided into a blank serum group,5%,10%,20% of drug-containing serum of Yiqi Huayu Sanjie Decoction groups.After drug intervention,the cell proliferation was detected by MTT,the cell cycle change was detected by flow cytometry,the protein and mRNA expression of PI3K,AKT and mTOR were detected by Western-blot and Real-time PCR.Results:Compared with the blank serum group,different concentration of Yiqi Huayu Sanjie Decoction could inhibit the proliferation of SGC-7901 cells to some degree,in which 10% and 20% concentration were especially significant and the difference was statistically significant(P<0.05).The most obvious time was 48 h; compared with the blank serum group,the proportion of cells in the G0/G1 phase increased and S phase decreased significantly in 10% and 20% concentration of Yiqi Huayu Sanjie Decoction group drug-containing serum group(P<0.05); compared with the blank serum group,the expression of PI3K,AKT,mTOR protein and mRNA in serum of different concentration of Yiqi Huayu Sanjie Decoction were significantly decreased,the difference was statistically significant(P<0.05).Conclusion:Inhibition of PI3K/AKt/mTOR signaling pathway may be one of the important mechanisms of Yiqi Huayu Sanjie Decoction on inhibiting the proliferation and regulating the growth cycle of gastric cancer cells.
Keywords Gastric cancer; Yiqi Huayu Sanjie Decoction; Proliferation; Cell cycle; PI3K/AKt/mTOR signal path
中圖分类号:R242;R285.5文献标识码:Adoi:10.3969/j.issn.1673-7202.2020.18.003
胃癌(Gastric Cancer,GC)是世界上第4大最常见的癌症,也是全球第2大癌症相关死亡原因[1]。根治术后早期胃癌预后良好,而由于早期临床症状不明显,大多数胃癌被诊断时已为晚期,导致5年生存率极低。在西方发达国家,胃癌的5年生存率为10%~19%[2-3]。我国胃癌的发病率和死亡率在各种恶性肿瘤中均居首位,每年新发病例约40万,占世界总发病病例数的42%。因此,胃癌的治疗极具挑战性[4-5]。研究表明,PI3K/AKT/ m TOR信号通路在介导胃癌细胞生长、增殖、代谢、生存和血管生成中有重要的作用[3,5-6]。中医药在改善胃癌等肿瘤患者临床症状、提高生命质量、实现带瘤生存以及改善化疗不良反应等方面的作用已逐渐得到公认。本研究通过实验观察临床治疗胃癌的有效验方益气化瘀散结方对胃癌细胞株SGC-7901的影响,并通过PI3K/AKt/mTOR信号通路分子的变化,以探讨益气化瘀散结方调控胃癌细胞周期和增殖分子机制。
1 材料与方法
1.1 材料
1.1.1 动物 SPF级健康雄性SD大鼠20只,购于河南省实验动物中心,饲养于郑州大学附属肿瘤医院实验动物中心,动物许可证号:SCXK(豫)2018-0014,体质量180~220 g,动物饲养于温度23~26 ℃,湿度40%~70%,光暗周期12/12 h的动物房中,自由摄取饲料、饮水。所有实验流程均经郑州大学附属肿瘤医院动物研究伦理委员会批准(伦理审批号:2018033004)。
1.1.2 药物
益气化瘀散结方含药血清制备:20只大鼠按体质量随机分为益气化瘀散结方组和空白对照组,每组10只。益气化瘀散结方由党参15 g、白术10 g、黄芪30 g、当归15 g、川芎15 g、桃仁12 g、红花12 g、夏枯草15 g、土鳖虫9 g、炙甘草9 g组成。药物来源于河南省肿瘤医院中药房。益气化瘀散结方给药剂量按照成人临床等效剂量换算(正常人体质量按照70 kg,人与大鼠体表面积系数为6.3)灌胃12.6 g/kg,空白对照组灌胃等量蒸馏水。2次/d,连续4 d。最后1次灌胃1 h后用水合氯醛麻醉,采用无抗凝剂真空采血管从腹主动脉取血。室温静置2 h,3 500 r/min离心半径8 cm,离心20 min,同组分离的血清一块混匀,经恒温水浴56 ℃灭活30 min,在超净台用0.22 μm微孔滤膜过滤除菌后,分装,放入-80 ℃冰箱中保存备用。
1.1.3 试剂与仪器
人GC细胞株SGC-7901由河南中医药大学第一附属医院实验室惠赠。RPMI-1640细胞培养基(Solarbi公司,货号:31800-500)、胎牛血清(Hyclone公司,美国,货号:SV30087.02);MTT(Solarbio公司,货号:M8180)、二甲基亚砜(Sigma公司,美国,货号:D2650),胰蛋白酶(Solarbio公司,货号:T1320);PI3K抗体(CST公司,美国,货号:4249)、AKT抗体(CST公司,美国,货号:4691)、mTOR抗体(CST公司,美国,货号:2983)、β-actin抗体(CST公司,美国,货号:4970)、羊抗兔二抗(Santa Cruz公司,美国,货号:sc-2357);RNA提取试剂盒(TIANGEN公司,货号:DP430);反转录试剂盒(Vazyme公司,货号:R211-01);SYBR Green I荧光定量PCR试剂盒(Qiagen公司,美国,货号:208054);细胞周期检测试剂盒(BD公司,美国,货号:340242)。
1.2 方法
1.2.1 分组与模型制备
SGC-7901细胞生长至对数生长期,消化,种至96孔板,分为空白对照组、5%益气化瘀散结方含药血清组、10%益气化瘀散结方含药血清组、20%益气化瘀散结方含药血清组。
1.2.2 给药方法
空白对照组采用空白鼠血清干预,实验组分别采用5%益气化瘀散结方含药血清、10%益气化瘀散结方含药血清、20%益气化瘀散结方含药血清干预。
1.2.3 检测指标与方法 1)不同浓度益气化瘀散结方含药血清对SGC-7901细胞活性和增殖的影响:SGC-7901细胞生长至对数生长期,消化,种至96孔板,分为5%、10%、20%益气化瘀散结方含药血清组(实验组)和空白对照组,空白对照孔采用空白鼠血清。分别培养一定时间(12 h、24 h、48 h、72 h)后,MTT法检测细胞增殖率。2)流式细胞术检测各组细胞周期:胰酶消化细胞后,用冷PBS洗细胞2次,每次1 000 r/min离心半径8 cm,离心5 min;弃上清留大约50 μL液体以防止碰到细胞团,加入1 mL Buffer Solution并低速混匀细胞,1 000 r/min离心半径8 cm,离心5 min,洗涤2~3次;最后1次洗完后,加入1 mL Buffer Solution重悬细胞,计数,用Buffer Solution调整细胞密度为1×106个/mL;取0.5 mL含细胞5×105个,每管加Solution A 250 μL,用手轻拍混匀(勿用漩涡混匀);室温放置10 min,保留Solution A,再加Solution B 200 μL,轻轻混匀,室温孵育10 min,保留Solution A+B;加预冷Solution C 200 μL,轻轻混匀,2~8 ℃避光孵育10 min;最后用50 μm尼龙网过滤细胞,上流式细胞仪分析。3)Western-blot技术检测各组细胞PI3K、AKT、mTOR的蛋白表达:消化收集各组细胞,PBS 1 000 r/min离心半径8 cm,离心5 min,洗涤细胞2次,用RIPA裂解液(按1%的比例加PMSF)裂解细胞,1 000 r/min离心半径8 cm,离心10 min提取细胞总蛋白。按照BCA法进行蛋白定量,将各蛋白样品调整至一致浓度。根据实验取适量蛋白样品,按照4∶1的比例加入5×SDS上样缓冲液,混匀后95 ℃加热3~5 min,使蛋白变性。将变性的蛋白加入制好的SDS凝胶孔中,采用恒压法进行电泳,浓缩胶100 V、分离胶80 V。电泳结束后,取出凝胶,确定目的条带的大致位置后,将多余的凝胶切除,裁取比目的凝胶稍大的PVDF膜,甲醇中浸泡5 min,然后按照胶、滤纸、膜的顺序,其中胶在负极(黑的一面),于4 ℃环境下200 mA恒流转膜2 h。转膜完后取出PVDF膜,于5%脱脂奶粉中,摇床封闭1~2 h。用封闭液稀释抗体(PI3K、AKT、mTOR、β-actin,稀释比例参考抗体说明书),膜在抗体中4 ℃孵育过夜。弃一抗,TBST洗膜3次,5 min/次,然后加入稀释后的二抗于室溫下孵育1 h。TBST洗膜3次,5 min/次,加ECL发光液,室温孵育3~5 min,用Western Blot扫膜仪采集膜上的蛋白条带,并分析计算各条带的灰度值。4)Real time PCR技术检测细胞PI3K、AKT、mTOR mRNA的表达:根据Gen Bank靶基因序列设计引物,以GAPDH为内参,均由上海生工生物工程技术有限公司合成。GAPDH序列:上游TCGGAGTCAACGGATTTGGT,下游TTCCCGTTCTCAGCCTTGAC,产物181 bp。PI3K序列:上游AGATCGCTCTGGCCTCATTG,下游TCCAGGTCATCCCCAGAGTT,产物150 bp。AKT序列:上游AGCCTGGGTCAAAGAAGTCA,下游TACTCCCCTCGTTTGTGCAG,产物195 bp。mTOR序列:上游AAGCCGCGCGAACCTC,下游CTGGTTTCCTCATTCCGGCT,产物134 bp。消化收集各组细胞,提取总RNA,反转录,然后采用SYBR-Green荧光定量试剂盒,罗氏480实时荧光定量PCR仪检测各组细胞PI3K、AKT、mTOR mRNA表达,采用2-△△Ct法进行数据分析。
1.3 统计学方法
采用SPSS 19.0统计软件进行数据分析,其中计数资料以(%)表示,采用χ2检验,计量资料以(±s)表示,采用t检验,以P<0.05为差异有统计学意义。
2 结果
2.1 益气化瘀散结方含药血清对SGC-7901细胞增殖的抑制作用比较
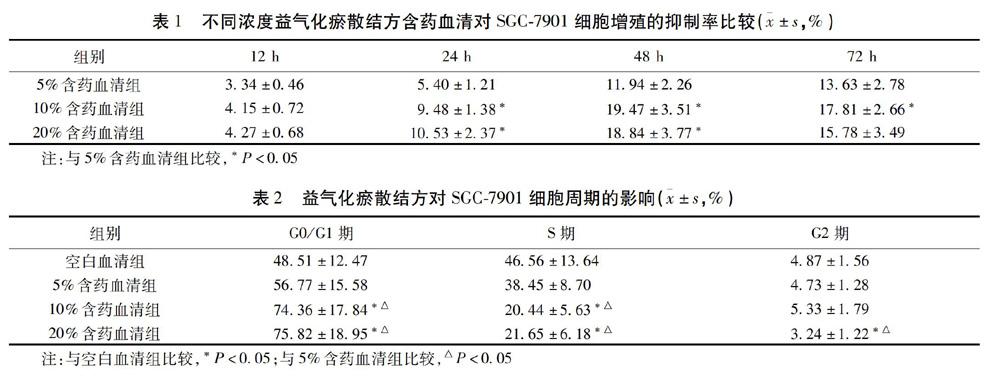
与空白对照组比较,5%、10%、20%益气化瘀散结方含药血清均能不同程度的抑制SGC-7901的增殖,其中以10%、20%含药血清抑制作用明显(P<0.05);在时间上,随着时间延长,益气化瘀散结方含药血清对SGC-7901细胞增殖的抑制作用逐渐增强,48 h达到高峰,至72 h已经下降。因此本研究后续实验以48 h为各浓度益气化瘀散结方含药血清干预时间。见表1。
2.2 益气化瘀散结方对SGC-7901细胞周期的影响
用流式细胞术检测各组细胞的周期分布情况,结果显示,与空白血清组和5%含药血清组比较,10%、20%益气化瘀散结方含药血清组G0/G1期细胞比例明显升高,S期细胞比例明显降低(P<0.05)。见表2。
2.3 益气化瘀散结方对SGC-7901细胞PI3K、AKT、mTOR蛋白表达的影响
利用β-actin作为内参计算PI3K、AKT、mTOR蛋白在各组细胞中的相对表达量。结果显示,与空白血清组比较,5%、10%、20%益气化瘀散结方含药血清均能下调PI3K、AKT、mTOR蛋白的表达(P<0.05);不同浓度益气化瘀散结方含药血清组间比较,5%含药血清组PI3K、AKT、mTOR蛋白相对表达量高于10%、20%含药血清组(P<0.05)。见表3,图1。
2.4 益气化瘀散结方对SGC-7901细胞PI3K、AKT、mTOR mRNA表达的影响
以GAPDH作为内参基因,采用2-△△Ct法分析比较各组细胞目的基因变化。结果显示,与空白血清组比较,5%、10%、20%益气化瘀散结方含药血清均能下调PI3K、AKT、mTOR mRNA的表达;不同浓度益气化瘀散结方含药血清组间比较,5%含药血清组PI3K、AKT、mTOR mRNA相对表达量高于10%、20%含药血清组见表4。
3 讨论
PI3K/Akt/mTOR信号通路是肿瘤细胞增殖和存活的重要通路,参与胃癌细胞的增殖、周期、转移和耐药性[7]。研究表明,PI3K/Akt/mTOR信号通路在胃癌组织中异常表达,其表达明显高于癌旁组织[8-9]。AKT是炎性反应和肿瘤发生的关键蛋白,其表达和激活可促进胃癌发生,胃癌组织中磷酸化AKT水平高于周围非肿瘤组织,且其水平与肿瘤和淋巴结转移阶段显著相关[12]。AKT参与胃癌发生发展的机制与端粒酶活性、核因子κB激活、缺氧诱导因子1等相关,可作为胃肠癌转移的生物标志物和胃癌治疗的分子靶点[10-11]。mTOR是AKT下游的重要靶点,参与调节许多致癌和代谢事件的关键点,调节细胞自噬和细胞生长抑制。研究发现,mTOR的激活受PI3K/AKT、MAPK、ERK1/2等调控,磷酸化后促进下游靶点如p70-S6激酶(p70S6K)和真核起始因子4E结合蛋白1(4E-BP1),导致肿瘤进展[13]。
中医药在稳定胃癌病灶、改善患者生命质量、延长患者生存期等方面都已得到肯定。研究表明,中医药通过调节PI3K/Akt/mTOR信号通路影响胃癌的发生发展与预后。张逸绒研究发现,胃癌Ⅰ号方可明显抑制SGC-7901细胞的增殖和迁移,并将SGC-7901细胞的细胞周期阻滞于G0/G1期,其抗肿瘤作用可能与增加PTEN蛋白的分泌,下调PI3K/AKT信号通路相关[14]。除胃癌外,在其他肿瘤研究也发现,中医药通过调节PI3K/Akt/mTOR信号通路对肿瘤的发生和转移有抑制作用。赵天一研究阳和汤大鼠含药血清对乳腺癌的实验发现,阳和汤能明显抑制人乳腺癌MDA-MB-231细胞的增殖,促进其凋亡,并将细胞周期阻滞于G2/M期,进一步探索其机制发现,阳和汤可下调p-PI3K、p-Akt和p-mTOR蛋白的表达,促进PTEN蛋白的表达[15]。
中医学认为,胃癌的病机多为虚实夹杂,正气亏虚为本,瘀毒互结为标,本研究采用的益气化瘀散结方由党参、白术、黄芪、当归、川芎、桃仁、红花、夏枯草、土鳖虫、炙甘草组成,临床应用显示,其能能提高患者生命质量,改善临床症状体征,同时可抑制早期胃癌肿瘤的生长。本研究显示,与空白血清组比较,不同浓度益气化瘀散结方含药血清尤其是10%、20%浓度组均能不同程度抑制SGC-7901细胞的增殖。通过对细胞周期的观察发现,益气化瘀散结方含药血清尤其是10%、20%浓度组干预后,能使更多的SGC-7901细胞处于G0/G1,这可能是其抑制SGC-7901细胞增殖的重要机制。通过Western-blot、Real-time PCR对PI3K、AKT、mTOR基因的表达情况进行分析,结果显示,与空白血清组比较,不同浓度益气化瘀散结方含药血清组PI3K、AKT、mTOR蛋白及mRNA表達水平明显降低,这提示益气化瘀散结方抑制胃癌细胞增殖、调节胃癌细胞生长周期的作用,可能与调控PI3K/Akt/mTOR信号通路相关。
参考文献
[1]Siegel RL,Miller KD,Jemal A.Cancer Statistics,2017[J].CA Cancer J Clin,2017,67(1):7-30.
[2]Thiel A,Ristimki A.Gastric cancer:basic aspects[J].Helicobacter,2012,17(1):26-29.
[3]Qiu YS,Jiang NN,Zhou Y,et al.LMO3 promotes gastric cancer cell invasion and proliferation through Akt-mTOR and Akt-GSK3β signaling[J].Int J Mol Med,2018,41(5):2755-2763.
[4]白慧霞.中国胃癌发病率及死亡率研究进展[J].临床医药文献杂志(连续型电子期刊),2019,6(7):192.
[5]Li Y,Liu Y,Shi F,et al.Knockdown of Rap1b Enhances Apoptosis and Autophagy in Gastric Cancer Cells via the PI3K/Akt/mTOR Pathway[J].Oncol Res,2016,24(5):287-293.
[6]Liu Y,Huang Y,Zhang J,et al.TIMMDC1 Knockdown Inhibits Growth and Metastasis of Gastric Cancer Cells through Metabolic Inhibition and AKT/GSK3β/β-Catenin Signaling Pathway[J].Int J Biol Sci,2018,14(10):1256-1267.
[7]Xiong J,Li Z,Zhang Y,et al.PRL-3 promotes the peritoneal metastasis of gastric cancer through the PI3K/Akt signaling pathway by regulating PTEN[J].Oncol Rep,2016,36(4):1819-1828.
[8]Ying J,Xu Q,Liu B,et al.The expression of the PI3K/AKT/mTOR pathway in gastric cancer and its role in gastric cancer prognosis[J].Onco Targets Ther,2015,8:2427-2433.
[9]Tian WY,Chen WC,Li R,et al.Markers CD40,VEGF,AKT,PI3K,and S100 correlate with tumor stage in gastric cancer[J].Onkologie,2013,36(1-2):26-31.
[10]Sasaki T,Yamashita Y,Kuniyasu H.AKT plays a crucial role in gastric cancer[J].Oncol Lett,2015,10(2):607-611.
[11]Sasaki T,Kuniyasu H,Luo Y,et al.Increased phosphorylation of AKT in high-risk gastric mucosa[J].Anticancer Res,2013,33(8):3295-3300.
[12]Joo MK,Park JJ,Yoo HS,et al.The roles of HOXB7 in promoting migration,invasion,and anti-apoptosis in gastric cancer[J].J Gastroenterol Hepatol,2016,31(10):1717-1726.
[13]Hu C,Zou MJ,Zhao L,et al.E Platinum,a newly synthesized platinum compound,induces autophagy via inhibiting phosphorylation of mTOR in gastric carcinoma BGC-823 cells[J].Toxicol Lett,2012,210(1):78-86.
[14]張逸绒.胃癌Ⅰ号方体外对人胃癌SGC-7901细胞PI3K/AKT信号通路影响的实验研究[D].南京:南京中医药大学,2017.
[15]赵天一.基于PI3K/AKT/mTOR信号通路探讨阳和汤含药血清对人乳腺癌细胞增殖、凋亡的影响[D].兰州:甘肃中医药大学,2017.
(2018-11-07收稿 责任编辑:徐颖)

