新狼毒素A抑制小鼠黑色素瘤B16F10细胞糖酵解和迁移
赵微,陈小宇,于兰,丁杨芳,夏源,郑秋生,*
(1 石河子大学药学院/新疆植物药资源利用教育部重点实验室,新疆 石河子 832000;2 滨州医学院中西医结合学院,山东 烟台 264000)
恶性黑色素瘤(malignant melanoma,MM)是皮肤肿瘤中恶性程度最高的肿瘤[1],其主要生物学特征是侵袭和转移[2],50%~80%的晚期黑色素瘤患者会发生肝转移,8%~46%的黑色素瘤患者会发生脑转移[3],发生转移的晚期黑色素瘤患者中位生存时间仅为8 ~ 9个月,5年生存率不足5%[4]。全球每年新发皮肤恶性黑色素瘤约20余万例,而中国每年新发病例达2万余例[5],因此黑色素瘤已成为严重危及我国人民健康的疾病之一,如何有效地抑制黑色素瘤细胞的迁移和侵袭也成为临床治疗成功的关键。
研究发现黑色素瘤具有高度活跃的糖酵解进程,且丙酮酸激酶同工酶2(PKM2)呈过表达状态[6],这提示我们PKM2可能是抑制黑色素瘤侵袭与转移并能有效治疗黑色素瘤的潜在靶点。越来越多的研究表明,天然产物在肿瘤的治疗中通过抑制糖酵解表型及迁移而发挥着积极的作用[7]。新狼毒素A(Neochamae jasmin A,NCA)是从植物瑞香狼毒StellerachamaejasmeL.根中提取分离得到的黄酮类化合物[8],具有较强的体内外抗肿瘤作用[9-10],其抗癌谱广、不良反应小,可以通过调节细胞周期等特定的分子途径抑制多种肿瘤细胞的增殖并诱导细胞的凋亡[11],然而关于NCA对黑色素瘤B16F10细胞的增殖、侵袭及其相关机制的研究尚未有明确报道。因此,本研究主要揭示NCA对小鼠黑色素瘤B16F10细胞糖酵解和迁移的影响。
1 材料与方法
1.1 材料
1.1.1 细胞系
小鼠黑色素瘤B16F10细胞(购买于中国科学院上海生命科学院细胞资源中心)。
1.1.2 药品与试剂
NCA(纯度≥98%,Chemaces公司,武汉);二甲基亚砜(DMSO,Sigma-Aldrich公司,美国);胎牛血清(杭州四季青生物工程材料有限公司,中国);青霉素-链霉素混合溶液(HyClone公司,美国);胰蛋白酶(北京索来宝科技有限公司,中国);DMEM低糖培养基(Gibco公司;美国);葡萄糖测定试剂盒(北京普利莱基因技术有限公司,中国);ATP含量测试盒、乳酸含量测定试剂盒、乳酸脱氢酶含量测定试剂盒、丙酮酸激酶含量测定试剂盒、己糖激酶含量测定试剂盒(南京建成生物工程研究所,中国);RNA提取试剂盒、琼脂糖B、引物合成(上海生工生物工程有限公司,中国);cDNA逆转录试剂盒(赛默飞世尔公司,美国);2×Taq PCR MasterMix(天根生化科技(北京)有限公司,中国)。
1.1.3 仪器
CO2细胞培养箱(Thermo 3131,美国赛默飞世尔公司);多功能酶标仪(Thermo 3001,美国赛默飞世尔公司);倒置生物显微镜(BDS200-PH,重庆奥特光学仪器有限公司);化学发光检测成像系统(美国Ultra-Violet产品有限公司);PCR扩增仪(Bio-Rad);恒流恒压电泳仪(Bio-Rad)。
1.2 细胞培养及储备液配置
将小鼠黑色素瘤B16F10细胞与含有10%的血清和1%青霉素-链霉素混合溶液的DMEM低糖培养基在37 ℃,含5% CO2的细胞培养箱中孵育;5 mg的新狼毒素A(NCA)经92.75 μL二甲基亚砜(DMSO)溶解后配置成1×105μmol·L-1的NCA母液,放置于-20 ℃保存。实验中的DMSO终浓度均小于0.1%。
1.3 细胞活力测定
将对数生长期的B16F10细胞,经胰蛋白酶消化后以8 × 104个·mL-1接种于96孔板中,培养至细胞长到70%融合度后,吸出旧培养液,分别加入200 μL含NCA的培养基,至终浓度分别为0、10、20、30、40 μmol·L-1,于37 ℃继续培养24 h和48 h后,在每孔液面上加入50%(质量/体积) 的三氯乙酸(TCA)50 μL固定细胞(TCA的终浓度为10%),然后在4 ℃冰箱中放置1 h,培养板各孔用去离子水洗涤5遍,以去除TCA;空气中过夜干燥,随后每孔加0.4%的黄酰罗丹明B (SRB) 100 μL,室温下放置20 min,弃去各孔内液体(回收)后用1%乙酸洗涤5遍,去除未结合的染料,空气中干燥后加入150 μL DMSO(二甲基亚砜),在平板振荡器上振荡5 min,用Thermo 3001多功能酶标仪OD 490 nm测量各孔的吸光值[12]。按下式计算药物对细胞增殖的抑制率:
抑制率/%=
1.4 细胞划痕实验
用划痕实验检测NCA对肿瘤细胞迁移运动能力的影响[13],即收集对数生长期细胞,调整单细胞悬液浓度至1.0 × 105个·mL-1,接种于6孔培养板,至细胞长到70%融合度,以200 μL无菌吸头均匀划痕,用PBS轻轻洗去脱落的细胞,再于各组分别加入含不同浓度NCA的培养基,其终浓度分别为0、10、20、30、40 μmol·L-1,5% CO2,37 ℃培养箱孵育24 h至正常(control)组划痕基本愈合。用ZEISS倒置显微镜拍照并分析。采用Image-Pro plus软件分别测定各组划痕前后宽度,按照如下公式计算划痕愈合率。
划痕愈合率/%=
1.5 B16F10细胞中ATP含量测定
在肌酸激酶的催化作用下,三磷酸腺苷(ATP)与肌酸生成磷酸肌酸,磷酸肌酸又可用于ATP的再合成为细胞提供大量能量储备,维持细胞内的能量代谢,通过磷钼酸比色法在700 nm处测得磷酸肌酸的含量,以反映ATP的生成水平。
以此为原理,取对数生长细胞,制成细胞悬液,计数并调整细胞悬液的浓度为1.0 × 105个·mL-1,接种于在6孔板上,至细胞长到70%融合度,给予NCA使其终浓度分别为0、10、20、30、40 μmol·L-1,药物作用24 h后终止培养。离心处理将细胞和上清分离,收集下层细胞沉淀,在收集好的细胞中加入300-500 μL热双蒸水,置于热水浴(90~100 ℃)中匀浆破碎细胞,然后将细胞裂解液于沸水浴中加热10 min,取出混匀抽提(涡旋混匀)1 min,按照ATP含量测定试剂盒说明书指导进行混匀,室温静置5 min,在636 nm,0.5 cm光径,双蒸水调零,测定吸光度值,按照如下公式计算细胞中ATP的含量。
1.6 细胞乳酸(LD)含量测定
多数肿瘤细胞即使在氧气条件充足的情况下,仍然选择有氧糖酵解作为主要供能方式,其主要特征是葡萄糖消耗增加以及乳酸生成增多[3]。
当细胞培养至80%~90%融合度时,消化细胞后将B16F10细胞调整为1 × 105个·mL-1的密度接种于6孔培养板中,培养24 h后,吸弃旧培养基,加入不同浓度的含NCA的培养基,其终浓度分别为0、10、20、30、40 μmol·L-1,在5% CO2,37 ℃培养箱中孵育24 h。在乳酸测定过程中,乳酸脱氢酶能够催化乳酸产生丙酮酸,作为氢受体的NAD+转化为烟酰胺腺嘌呤二核苷酸(NADH)。
其中吩嗪硫酸甲酯(PMS)递氢使氯化硝基四氮唑蓝(NBT)还原为紫色呈色物,呈色物的在530 nm的吸光度与乳酸含量成线性关系,以此为原理,按照乳酸(Lactic acid)测定试剂盒说明书指导,进行乳酸含量测定,计算公式如下:
1.7 细胞培养液中葡萄糖(GOD)含量测定
当细胞培养至80%~90%融合度时,消化细胞后将B16F10细胞调整为1 × 105个·mL-1的密度接种于6孔培养板中,培养24 h后,吸弃旧培养基,加入不同浓度的含NCA的培养基,其终浓度分别为0、10、20、30、40 μmol·L-1,在5% CO2,37 ℃培养箱孵育24 h。根据著名的Trinder反应(Trinder,1969;Barham,1972),其原理为葡萄糖在葡萄糖氧化酶(GOD)作用下生成葡萄糖酸和过氧化氢(H2O2);过氧化物酶(POD)催化H2O2,色原物质生成红色醌亚胺类化合物,颜色的深浅与葡萄糖含量成正比。以葡萄糖氧化酶法检测试剂盒说明书为指导,测得葡萄糖含量,计算公式如下:

1.8 丙酮酸激酶(PK)的活性测定
丙酮酸激酶(PK)作为糖酵解途经中三个限速酶之一,在糖酵解中发挥了重要的作用[14]。PK催化磷酸烯醇式丙酮酸和ADP生成ATP和丙酮酸,乳酸脱氢酶进一步催化NADH和丙酮酸生成乳酸和NAD+,因此PK活力的大小在很大程度上反映了糖酵解的水平,通过在340 nm下测定NADH下降速率,即可反映PK活性。
以此为原理,收集对数生长期细胞,调整单细胞悬液浓度至1.0×105个·mL-1,接种于6孔培养板培养24 h后加入含不同浓度NCA的培养基,其终浓度分别为0、10、20、30、40 μmol·L-1,5% CO2,37 ℃培养箱孵育24 h后,按丙酮酸激酶(PK)测定试剂盒说明书的指导并根据下列PK活性的计算公式测得细胞中PK的活性。

1.9 己糖激酶(HK)的活性测定
作为糖酵解途径中限速酶的己糖激酶(HK),不仅可以在葡萄糖磷酸化过程中发挥作用,还能促进线粒体产生ATP,从而加速糖酵解进程[15],根据6-磷酸葡萄糖脱氢酶(G-6-PD)的偶联反应,在提供足量的底物条件下生成NADPH,通过在340 nm处测定吸光度,吸光度值的增加值可以反映己糖激酶(HK)的活性。
因此,使用己糖激酶(HK)测定试剂盒,收集对数生长期细胞,调整单细胞悬液浓度至1.0×105个·mL-1,接种于6孔培养板中培养24 h后加入含不同浓度NCA的培养基,其终浓度分别为0、10、20、30、40 μmol·L-1,5% CO2,37 ℃培养箱孵育24 h后,照说明书的指导及下列HK活性计算公式测得细胞中HK的活性。
1.10 乳酸脱氢酶(LDH)的活性测定
在糖酵解进程中,乳酸脱氢酶(LDH)的主要功能是催化生成乳酸,抑制其表达可有效地抑制肿瘤地发生发展,因此被广泛认为是用于治疗肿瘤的极具前景的靶点[14],而LDH在辅酶I的递氢作用下,使乳酸脱氢生成丙酮酸,NAD+还原成NADH引起了340 nm处吸光度值的改变。
以此为原理,收集对数生长期细胞,调整单细胞悬液浓度至1.0×105个·mL-1,接种于6孔培养板培养24 h后加入含不同浓度NCA的培养基,其终浓度分别为0、10、20、30、40 μmol·L-1,5% CO2,37 ℃培养箱孵育24 h后,按照乳酸脱氢酶(LDH)说明书指导处理各组份细胞,测得LDH酶活性,计算公式如下:

1.11 GLUT1、LDHA、PKM2、MMP-2、MMP-9、TIMP-1、TIMP-2的mRNA表达的测定
B16F10细胞经不同浓度的NCA(0、10、20、30、40 μmol·L-1)处理24 h后,加入1 mL Trizol分离核蛋白与核酸分离,参照UNIQ-10柱式总RNA提取试剂盒说明书指导提取细胞总RNA,测得RNA浓度后定量。
根据cDNA逆转录试剂盒的说明进行逆转录反应,得到逆转录产物cDNA,使用2×Taq PCR Master Mix将cDNA 在95 ℃预变性5 min,95 ℃变性30 s,根据引物的不同选择不同温度退火30 s,72 ℃延伸30 s,循环38次后于72 ℃延伸5 min,得到PCR产物,经琼脂糖凝胶电泳后,将其成像并在紫外线下成像、拍照,引物序列如表1所示。

表1 引物序列表
1.12 统计学分析
所有试验设3个平行组或重复3次,结果以平均值±标准偏差(Mean values ± SD)表示,以t检验进行组间统计学差异比较,以*P<0.05为差异具有显著统计学意义,**P<0.01为差异具有非常显著统计学意义。
2 结果
2.1 NCA抑制B16F10细胞增殖
NCA以不同浓度(0、10、20、30、40 μmol·L-1)分别作用于B16F10细胞24 h及48 h后,抑制率呈明显的量效关系。如图1所示:当药物干预24 h后,NCA在浓度为10 μmol·L-1时就能显著抑制B16F10细胞的增殖,并呈剂量依赖性和时间依赖性。(IC5024 h=28.60 μmol·L-1;IC5048 h=18.51 μmol·L-1)。
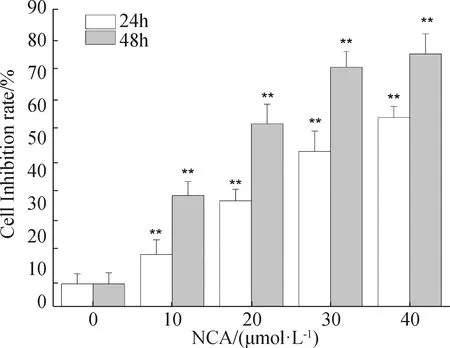
*P<0.05,**P<0.01。
2.2 NCA抑制B16F10细胞迁移
不同浓度NCA(0、10、20、30、40 μmol·L-1)处理24 h后,B16F10细胞愈合率随给药浓度增大显著下降,由此得出NCA可有效抑制细胞迁移且呈剂量依赖性(图2)。
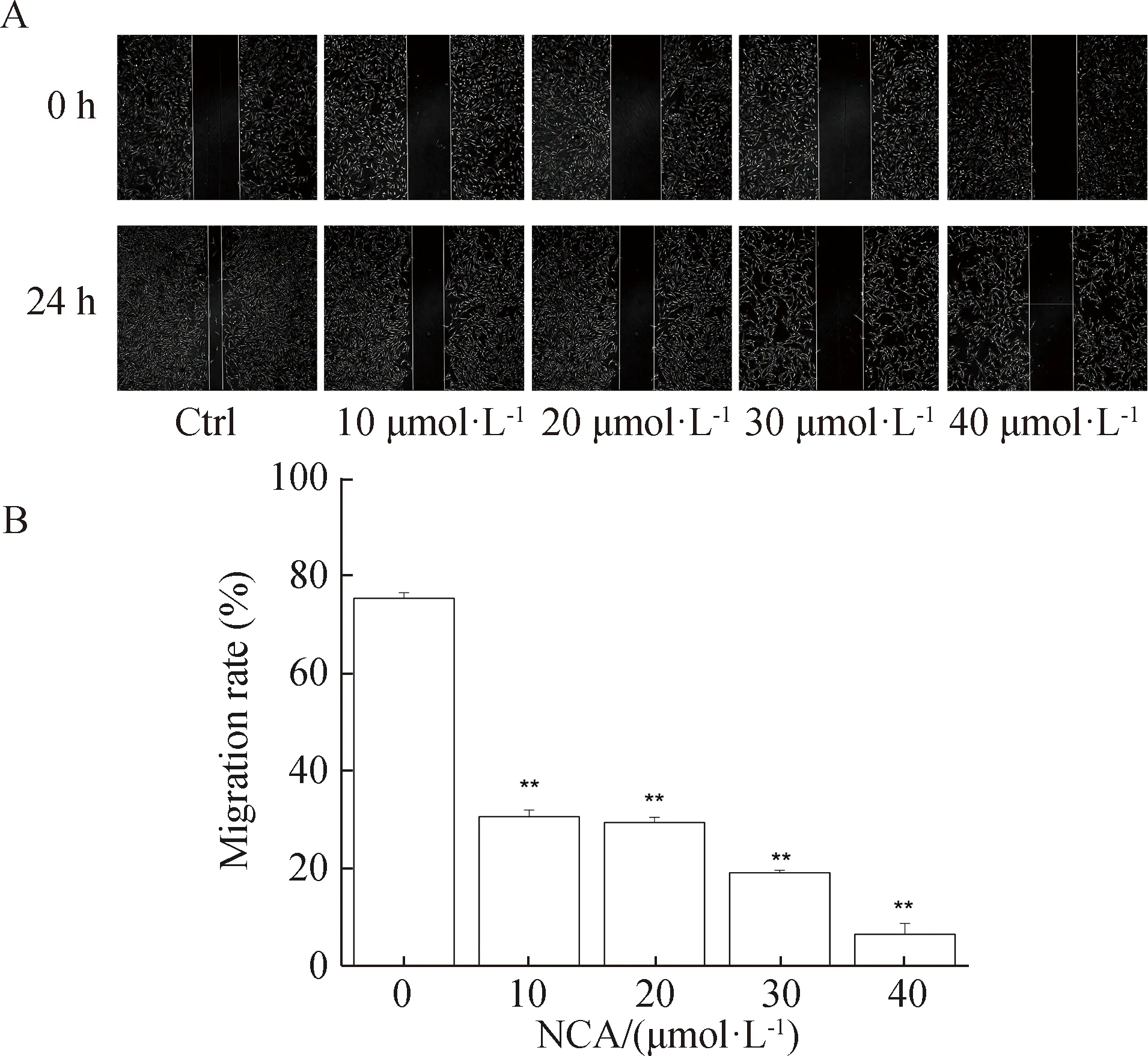
*P<0.05,**P<0.01。
2.3 NCA抑制B16F10细胞ATP的生成
不同浓度NCA(0、10、20、30、40 μmol·L-1)处理B16F10细胞24 h后,细胞中的ATP水平受到抑制,且随着NCA浓度的增大ATP水平逐渐降低,表明NCA降低了细胞ATP的水平(图3)。
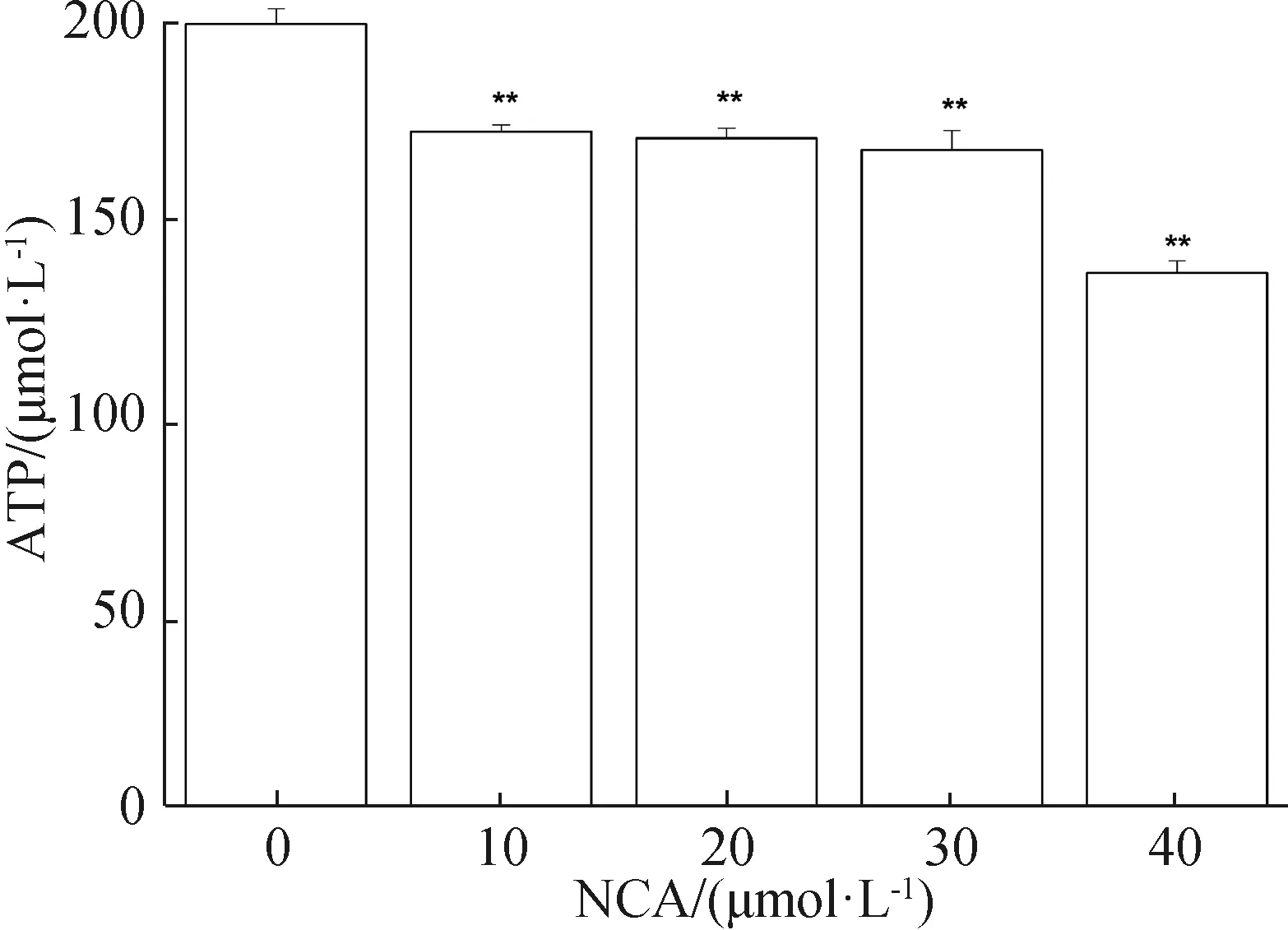
*P<0.05,**P<0.01。
2.4 NCA减少B16F10细胞乳酸生成
不同浓度的NCA(0、10、20、30、40 μmol·L-1)处理B16F10细胞24 h后,细胞培养液中的乳酸含量随着新NCA浓度的增大而减小,与对照组相比较,高浓度NCA(30 μmol·L-1和40 μmol·L-1)能够显著抑制B16F10细胞中乳酸生成(图4)。

*P<0.05,**P<0.01。
2.5 NCA减少B16F10细胞葡萄糖的摄取
不同浓度的NCA(0、10、20、30、40 μmol·L-1)作用于B16F10细胞24 h后,细胞培养液中葡萄糖含量随着NCA浓度的增大逐渐增多,细胞摄取葡萄糖的能力逐渐减弱,与对照组相比,NCA处理组具有显著性差异(图5)。
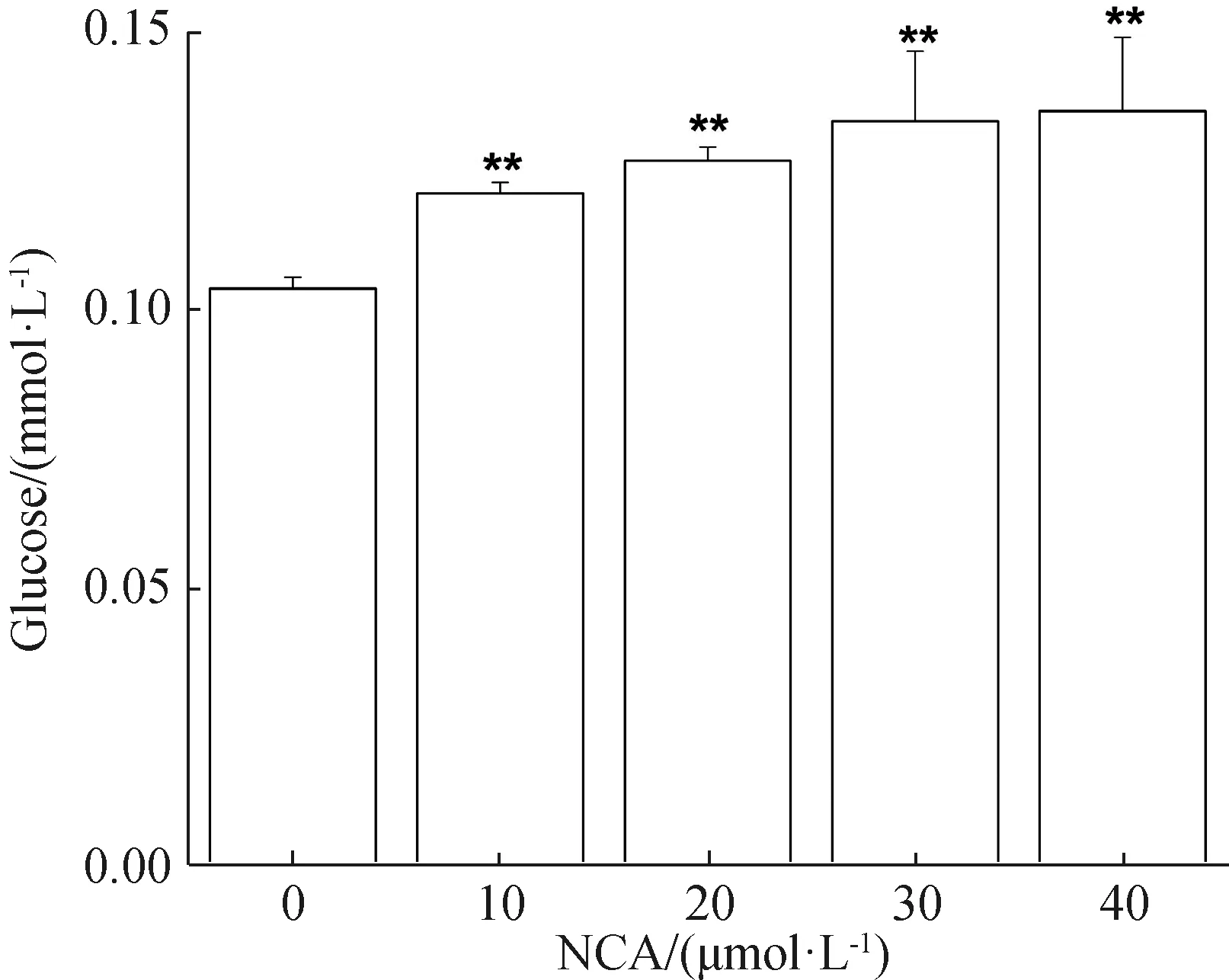
*P<0.05,**P<0.01。
2.6 NCA抑制己糖激酶(HK),丙酮酸激酶(PK)和乳酸脱氢酶(LDH)的活力
如图6所示,NCA干预B16F10细胞后,与对照组相比,NCA显著抑制了B16F10细胞内HK、PK、LDH的活力,表明NCA可能通过抑制糖酵解相关酶,下调了B16F10细胞内的糖酵解水平,从而抑制B16F10细胞的增殖和迁移。
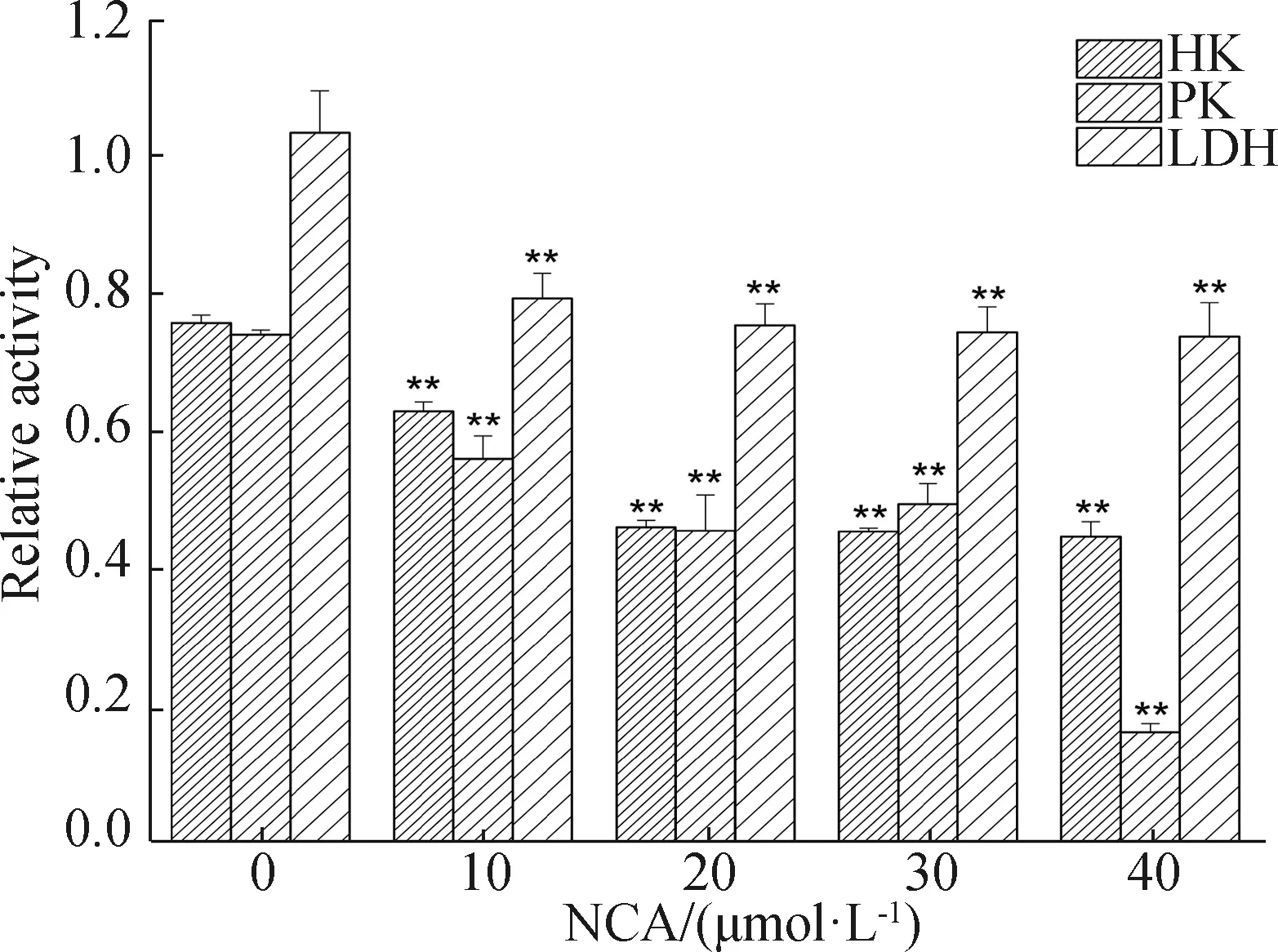
*P<0.05,**P<0.01。
2.7 NCA下调GLUT1、LDHA、PKM和MMP-2、MMP-9的表达,上调TIMP-1、TIMP-2 mRNA的表达
不同浓度的(0、10、20、30、40 μmol·L-1)NCA处理B16F10细胞24 h后,RT-PCR检测NCA对B16F0细胞GLUT1、LDHA、PKM和MMP-2、MMP-9、TIMP-1、TIMP-2 mRNA表达的影响,结果如图7所示,NCA能下调GLUT1、LDHA、PKM2和MMP-2、MMP-9的表达,上调抑制因子TIMP-1、TIMP-2的表达。
3 讨论
糖代谢的异常被认为是肿瘤的十大特征之一[15],获得足够的能量对肿瘤细胞生长增殖至关重要[16],早在上世纪20年代,德国科学家Warburg 发现,肿瘤细胞无论是否有氧气存在都主要依赖糖酵解进行代谢,大量消耗葡萄糖的同时并伴有乳酸的产生,这一现象称为“糖酵解或Warburg效应”[17]。糖酵解产生的大量乳酸维持了肿瘤细胞内酸性微环境,进而导致细胞基质的不稳定性,产生大量核酸前体,肿瘤细胞为逃避酸性的生存环境,便趋利避害的选择向正常的组织侵袭,从而助于肿瘤细胞的增殖、耐药、侵袭和转移[18-19],因此,抑制恶性肿瘤细胞糖酵解进程也可能是中药成分抑制肿瘤增殖迁移的机制之一。
NCA作为中药狼毒中具有较强抗肿瘤作用的有效成分[9],能以时间剂量依赖性的抑制黑色素瘤高转移细胞株B16F10细胞的增殖及划痕愈合;MMP-2和MMP-9作为基质金属蛋白酶家族的成员,在NCA的作用下表达水平下降,而抑制因子TIMP-1、TIMP-2的mRNA表达增强,说明B16F10细胞的转移能力减弱[20];肿瘤转移能力除了与细胞降解外基质的关键酶(如基质金属蛋白酶)有关,还与细胞上皮细胞间质转型(Epithelial-Mesenchymal Transition,EMT)密切相关[21],这提示我们,NCA对于B16F10细胞EMT具有抑制作用。
大量研究表明,EMT大多与高度活化的糖酵解进程相关从而促进肿瘤细胞的增殖与转移[19,21],如乳腺癌MCF-7细胞发生EMT后,GLUTI表达增强且葡萄糖摄取量增加[22];胰腺导管癌细胞发生EMT的同时伴随GLUTI和LDH的增加[20]。在高度活化的糖酵解过程中,肿瘤细胞依赖Warburg效应的根本机制就是对关键酶的调节,过量表达糖酵解途径的关键酶能够诱发Warburg效应[23]。本研究发现,当我们对B16F10细胞给与NCA处理时,B16F10细胞发生EMT抑制的同时GLUT1、LDHA及PKM2的表达减弱;细胞摄取葡萄糖的能力、乳酸生成量与ATP的水平均受到抑制;同时与其密切相关的关键酶(PK、HK、LDH)的活力抑制影响了B16F10细胞的Warburg效应,没有足够ATP的生成,肿瘤细胞增殖所需的核苷酸和脂肪酸生成减少[24],进而抑制B16F10细胞的增殖迁移。
综上所述,我们初步认为NCA对B16F10细胞增殖迁移的抑制作用可能与抑制糖酵解表型有一定的相关性。对于开发新药用于治疗黑色素瘤这样具有高度增殖、转移能力的肿瘤而言,探究其是否能够调控糖酵解途径具有十分重要的意义。然而仅仅通过调控糖酵解途径的某一个靶点并不足以抑制肿瘤细胞的生长增殖,研究NCA对于B16F10细胞糖酵解进程的目的在于从多个方面探究其作用机制从而更好的开发理想的靶向药物,相信在世界科技水平的不断提升及科研人员的不懈努力下,恶性肿瘤这个难题终将被攻克!

