影响生鲜乳β-内酰胺酶杯碟法检测因素的研究
屈雅莉,郭星,张影,肖淑珍,刘丽,刘文雅,张耀广,柴艳兵,李飞,李兴佳,刘志楠
(石家庄君乐宝乳业有限公司,石家庄050021)
0 引 言
抗生素应用带来经济增长的同时还带来细菌耐药性问题。当前,该问题已成为全球性危机[1-4],给公共卫生安全造成了很大威胁[5-9]。
β-内酰胺类抗生素具有杀菌性强、应用广泛等优点常被使用。如果饲养者滥用药物可造成牛乳中的残留,使用后会引起部分人过敏反应或产生耐药性,从而间接危害人体健康[10-12]。
目前国内外对生牛乳的β-内酰胺酶检测主要有高效液相色谱法、碘量法和杯碟法[13-15]。高效液相色谱法操作复杂检测成本高[16]。碘量法灵敏度差且不同样本重复性差。杯碟法灵敏度高,易操作,易判定。
本研究采用杯碟法检测生牛乳,实验中发现β-内酰胺酶标准品酶活力和供试平板的厚度影响实验结果的准确性;青霉素标准溶液应现配现用。
1 实 验
1.1 材料和设备
试剂:三级水,实验室自制;生理盐水(分析纯),天津市大茂化学试剂厂;磷酸盐缓冲液,北京陆桥技术有限责任公司。
实验菌种:藤黄微球菌(Micrococcus luteus)CMCC(B)28001第二代,CICC 10445第二代。
标准品:青霉素标准溶液(Dr)、β-内酰胺酶标准溶液(SIGMA、中国食品药品检定研究院)、舒巴坦标准溶液(Dr)。
培养基:营养琼脂培养基、抗生素检定培养基II(北京陆桥技术有限责任公司)。
仪器设备:生化培养箱36±1 ℃(BINDER),生物安全柜(ESCO)光度计 450 nm(赛默飞),pH 计(梅特勒-托利多仪器有限公司),移液器(Thermo),电子天平(梅特勒-托利多仪器有限公司),恒温水浴锅(上海一恒),游标卡尺,牛津杯,培养皿,离心管,陶瓦盖。
1.2 方法
依据NY/T 3313-2018《生乳中β-内酰胺酶的测定》对生乳进行测定,该方法检出限为4 U/mL,原理为:杯碟法是使用对青霉素类药物敏感的藤黄微球菌,利用舒巴坦特异性抑制β-内酰胺酶的活性,同时加入青霉素作对照,比对加入舒巴坦与未加入舒巴坦的样品产生的抑菌圈的大小来间接测定样品中是否含有β-内酰胺酶类药物[17]。
1.2.1 制备菌悬液优化
采用不同来源的标准菌株:藤黄微球菌(Micrococcus luteus)CMCC(B)28001 第二代和 CICC 10445 第二代分别接种于营养琼脂培养基斜面上,36±1 ℃培养18~24 h,分别记录菌形态,于生物安全柜内制备菌悬液。同时将以上菌悬液分别对50 组生鲜乳进行加标实验,该方法检出限为4 U/mL,所以采用检出限对不同菌株进行验证,选出该方法的最适菌株。
1.2.2β-内酰胺酶标准品制备优化
从市面选取常见的3 个不同品牌的β- 内酰胺酶标准品 (对青霉素敏感),标注分别为:≥8×106U/mL;≥6×106U/mL;≥3×106U/mL。选用3 个品牌标准品分别进行3 组加标实验,每组50 个样品,加标量分别为2,4,8 U/mL,计算加标结果,验证不同品牌β-内酰胺酶标准品对实验结果的影响。
1.2.3 青霉素标准溶液贮存条件优化
青霉素标准溶液制备完成后,分别选用现配现用,常温(20~25 ℃)贮存2,4,6,低温(0~8 ℃)贮存2,4,6,24 h 的青霉素标准溶液进行加标实验,加标量为4 U/mL,每组50 个样品本底,计算加标样品阳性检出率,验证青霉素标准溶液不同贮存条件对实验结果的影响,确定青霉素标准溶液贮存的最优条件。
1.2.4 检测平板制备优化
方法中要求添加藤黄微球菌的抗生素检定培养基II 倾注量约为15~20 mL,但试验中发现倾注较厚的平板易产生“双圈”现象,即在明显抑制圈与非抑制圈之间有一圈不清晰(浅色带)的抑菌圈,影响结果判定。本研究分为两组,一组供试检测平板倾注量约10~15 mL,另一组供试检测平板倾注量约20~25 mL。两组平板分别检测50 个加标样品(加标量4 U/mL),计算加标样品阳性检出率,同时观察平板抑菌圈形态,确定检测平板制备的最优化条件。
1.2.5 检测平板贮存条件优化
本文对供试检测平板制备完成后的贮存条件进行研究。选取在2~8 ℃贮存0,1,2,3,4 d 的供实检测平板进行加标实验,加标量为4 U/mL,每组50 个样品本底,计算加标样品阳性检出率,确定检测平板贮存最优条件。
2 结果与分析
2.1 制备菌悬液优化
采用不同来源标准菌株。藤黄微球菌(Micrococcus luteus)CMCC(B)28001第二代菌36±1 ℃培养20~24 h菌落大,菌苔厚,利于制备菌悬液。CICC 10445 第二代菌株生长较慢,36±1 ℃培养 18~20 h 菌苔较小、透明且薄,不利于菌悬液制备,若使用CICC 10445 作为实验菌株最好选用活化培养22~24 h 的菌苔制备菌悬液(见表1)。
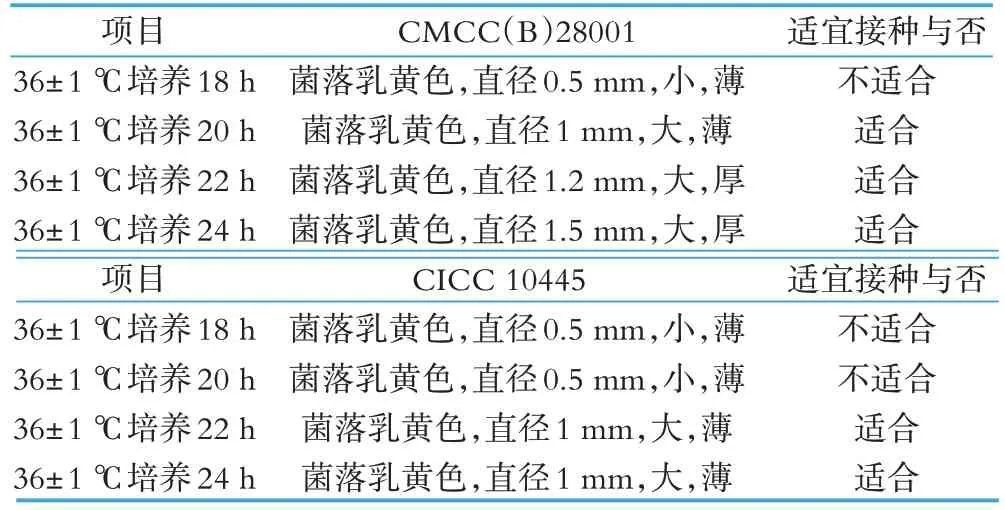
表1 不同来源标准菌株培养情况
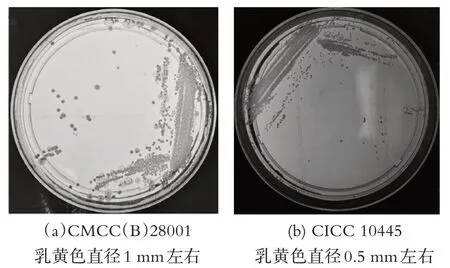
图1 两种来源标准菌株36±1 ℃培养20 h菌落形态
采用两种标准菌株进行加标实验,加标量为4 U/mL。使用CMCC(B)28001 第二代菌的实验组阳性检出率为100%,使用CICC 10445 第二代菌的实验组阳性检出率为100%。两种菌株的检出率一致,对加标实验结果无明显差异(见表2)。
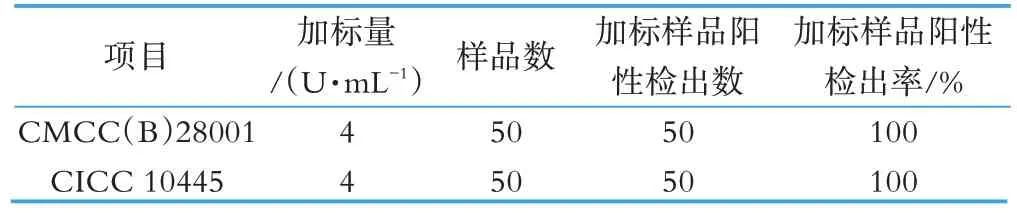
表2 采用不同来源标准菌株加标实验阳性检出情况
2.2 β-内酰胺酶标准品制备优化
采用3 个品牌对青霉素敏感的β-内酰胺酶标准品2 U/mL 加标实验(图2),其中品牌1 的β-内酰胺酶活力较高,72%的样品检出阳性,但后期排查的成本较高;4 U/mL(检出限)加标实验(图3),阳性检出率分别为100%,100%,84%;品牌1 和品牌2 漏检率0%,品牌3 漏检率为16%,采用品牌3 的β-内酰胺酶试验有很大漏检风险;8 U/mL 加标实验(图4),3 个品牌阳性检出率均为100%。
本研究的检出限为4 U/mL,采用品牌1 可满足方法要求,但有72%概率出现假阳性,会造成资源浪费;品牌2 可满足方法要求;品牌3 不能满足方法要求,有16%的漏检概率。采用不同品牌β-内酰胺酶标准品对实验结果的准确性有影响。

图2 3个品牌β-内酰胺酶标准品2 U/mL加标实验检出情况
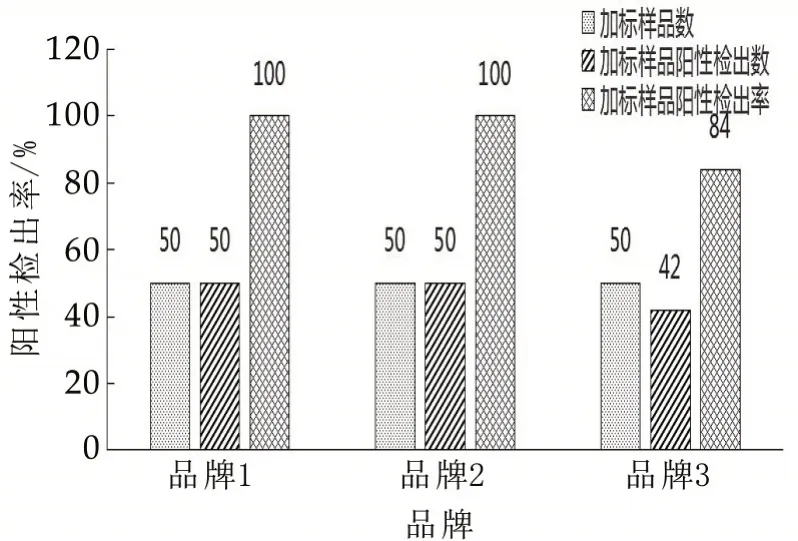
图3 3个品牌β-内酰胺酶标准品4 U/mL加标实验检出情况

图4 3个品牌β-内酰胺酶标准品8 U/mL加标实验检出情况
2.3 青霉素标准溶液贮存条件优化
采用低温(0~8 ℃)贮存不同时间的青霉素标准溶液进行实验,结果如图5 所示。由图5 可以看出,随着贮存时间延长,青霉素分解,加标样品阳性检出率逐步降低。低温贮存时间0~2 h 青霉素标准溶液阳性检出率为100%,漏检率0%;低温贮存时间>2 h,存在不同程度漏检的概率。本研究青霉素标准溶液配制完成后低温贮存时间最优为0~2 h。
采用常温(20~25 ℃)贮存不同时间的青霉素标准溶液进行实验,结果如图6 所示。由图6 可以看出,随着贮存时间延长,加标样品阳性检出率逐步降低。常温贮存时间0~6 h,存在不同程度漏检的概率。青霉素标准溶液配制完成应现配现用,不可常温贮存。

图5 青霉素标准溶液低温贮存不同时间检出情况

图6 青霉素标准溶液常温贮存不同时间检出情况
2.4 检测平板制备优化
采用倾注量为10~15 mL 的供试检测平板进行加标实验的阳性检出率为100%,加标实验检测平板抑菌圈边界清晰可见,易于判断结果(图7)。

图7 β-内酰胺酶检测平板抑菌圈形态
采用倾注量为20~25 mL 的供试检测平板进行加标实验,存在不同程度的漏检概率,主要是由于检测平板抑菌圈边界不清晰,且一部分出现“双圈”现象,且以外圈计和内圈计结果不一致,不易判断检测结果。本研究结果表明,供实检测平板的倾注量10~15 mL最优(见表3)。

表3 采用不同倾注量检测平板加标实验阳性检出情况
2.5 检测平板贮存条件优化
采用低温(2~8 ℃)贮存不同时间的供试检测平板进行加标试验,随着平板保存时间延长,阳性样品检出率降低。使用低温(2~8 ℃)贮存0~1 d 供试检测平板进行加标实验(加标量4 U/mL),阳性检出率为100%,使用低温(2~8 ℃)贮存2~4 d供试检测平板加标实验存在不同程度漏检的概率。本研究供实检测平板冷藏贮存的时间最优为0~1 d,建议现配现用(图8)。
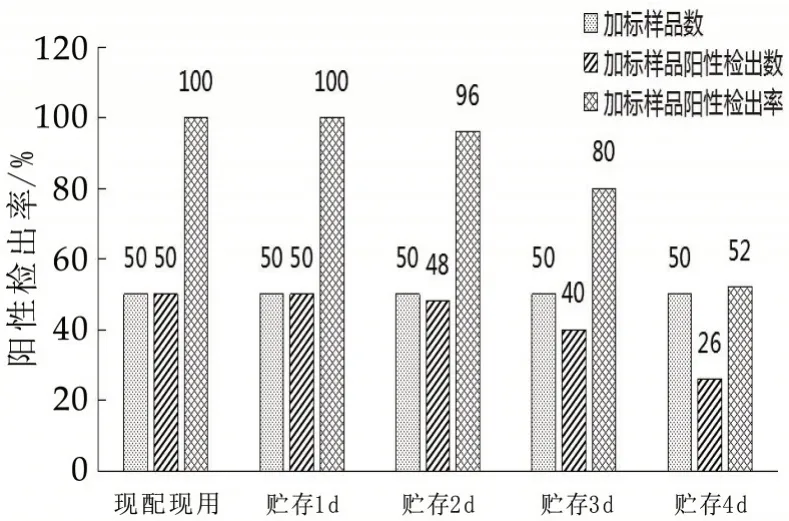
图8 采用不同贮存时间检测平板的检出情况
3 结果与讨论
用杯碟法检测β-内酰胺酶,主要是利用舒巴坦特异性抑制β-内酰胺酶的活性,并加入青霉素作为对照,通过比对抑菌圈的大小来间接测定样品中有无含有β-内酰胺酶类药物[18]。试验中菌株、β-内酰胺酶、青霉素等是试验中应注意的关键因素,把控其最优条件有利于提高试验的准确性[19-20]。
通过分析试验结果,采用藤黄微球菌(Micrococcus luteus)CMCC(B)28001 和 CICC 10445 作为实验菌株对实验结果准确性无明显影响,实验室可根据自身情况选择性购买标准菌株,但考虑到两种菌株的生长特性,藤黄微球菌(Micrococcus luteus)CMCC(B)28001 建议使用活化20~24 h 的培养物制备菌悬液,CICC 10445建议使用活化22~24 h的培养物制备菌悬液。
采用不同品牌β-内酰胺酶标准品对实验结果有较大影响,建议实验开展之前对β-内酰胺酶的酶活力进行实验,可采用检出限附近加标回收的方式验证其活力是否符合实验要求。
青霉素标准溶液随着贮存时间延长会逐步衰减,贮存温度越高衰减越快。此次试验结果显示青霉素标准溶液不可常温贮存,建议青霉素标准溶液配制完成后最好立即实验,若无法立即实验,应将青霉素标准溶液放置于冰水混合物中2 h完成实验。
供试检测平板的厚度对实验结果的判定有影响,偏厚的平板易产生“双圈”现象,本次试验显示检测平板的最优倾注量为10~15 mL,倾注的时候可以先倾注一部分含菌培养基至无菌平皿上,轻微旋转平板,使培养基流动平铺于整个无菌平皿上,可得到较薄测试平板。
供实检测平板最优现配现用,若配置较多平板或实验需求,在冰箱冷藏贮存1 d 可达同等效果。实验中注意:可待检测平板凝固后即刻放入2~8 ℃冰箱冷藏保存,若室温放置时间较长造成藤黄微球菌大量生长,则平板不可使用。

