膜蛋白基因与抗生素环境适应性的关联研究
张文羿,刘洋硕
(内蒙古农业大学乳品生物技术与工程教育部重点实验室,农业农村部奶制品加工重点实验室,呼和浩特010018)
0 引 言
益生菌是足量摄入后会在人体内定殖并对健康有益的一类活的微生物,它是通过改善和维持肠道微生物平衡来宿主产生有益影响,目前被广泛应用于食品、医药和工业等领域[1]。但是由于益生菌本身的特性,它在定殖于人体肠道之前往往会受到来自环境的胁迫,包括人体胃肠道中内源性物质的胁迫以及加工及贮藏过程的环境考验。内源性物质主要包括胃酸、胆盐等;而外界环境的胁迫主要为冷热胁迫、渗透压胁迫以及氧胁迫[2-3]。不仅如此,近些年兴起的抗生素也成为一种新的胁迫环境。由于抗生素滥用的现象非常普遍,在治疗胃肠道或者与感染相关的疾病时尤为严重,这会对人体肠道中的肠道菌群产生一定的影响,也会导致益生菌在进入人体之后无法发挥其本身的益生功能。因此,十分有必要研究益生菌在抗生素环境下的适应性机制。
基因敲除技术是根据同源重组的原理,构建带有同源序列的基因敲除载体,以电转化或者热转化的方式将其导入细胞,取代原始菌株上的等位基因,从而产生缺少目的基因的突变株,通过分析突变株的表型变化以及其与原始菌株的表型差异来确定目的基因的生物学功能,该技术是目前研究基因功能最有效的方法之一[4]。Cre/lox 位点特异性基因重组系统可以对转入的基因进行组织特异性和定点操作,对选取的目的基因进行整合性删除和条件性重组,这是基因敲除技术的关键组成部分[5]。该系统中主要涉及到的是Cre重组酶,其作用是介导两个LoxP位点间的重组[6]。
Lactobacillus plantarum P-8 源自自然发酵酸牛乳,具有调节血脂、维持微生态平衡的功能特性[7-9]。课题组前期采用蛋白质学技术建立了L. plantarum P-8 适应氨苄西林环境过程中的差异表达蛋白谱,结果发现膜蛋白基因(LBP_cg0719)与抗生素环境适应性密切相关。与原始菌株相比,膜蛋白基因在氨苄西林环境下适应性进化1600 代后的L. plantarum P-8 菌株中显著上调控。本研究为了进一步了解膜蛋白基因在L. plantarum P-8 适应氨苄西林环境中作用,采用Cre/lox 基因重组技术对膜蛋白基因的生物学功能进行了分析。
1 材料与方法
1.1 材料
(1)菌株和质粒
在氨苄西林环境下连续培养1600 代的抗生素菌株Lactobacillus plantarum P-8-A-1600[10],由内蒙古农业大学乳品生物技术与工程教育部重点实验室提供;Escherichia coli DH5α[11]购买于泽生生物技术有限公司;质粒pNZ5319[11]和质粒pMSPcre[12]分别由荷兰瓦格宁根大学和山东大学提供。
(2)所用试剂及配制溶液
高保真 DNA 聚合酶、Taq DNA 聚合酶、5× PCR Buffer、三磷酸碱基脱氧核苷酸(dNTPs)和核酸染料均购自北京全式金生物技术有限公司;限制性内切酶购自美国New England Biolabs 公司;T4 连接酶购自美国Beckman公司;红霉素和氯霉素购自美国Sigma公司。
溶液I:MRS液体培养基中添加0.75 mmol/L山梨醇和0.1%甘氨酸;溶液II:1 mmol/L蔗糖+3.5 mmol/L MgCl·26H2O,用于洗涤细胞。复苏液:MRS+10 mmol/L CaCl2+100 mmol/L MgCl2+0.75 mol/L 山梨醇。以上溶液均需要现配现用,使用之前在冰上预冷。
(3)所用培养基
MRS 培养基,用于 L. plantarum P-8 的增殖,生长条件为37 ℃静置培养。使用根据需要前添加红霉素或氯霉素,添加量根据提供的效价计算,需要将其配制成水溶液(浓度均为10 μg/mL)并进行滤菌操作,采用0.22 μm 的水系滤膜进行过滤。
LB 培养基,用于大肠杆菌的增殖,生产条件为37 ℃摇床培养。红绿霉素的添加方式与MRS培养基一致,红霉素终浓度为250 μg/mL,氯霉素为10 μg/mL。
(4)所用仪器
PCR 仪,购自美国 Applied Biosystems 公司;核酸电泳仪、UPV 凝胶成像系统和MicroPulser TM 电击仪,均购自美国Bio-Rad 公司;BT25S 分析天平,购自美国 Merrler Toledo 公司;5417R 离心机,购自德国Eppendorf 公司;DU800 分光光度计,购自美国Beckman公司。
1.2 引物设计
在NCBI数据库中查找L. plantarum P-8全基因组序列(CP005942.2)并找出 LBP_cg0719 基因序列,使用软件Primer premier 5.0 设计上下游同源臂引物,大小约为1 000 bp。引物合成由上海桑尼生物科技有限公司完成,具体引物名称以及序列如表1所示。

表1 引物基本信息
1.3 同源臂扩增
以L. plantarum P-8 基因组DNA 为模板,分别使用LBP_cg0719 的上下游同源臂引物进行PCR 扩增,得到长度约1000 bp 的上下游同源臂片段。PCR 反应的条件为:95 ℃预变性 5 min;95 ℃变性 1 min,58 ℃退火 1 min,72 ℃延伸 2 min,共 30 个循环;72 ℃终端延伸10 min;4 ℃保存。PCR 的反应体系为50 μL,各成分及相应体积如表2所示。

表2 PCR反应体系基本信息
1.4 构建敲除载体pNZ5319-0719 Up-Down
用限制性内切酶将同源臂上游片段插入pNZ5319 质粒的 XohI、PemI 酶切位点中,同源臂下游片段插入Eco53kI、BglII 酶切位点中。在42 ℃将质粒pNZ5319 的 DNA 转入 E.coli DH5α 感受态细胞中,吸取菌体细胞 100 μL 涂布于 10 μg/mL 的氯霉素 LB 固体平板,37 ℃培养48 h,筛选具有氯霉素抗性的载体pNZ5319-0719 Up-Down。用PCR 扩增验证结果,并将产物寄出测序,反应所用引物为0719 upF/85R 和87F/0719 downR。
1.5 感受态菌体细胞的制备
将抗生素菌株L. plantarum P-8-A-1600 活化2 代后接种到MRS 空白培养基中,放置在37 ℃培养箱中培养24 h。将菌液以2%的接种量接种到溶液I 中,37 ℃ 培养至其 OD600值在 0.3~0.6 之间时取出离心(6 000 rpm,4 ℃,5 min),弃掉上清液收集菌体。用1 mL 预冷的溶液II 重悬菌体,以相同条件离心,弃掉上清液收集菌体,重复洗涤3次。最后用40 μL预冷的溶液II重悬菌体,得到的菌液即为感受态菌体细胞。
1.6 敲除载体的电转化
无菌电转化杯置于冰上预冷10 min,加入40 μL预冷的感受态菌体细胞和1 μg 质粒DNA,吹打混匀后在冰上静置10 min。设置电击仪的使用参数:电容25 μF、电压1.7 kV、电阻200 Ω。将电转化杯快速擦干放入电击槽开始电转化。务必要确保杯身的干燥洁净,防止爆杯现象的发生。电转化后,在电转化杯中加入960 μL 预冷的复苏液,吹打混匀,在冰上静置5 min;之后将菌液转移至2 mL 无菌EP 管中37 ℃静置培养3 h,吸取100 μL 菌液涂布到含有氯霉素的MRS平板上,37 ℃培养48 h,长出的菌落即为转化子。
1.7 筛选双交换转化子L. plantarum P-8-A-1600-0719::lox66-P32-cat-lox71
挑取转化子单菌落,分别在含氯霉素10 μg/mL的MRS 液体培养基中活化24 h,随后接种在浓度均为10 μg/mL 红氯霉素双抗生素MRS 培养基中,筛选出具有氯霉素抗性且不具有红霉素抗性的双交换子,同时将抗生素菌株L. plantarum P-8-A-1600 分别接种于含仅氯霉素和仅含红霉素的MRS 培养基中作为对照组进行培养(红氯霉素浓度均为10 μg/mL)。将筛选到的双交换子、敲除载体以及抗生素菌株分别用引物(EryF/EryR、CatF/CatR、0719 upF/0719 downR)进行扩增,验证结果并寄样测序。
1.8 消除红霉素抗性基因并构建突变菌株L.plantarum P-8-A-1600-0719
将具有氯霉素抗性的双交换子电转到pMSPcre质粒中,电转化的过程及条件与上述一致,涂布在10 μg/mL红霉素的MRS固体平板上,37 ℃培养48 h。长出的菌落则为含有红霉素抗性的菌株,即带有pMSPcre 质粒的菌株。将其在MRS 液体培养基中连续传代使质粒pMSPcre 从菌株中丢失。为了验证突变株是否构建成功,将筛选到的突变株再次用LBP_cg0719 的同源臂引物进行PCR 扩增验证,所用引物为EryF/EryR、CatF/CatR和0719 upF/0719 downR,以连续传代前含有pMSPcre 质粒的菌株作为对照。如果PCR验证及测序结果均为正确,那么所得到的菌株即为突变菌株L. plantarum P-8-A-1600-0719。
1.9 突变菌株L. plantarum P-8-A-1600-0719 耐药表型分析
将突变菌株L. plantarum P-8-A-1600-0719 和抗生素菌株L. plantarum P-8-A-1600 分别接种在浓度为 4 μg/mL、8 μg/mL 和 16 μg/mL 的氨苄西林 MRS培养基以及不含氨苄西林的空白MRS 培养基中,37 ℃静置培养48 h,采用分光光度计测定不同菌株在波长为600 nm时的OD值。以抗生素菌株L. plantarum P-8-A-1600 的OD600值作为对照,从而分析突变株与抗生素菌株的耐药性表型。
2 结 果
2.1 敲除载体pNZ5319-0719 Up-Down的构建
在含有10 μg/mL 氯霉素的LB 平板上筛选具有抗性的菌株进行增殖培养,随后用PCR 反应进行验证。结果如图1 所示,泳道1 至泳道4 所用引物分别为 0719upF/0719upR、0719upF/85R、0719downF/0719downR 和 87F/0719downR。泳道 1 与泳道 2 相比,条带要低100 bp 左右;泳道3 和泳道4 相比,条带同样要低100 bp 左右。这是因为85R 的位点本身要比0719upR 靠后100 bp 左右,而87F 的位点要比0719downF 靠前约100 bp,所以导致载体片段大小发生变化,在胶图中显示为泳道2 和4 的条带比泳道1 和3 高约100 bp,由以上结果说明前后臂已经成功插入pNZ5319 质粒,且测序结果说明各序列均正确。由此可知,载体pNZ5319-0719 Up-Down成功构建。
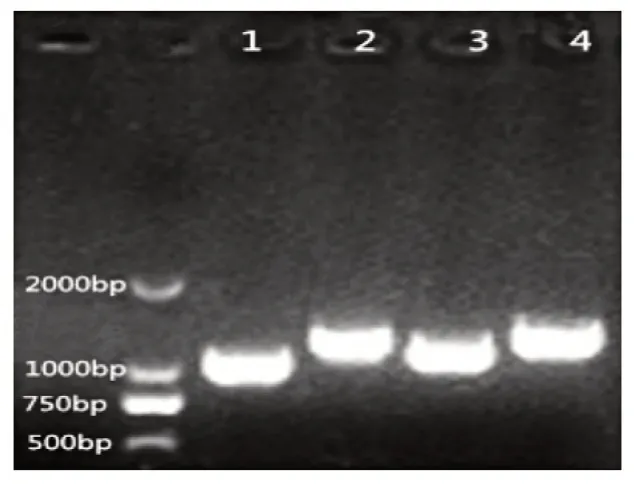
图1 敲除载体PCR方法验证
2.2 双交换子L. plantarum P-8-A-1600-0719::lox66-P32-cat-lox71的筛选
将敲除载体pNZ5319-0719 Up-Down电击转化到L. plantarum P-8-A-1600后,涂布于浓度均为10 μg/mL氯霉素和红霉素MRS 固体平板上,筛选出具有氯霉素抗性且不具有红霉素抗性的双交换子,即前后同源臂均进行交换的带有质粒的菌株。用引物0719 upF/0719 downR、EryF/EryR、CatF/CatR 进行验证,并以抗生素菌株L. plantarum P-8-A-1600 和质粒pNZ5319 作为对照。泳道1-3 所用引物为EryF/EryR;泳道4-6 所用引物为CatF/CatR;泳道7-9 所用引物为0719 upF/0719 downR。菌株顺序依次为抗生素菌株L. plantarum P-8-A-1600、质粒pNZ5319 和双交换子L. plantarum P-8-A-1600-0719::lox66-P32-cat-lox71。验证结果如图2 所示,因为pNZ5319 同时具有红霉素基因和氯霉素抗性基因而抗生素菌株和突变株均无红氯霉素抗性,所以泳道2 出现条带,而泳道 1 和 3 没有出现条带;L. plantarum P-8-A-1600 不含红霉素基因和氯霉素基因,因此泳道4 没有出现条带,而泳道5 和泳道6 均出现条带。因为抗生素菌株、质粒和突变株均含有LBP_cg0719 目的基因,所以泳道7-9 均有条带出现,而由于质粒pNZ5319 和双交换子L. plantarum P-8-A-1600-0719::lox66-P32-cat-lox71与L. plantarum P-8-A-1600 相比多了氯霉素抗性基因片段,因此其全长片段要大于L. plantarum P-8-A-1600,在胶图中显示为泳道7 的条带要比泳道8 和9 稍低。PCR 产物的测序结果显示各序列均正确。由此可知,已经成功地筛选到了双交换子。

表3 PCR所用菌株及引物

图2 双交换子PCR方法验证
2.3 突变株L. plantarum P-8-A-1600-0719的构建
将质粒pMSPcre 电转到筛选到的双交换子L. plantarum P-8-A-1600-0719::lox66-P32-cat-lox71中,涂布于浓度为10 μg/mL 红霉素的MRS 平板上,筛选出具有红霉素抗性而不具有氯霉素抗性的菌株,并在无抗生素的空白MRS 培养基中连续传10 代使pMSPcre 质粒丢失。用引物EryF/EryR、CatF/CatR和0719 upF/0719 downR 进行验证,以L. plantarum P-8-A-1600 和质粒 pMSPcre 作为对照。泳道 1-3 为L. plantarum P-8-A-1600、质粒 pMSPcre 和 L. plantarum P-8-A-1600-0719 用 EryF/EryR 为引物的 PCR产物,泳道4-6 所用引物为CatF/CatR,泳道7-9 是抗生素菌株、质粒和突变株用目的基因特异性引物0719 UpF/0719 DownR 进行PCR 得到的结果。验证结果如图3 所示,在L. plantarum P-8-A-1600-0719中均没有出现红霉素、氯霉素的基因,且L. plantarum P-8-A-1600中的前后臂比L. plantarum P-8-A-1600-0719 要长500 bp 左右。同时,测序结果也显示各序列都正确。因此,结果说明已经成功构建了突变株L.plantarum P-8-A-1600-0719。
2.4 突变株L. plantarum P-8-A-1600-0719 的耐药表型分析
对突变株L. plantarum P-8-A-1600-0719 进行氨苄西林耐药性表型分析,并且对其在不同氨苄西林浓度中的生长特性进行检测。以抗生素菌株L. plantarum P-8-A-1600 为对照,结果如图4 所示,突变株L.plantarum P-8-A-1600-0719 在正常培养基中生长时,和抗生素菌株相比,OD600值几乎没有差异。随着氨苄西林的浓度不断提高,抗生素菌株和突变株的OD600值同时呈现下降的趋势,但是两者之间的差距也在逐渐增加。当氨苄西林浓度增加到16 μg/mL时,突变株的OD600值约为抗生素菌株的2 倍。因此,由L. plantarum P-8-A-1600-0719 的耐药性表型可以推断,基因LBP_cg0719 与L. plantarum P-8 抗生素适应性菌株的耐药性相关。
表4 PCR反应所用菌株及引物

图3 突变株PCR方法验证
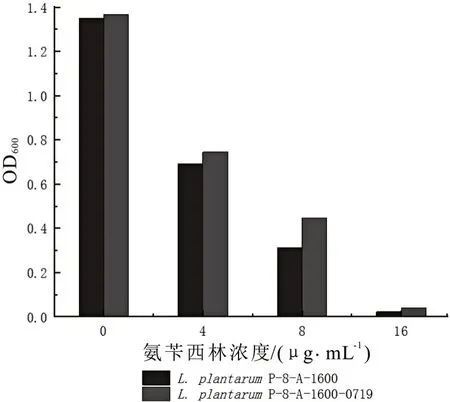
图4 抗生素菌株与突变株在添加不同浓度氨苄西林的LSM培养基中浊度的变化
3 结 论
本研究以实验室抗生素适应性进化性菌株为研究对象,为了进一步确认该基因的生物学功能,采用Cre-lox 基因敲除技术对目的基因LBP_cg0719 进行敲除实验,得到L. plantarum P-8-A-1600-0719 突变体菌株,并对其表型进行分析。研究结果显示敲除了LBP_cg0719 基因的突变体菌株在抗生素环境中的浊度更大,生长状况更加良好,相比于L. plantarum P-8-1600 具有更好的适应性。因此可以推测,LBP_cg0719 基因对L. plantarum P-8的耐药性具有一定的调节作用。

