四肢骨折延迟愈合患者血清miR-206、IGF-1、sICAM-1水平变化及诊断效能
周伟,黄松,魏优秀
华中科技大学同济医学院附属梨园医院,武汉 430000
骨折延迟愈合指骨折患者患处在正常愈合期(一般为4个月内)仍未达到骨折完全愈合的标准,骨折部位仍然有疼痛、压痛及异常活动,影像检查显示骨折线没有模糊,骨痂生长稀少。骨折延迟愈合是骨折患者治疗后的常见并发症,可明显延长患者病程,增加二次手术机会[1]。研究发现,年龄、营养、免疫、骨折类型、断端情况、血供、感染、骨质疏松、骨折情况等因素均可影响骨折处愈合。分子生物学认为,骨细胞的正常分化、增殖对骨折处的愈合起决定性作用,其中多种细胞因子、炎性因子、黏附分子等均参与了骨细胞的形成过程[2]。微小RNA-206(micro RNA-206,miR-206)是特异性表达于骨骼肌细胞miRNA家族成员,可调控骨骼肌细胞的生长、增殖、凋亡[3]。胰岛素样生长因子-1(insulin-like growth factor -1,IGF-1)是一种骨生成刺激因子,具有促使骨愈合和成骨细胞生成作用[4]。可溶性细胞间黏附分子(soluble intercellular cell adhesion molecule,sICAM-1)是细胞间、细胞和外基质间黏附分子,能促使白细胞黏附趋化,在骨折延迟愈合患者中呈高表达,经治疗后可出现下降[5]。目前,miR-206、IGF-1、sICAM-1在骨折延迟愈合中的作用机制尚不清楚。2017年5月~2019年10月,我们观察了四肢骨折患者血清miR-206表达及IGF-1、sICAM-1水平变化,分析骨折延迟愈合的影响因素,探讨其对骨折延迟愈合的诊断效能。
1 资料与方法
1.1 临床资料 选择同期我院骨科收治的骨折患者159例,纳入标准:①首次发生骨折患者;②骨折部位为四肢;③均为单侧骨折。排除标准:①骨代谢疾病、合并骨肿瘤者;②合并严重肝肾功能障碍者;③多发骨折或合并颅脑损伤者;④出院后失联未定期复查患者。本研究以书面形式向我院伦理委员会提出临床试验申请并获得批准,均获得患者及其家属同意,并签署同意书存档。
1.2 四肢骨折患者血清miR-206、IGF-1及sICAM-1、检测 分别于术前(T0)及术后第3天(T1)、第1周(T2)、第4周(T3)采集清晨静脉血5 mL。①miR-206检测 采用实时荧光PCR法。取不同时间的患者血清,TRIzol法提取总RNA,选择吸光度值A260 /A280 RNA样品,采用M-MLV 逆转录酶(Epicentre 公司)按照试剂盒说明将其转录为cDNA。CFX96实时荧光PCR 仪(美国Bio-Rad)检测血清中miR-206表达,引物合成及序列测定由上海基康公司完成,序列如下:miR-206上游引物:5′- ACGGTCCTCCTGGTCTTT-3′,下游引物5′- TGGCTGGCTGCATTGC-3′。以U6为内参,U6上游引物5′-CTCGCTTCG GCAGCACA-3′,下游引物5′-AACGCTTCACGAATTTGCGT-3′。反应条件:95 ℃变性10 s, 65 ℃退火20 s; 75 ℃延伸15 s,共40个循环。以U6为内参。以2-ΔΔCt代表miR-206的相对表达量。重复3次,取平均值。②血清IGF-1、sICAM-1检测 采用ELISA法。分别于术前(T0)、术后第3天(T1)、术后第1周(T2)、术后第4周(T3)采集,离心(4 ℃ ,3 000 r/min,离心时间15 min,离心半径10 cm)后取血清,-80 ℃超低温冰箱(Thermo Fisher公司)保存待检。取出样品快速解冻血清样品,ALISEI全自动酶标仪(意大利SEAC公司)采用ELISA法检测血清IGF-1、sICAM-1,试剂盒购自武汉博士德公司,所有操作均按试剂盒说明书进行。
1.3 资料收集方法 159患者均行手术(钢板内固定、髓内钉固定)固定骨折处,记录患者年龄、性别、骨折类型、损伤机制、合并疾病、骨质疏松、手术方式、术后负重时间等资料。术后3个月观察159例患者骨折愈合情况。骨折延迟愈合定义为骨折后≥3个月X 线示无或极少骨痂生成,断端骨质可见硬化、间隙[6]。术后3个月时,159例患者根据是否存在骨折延迟愈合分为骨折延迟愈合(延迟组)89例、骨折部位正常愈合(正常组)70例。骨质疏松按照2017版《原发性骨质疏松症诊疗指南》[7],将术后开始负重时间超过12周定义为术后负重延迟[8]。
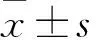
2 结果
2.1 不同时间点两组血清miR-206相对表达量及IGF-1、 sICAM-1水平比较 两组血清miR-206相对表达量及IGF-1、 sICAM-1水平比较见表1。

表1 不同时间点两组血清miR-206相对表达量及IGF-1、 sICAM-1水平比较
2.2 四肢骨折延迟愈合的影响因素 延迟组≥60岁比例、开放性骨折比例、骨质疏松比例、延迟负重比例高于正常组(P均<0.05),两组性别、损伤机制、多发伤、合并基础疾病、手术方式比较无统计学差异(P均>0.05)。
延迟组患者中年龄≥60岁50例、<60岁39例,男53例、女36例,正常组分别为24、46、46、24例。延迟组损伤类型为开放性骨折49例、闭合性骨折者40例,损伤机制为交通事故伤23例、高空坠落伤19例、跌倒31例、运动伤16例;正常组分别为21、49、20、17、27、6例。延迟组存在多发伤26例,合并基础疾病为高血压21例、糖尿病26例、冠心病24例,存在骨质疏松56例;正常组分别为21、19、18、21及26例。延迟组手术方式Wie钢板内固定术49例、髓内钉固定术40例,存在延迟负重37例;正常组分别为43、27及57例。
骨质疏松、开放性损伤类型、T3基线血清miR-206、IGF-1、sICAM-1是骨折延迟愈合的危险因素(P均<0.01),见表2。

表2 骨折延迟愈合的影响因素Logistic回归分析结果
2.4 血清miR-206、IGF-1、 sICAM-1水平及三者联合对骨折延迟愈合的诊断效能 T3基线时,当血清miR-206、IGF-1、sICAM-1诊断骨折延迟愈合的截断值分别为0.62、291.34 μg/L、202.43 ng/mL时,其诊断骨折延迟愈合的灵敏度分别为72.41%、79.31%、70.11%,特异度分别为72.86%、80.00%、84.29%,阳性预测值为76.83%、86.13%、77.22%,阴性预测值分别为68.00%、75.68%、66.67%,AUC分别为0.690(95%CI:0.606~0.773)、0.682(95%CI:0.596~0.767)、0.709(95%CI:0.626~0.793)。血清miR-206、IGF-1及sICAM-1联合诊断骨折延迟愈合的灵敏度、特异度、阳性预测值、阴性预测值分别为91.95%、91.43%、93.02%、90.14%,AUC为0.895(95%CI:0.837~0.95)。T3时刻血清miR-206、IGF-1及sICAM-1联合应用时AUC高于各指标单独应用时的AUC(z=3.021、3.162、2.615,P<0.05)。
3 讨论
骨折愈合机制复杂,主要包括血肿形成、原始骨痂形成、骨痂改建过程,骨细胞、间充质细胞能否正常增殖分化是骨折愈合决定性因素之一,但是除骨组织自身外,多种细胞和分子相互作用参与骨折愈合过程[2]。骨科医师应从细胞、分子水平了解骨折愈合机制,探讨骨折延迟愈合的原因,以早期发现骨折延迟愈合信息,更有效的采取针对性措施促使骨折正常愈合。
miR-206属于miR-1家族成员之一,在骨骼肌、成骨细胞中均有表达,参与骨细胞增殖、分化、凋亡调控,与骨骼系统疾病、恶性肿瘤形成均有关[9]。miR-206在骨折延迟愈合中的作用机制报道十分少见。本研究发现miR-206在延迟组表达较高,尤其是术后第1周、术后第4周,且术后第4周miR-206高表达与骨折延迟愈合相关,是导致骨折延迟愈合的危险因素之一。体外研究[10]显示,miR-206过表达通过抑制程序性细胞死亡4 (programmed cell death 4,PDCD4)、碱性磷酸酶(alkaline phosphatase,ALP)和B细胞淋巴瘤2 (B cell lymphoma 2,Bcl-2)表达,增加凋亡调节因子Bcl2-X相关蛋白(Bcl2 X associated protein,Bax)表达,降低骨细胞活力和增殖能力,诱导细胞凋亡。也有报道[11]显示,miR-206通过与其靶基因Cx43基因结合,抑制Cx43表达和功能,影响骨组织细胞间信号通路,降低成骨分化能力。提示miR-206可抑制成骨细胞分化,在骨折愈合过程中可能发挥抑制成骨细胞分化,骨形成作用。
IGF-1是一种分泌型小肽生长因子,具有调节生长激素、中间代谢、组织修复作用[12]。生长激素通过核因子κB受体激活剂、配体刺激骨保护素的产生以及在骨基质中蓄积,在维持骨代谢稳定方面发挥重要作用[13]。IGF-1作为调控生长激素的关键因子参与成骨细胞形成过程,在骨骼生长和骨折修复中起到重要的作用。本研究发现延迟组血清IGF-1水平低于正常组,说明IGF-1缺乏可能与骨折愈合有关,经回归分析证实低IGF-1水平是骨折延迟愈合的危险因素,提示骨折延迟愈合患者可能存在IGF-1 生成不足,导致骨细胞和软骨细胞增殖活性降低,骨形成障碍。IGF-1通过复杂的激素相互作用调控生长激素水平,增强成骨细胞活性,促使骨骼细胞有丝分裂和Ⅰ型胶原合成,并通过抑制胶原酶表达来减少骨胶原降解,刺激线性骨生长,激活骺软骨前细胞,达到促使骨细胞形成、骨愈合目的[14]。IGF-1缺失导致骨合成代谢障碍,导致骨吸收增加,骨量减少,给予IGF-1 可通过PI3K/AKT信号通路上调环氧化酶-2表达,逆转成骨抑制[15]。
sICAM-1是一类位于细胞表面介导细胞与细胞、细胞与细胞外基质黏附相互作用的糖蛋白,表达于内皮细胞、单核细胞和淋巴细胞等,在组织损伤修复、免疫应答、炎症反应中起到重要的作用[16]。现有研究显示骨折延迟愈合患者中血清sICAM-1水平处于较高水平[17],sICAM-1与骨不连的发生呈正相关[18]。本研究结果证实sICAM-1水平升高与骨折后延迟愈合有关,术后4周高水平sICAM-1是骨折延迟愈合的危险因素。ICAM-1参与骨折愈合机制为:骨组织结构损伤过程包含坏死、炎症反应、骨折修复等,涉及细胞外基质变化,骨折后sICAM-1表达升高介导细胞间、细胞与细胞外基质粘附,诱导中性粒细胞聚集,导致骨折端过度炎症反应,进而抑制成骨细胞增殖,诱导成骨细胞凋亡和软骨细胞损伤,导致骨折延迟愈合[19]。
本研究术后4周miR-206、IGF-1、sICAM-1水平与骨折延迟愈合关系最为密切,提示术后4周检测血清miR-206、IGF-1、sICAM-1水平有助于早期预测骨折愈合情况, ROC分析结果也证实术后4周miR-206、IGF-1、sICAM-1在骨折愈合诊断中均有一定应用价值,联合三项指标能提高预测准确性。本研究尚未检测4周后血清miR-206、IGF-1、sICAM-1水平,考虑临床影像学复查多在术后4、8、12周进行,随着检测时间延长可能导致过度诊断的可能,且不利于早期发现骨折愈合异常。本研究两组患者血清miR-206表达及IGF-1、sICAM-1水平在术前、术后第3天、术后1周已经出现差异,提示在骨折损伤早期延迟愈合患者体内miR-206、IGF-1、sICAM-1水平已经出现明显改变,因此应早期加强血清学检测,以发现高风险患者,采取针对性采取措施,促使骨折愈合。Logistic回归分析结果显示骨质疏松、损伤类型也与骨折延迟愈合有关,骨质疏松患者多伴骨代谢异常,骨形成缓慢,骨量减少,伴骨质疏松患者骨折部愈合缓慢,甚至可能出现不愈合[20]。不同骨折类型影响骨折愈合进程,开放性骨折多伴软组织损伤,影响骨折端血供和营养供给,可延迟骨折愈合进程。
综上所述,骨折延迟愈合患者血清miR-206表达、sICAM-1水平升高,IGF-1水平降低,术后4周血清高miR-206表达、sICAM-1水平及低IGF-1水平可能与骨折愈合发生密切相关,血清miR-206表达、sICAM-1及IGF-1水平诊断骨折延迟愈合的灵敏度、特异度均较高,可作为生物学标志物用于骨折延迟愈合的诊断。临床应结合骨折愈合危险因素,对延迟愈合患者进行合理准确的评估,以最大程度降低骨折延迟愈合发生率。

