丰富证据推理途径 建构认知思维模型——以几道电解质溶液问题的分析为例
湖南 李银秀 福建 胡 娟
有关电解质溶液的选择题是高考的高频题型,重点在于考查化学平衡理论,渗透对变化观念与平衡思想及证据推理与模型认知核心素养的考查。证据推理与模型认知核心素养的具体内涵是能从宏观和微观、定性与定量结合上收集证据,从不同视角分析推出合理结论;能描述和表示常见理论模型,指出模型表示的具体含义;能对模型和原型的关系进行评价并改进模型;能说明模型使用条件及适用范围;能依据各类物质及其反应的特征寻找证据,解释证据和结论之间的关系;能对复杂问题情境中的关键要素进行分析建构相应模型;能选择不同模型综合解释或解决复杂的化学问题。“素养立意”的化学命题非常注重对学生“证据推理与模型认知”素养的考查,本文以几道有关电解质溶液的选择题分析为例,试图丰富证据推理途径,建构认知模型,突破教学中的难点问题,消除迷思概念。
【例1】(2020·山东卷模拟·14)25℃时,向10 mL 0.10 mol/L 的一元弱酸HA(Ka=1.0×10-3)中逐滴加入0.10 mol/L NaOH溶液,溶液pH随加入NaOH溶液体积的变化关系如图所示。下列说法正确的是
( )
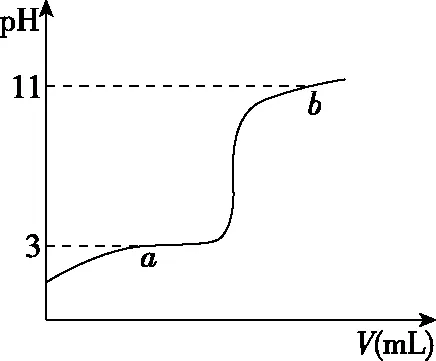
A.a点时,c(HA)+c(OH-)=c(Na+)+c(H+)
B.溶液在a点和b点时水的电离程度相同
C.b点时,c(Na+)=c(HA)+c(A-)+c(OH-)
D.V=10 mL时,c(Na+)>c(A-)>c(H+)>c(HA)
【解析】山东省是第二批进入新高考改革的省区,该套模拟题是很多专家集体智慧的结晶,经过了教育部考试中心的审核,试题质量很高,很好地体现了《普通高中化学课程标准(2017年版)》的内容要求和学业要求,凸显核心素养的立意。做好试题分析,对日常教学复习有重要意义。
该题创设强碱滴定弱酸溶液过程中pH变化的真实情境,考查考生接受、吸收、整合化学信息的能力,以及分析和解决化学问题的能力。试题巧妙利用图象提供多种信息,可用于选项中的相应问题的解答,体现了证据推理与模型认知的学科核心素养。例如选项B需要利用“影响水的电离的因素”,结合图象中a点和b点分别位于滴定突跃前后的信息进行分析推理。
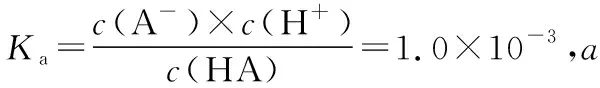

B项分析方法二:a点时的溶质为HA、NaA,pH=3,b点时的溶质为NaOH、NaA,pH=11,故a、b两点的溶液可看作是向NaA溶液中分别滴加HA溶液与NaOH溶液得到的。H+浓度相等的HA溶液与OH-相等的NaOH溶液对水电离的抑制程度相同,故可推知若向等量的NaA溶液中分别滴加HA溶液、NaOH溶液,得到pH=3的NaA、HA的混合溶液和pH=11的NaA、NaOH的混合溶液,则溶液在a点和b点时水的电离程度相同。但a点时HA未被完全中和,b点时NaOH过量,a点与b点比较,NaA的量显然后者多,故假设不成立,B项错误。以上快捷分析启示我们,遇到问题要善于运用转化思想,即跳出问题看问题,可以化难为易。
值得注意的是,多个教研微信群、QQ群及公众号上传的资料中分享了下面这种看似简便易行的分析过程,那么推断是否合理?
a点时的溶质为HA、NaA,pH=3,水电离出的c水(OH-)=c(OH-)=1.0×10-11mol/L。b点时的溶质为NaOH、NaA,pH=11,c(OH-)=1.0×10-3mol/L,OH-是由NaOH电离和水电离出的两部分之和组成的,推断出由水电离出的c水(OH-)
C项分析方法一:b点处的溶质为NaA和NaOH,据电荷守恒可知:c(A-)+c(OH-)=c(Na+)+c(H+),则c(Na+) C项分析方法二:b点的溶质为NaA和NaOH,据电荷守恒可知:c(Na+)+c(H+)=c(A-)+c(OH-),假设C项正确,c(Na+)=c(HA)+c(A-)+c(OH-)代入上式,可得:c(HA)+c(A-)+c(OH-)+c(H+)=c(A-)+c(OH-),进而得到c(HA)+c(H+)=0,这与客观事实不符,C项错误。 B项分析方法一重在证实,分析过程严谨,能帮助学生深刻理解不仅a、b两点水的电离程度不同,而且b点水的电离程度比a点的大;分析方法二重在证伪,分析视角独特简洁,有利于学生快捷判断。C项分析方法一也重在证实,采用常规方法,学生容易想到;分析方法二重在证伪,巧妙借助了数学反证法,让学生深刻理解题中所示关系必然不成立。B项和C项均采用两种不同方法分析,能帮助学生深刻理解相关微粒浓度大小的必然关系,提升对证据推理的理解和运用能力。日常教学中启发学生从多种角度思考,能培养学生思维的全面性、深刻性和敏捷性,感受思维的魅力,享受思维的快乐。 那么,D项的分析能否采用快捷方法?电解质溶于水会有很多行为,首先是电解质的电离,其次是电解质产生次级微粒的行为,有的次级微粒发生电离,有的次级微粒发生水解,还有的次级微粒发生质子自递。基于此,要快速比较电解质溶液中微粒浓度大小,可理清行为主次,采用“抓主略次”的思路快速判断。 V=10 mL时,NaOH与HA恰好完全中和,且NaA浓度为0.05 mol/L。0.05 mol/L NaA溶液中各微粒浓度行为及程度如下: 前面定量计算的意义在于消除学生对用近似方法分析可能产生的疑虑,从而在更多类似问题的解决中敢于大胆采用近似的模型分析方法进行分析比较,这与“用人不疑、疑人不用”的道理一样。 通过以上分析不难得到结论,对于水溶液中微粒浓度关系的分析,可以建构如下思维模型。 值得注意的是,有部分教师认为B项也正确,下面试图分析产生这一错误认识的原因。 【例2】(2013·山东卷·13)某温度下,向一定体积0.1 mol/L 的醋酸溶液中逐滴加入等浓度的NaOH溶液,溶液中pOH[pOH=-lg(OH-)]与pH的变化关系如图所示,则 ( ) A.M点所示溶液的导电能力强于Q点 B.N点所示溶液中c(CH3COO-)>c(Na+) C.M点和N点所示溶液中水的电离程度相同 D.Q点消耗NaOH溶液的体积等于醋酸溶液的体积 所有知名品牌的教辅用书及各大网站给出了几乎一样的分析,现摘录如下: 【解析】据图可知Q点pH=pOH,溶液呈中性,M点溶液呈酸性,N点溶液呈碱性,A中M点到Q点溶液主要是弱酸变为盐,因此导电能力增强,错误;B中N点溶液c(OH-)>c(H+),根据电荷守恒可知,c(CH3COO-) 上述对A、B、D项的分析是可行的,对C项的分析是基于M点pOH与N点pH相同,M点电离的c(H+)与N点电离的c(OH-)相等,就得出这两点水的电离抑制程度相同的结论。由例1分析可知,要得出该结论,要求这两点含有等量的CH3COONa,但这一假设不成立。可见,该题的科学性值得商榷。 高考真题因集中体现了命题专家的智慧,往往成为广大教师选题以及命制模拟题的重要依据。例如,例3就是由例2改编而成。 【例3】(2017·河南南阳等六市联考·13)某温度下,向一定体积0.1 mol/L的氨水中逐滴加入等浓度的盐酸,溶液中pOH=-lg[c(OH-)]。下列说法不正确的是 ( ) A.M点和N点H2O的电离程度相同 C.M点溶液的导电性小于Q点溶液的导电性 该题给出的参考答案是B项,根据前面分析,A项也是错误的。 通过本文分析可知,在遇到较为复杂问题时,可以丰富证据推理途径,建构认知思维模型,使学生更好地理解电解质溶液中有关微粒浓度的关系,突破教学难点,提升快捷思考与解决问题的能力,同时消除迷思概念,提升证据推理能力,发展学生的核心素养。同时尽量杜绝使用科学性有待加强的试题进行训练,减少对学生思维的负面干扰,提高复习备考的实效。











