中学化学常见反应顺序问题
上海 樊亚军
中学化学涉及的化学反应纷繁复杂,物质混合体系中的化学反应往往包括很多具体的反应。分析清楚化学反应进行的先后顺序对解决混合体系中的化学反应问题很有帮助,有助于将复杂问题简单化。以下是几种中学化学常见的与化学反应顺序有关的问题:
一、与氧化还原反应有关的顺序
【例1】(2016·江西新干模拟)在FeCl3、CuCl2、FeCl2的混合溶液中,Fe3+、Cu2+、Fe2+的物质的量浓度之比为4∶2∶1,现加入适量的铁粉,使溶液中三种离子的物质的量浓度之比为1∶3∶9,则投入的铁粉与原溶液中Cu2+的物质的量之比为
( )
A.5∶4 B.4∶5 C.3∶5 D.5∶6
【答案】D

【备考提示】与氧化还原反应有关的顺序问题,需要首先找到体系中所有涉及的化学反应,再依据不同的氧化剂(或还原剂)强弱进行排序,依据反应强先于弱进行的原则,分清楚体系中所有化学反应进行的先后顺序,然后按照步骤依次进行计算。
【例2】(2017·吉林高考模拟)向含有Fe2+、I-、Br-的溶液中通入适量氯气,溶液中各种离子的物质的量变化如图1所示。有关说法正确的是
( )

图1
A.线段BC代表Cl-数目的变化情况
B.原混合溶液中c(FeBr2)=6 mol/L

D.原溶液中n(Fe2+)∶n(I-)∶n(Br-)=2∶1∶3
【答案】CD

二、酸与盐的反应顺序
【例3】(2019·陕西西安期末)向四只盛有一定量NaOH溶液的烧杯中通入不同量的CO2气体后,在所得溶液中逐滴加入盐酸至过量,并将溶液加热,产生的气体与加入盐酸的物质的量的关系如图2所示:

Ⅰ

Ⅱ
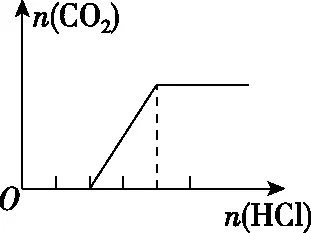
Ⅲ

Ⅳ
则下列分析都正确的组合是
( )
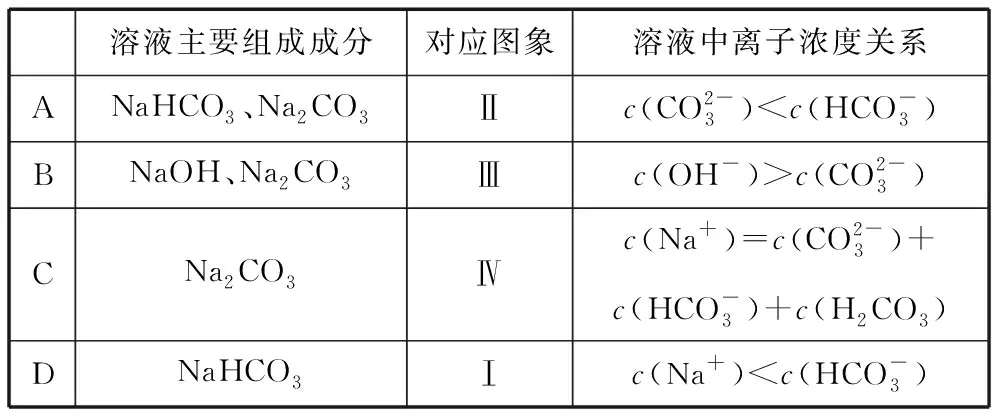
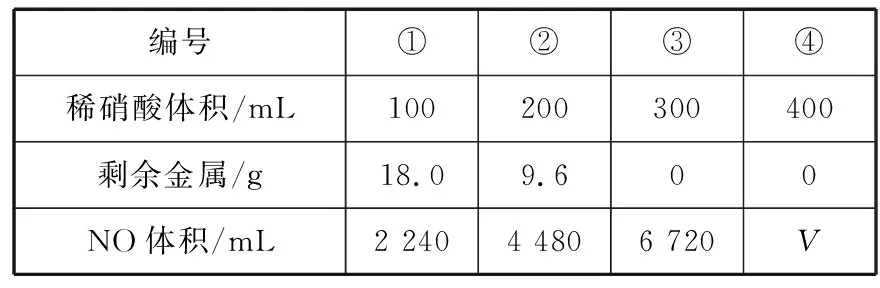
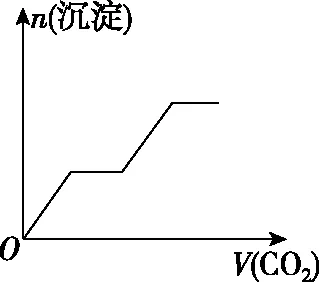
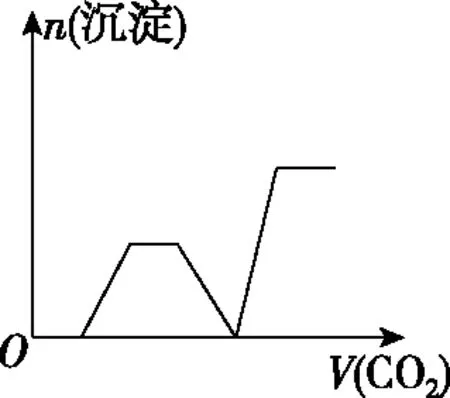
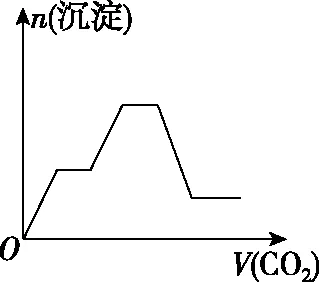
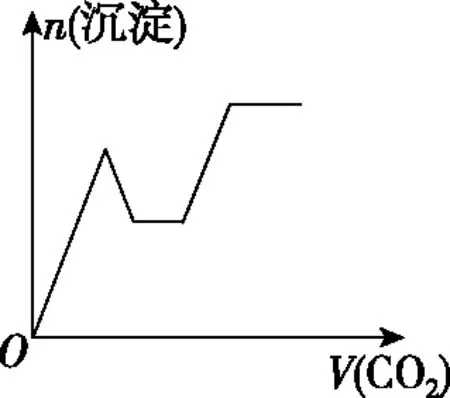
溶液主要组成成分对应图象溶液中离子浓度关系ANaHCO3、Na2CO3Ⅱc(CO2-3) 【答案】A 备考提示:酸与盐反应的体系中往往会涉及与碱的反应,在判断反应顺序时,首先要从离子反应角度,H+先与OH-反应,再与酸根离子反应,如果是多元酸根离子,还需要从“强酸制弱酸”的角度分步进行反应。 【例4】(2019·江西赣州质检)已知HX为一元弱酸。某混合溶液中含有4 mol NaX、2 mol Na2CO3和1 mol NaHCO3。往溶液中通入3 mol CO2气体,充分反应后,气体全部被吸收,所得溶液中钠盐的量可能为 ( ) 选项NaXNa2CO3NaHCO3A0 mol3 mol3 molB1 mol2 mol4 molC2 mol1 mol5 molD3 mol0 mol6 mol 【答案】D 【例5】(2019·河南南阳月考,不定项选择)某铜铁合金中铜和铁的物质的量之和为ymol,其中Cu的物质的量分数为a,将其全部投入50 mLbmol·L-1的稀硝酸溶液中,加热使其充分反应(假设NO是唯一的还原产物)。下列说法正确的是 ( ) A.若金属有剩余,在溶液中再滴入硫酸后,金属又开始溶解 B.若金属全部溶解,则溶液中一定含有Fe3+ C.若金属全部溶解,且产生336 mL气体(标准状况),则b=0.3 【答案】AD 【例6】(2019·吉林白城模拟)铁粉和铜粉的均匀混合物,平均分成四等份,分别加入同浓度的稀硝酸,充分反应,在标准状况下生成NO的体积和剩余金属的质量如表1所示(设硝酸的还原产物只有NO): 编号①②③④稀硝酸体积/mL100200300400剩余金属/g18.09.600NO体积/mL2 2404 4806 720V 下列计算结果正确的是 ( ) A.①中溶解了5.6 g Fe B.硝酸的浓度为4 mol/L C.②中溶解了9.6 g Cu D.④中V=8960 【答案】BD 【例7】(2018·天津期末)将足量的CO2不断通入KOH、Ba(OH)2、KAlO2的混合溶液中,生成沉淀与通入CO2的量的关系可表示为 ( ) A B C D 【答案】C 【备考提示】这类题目中,往往涉及二氧化碳与两种碱反应,生成一种碳酸盐可溶,一种碳酸盐难溶,可以依据先生成沉淀后不生成沉淀,先与溶质反应后与沉淀反应,先与碱反应后与碳酸盐的顺序,可以将反应分为四步。以氢氧化钾和氢氧化钡的混合溶液为例:1.二氧化碳与氢氧化钡生成碳酸钡;2.二氧化碳与氢氧化钾生成碳酸钾;3.二氧化碳与碳酸钾生成碳酸氢钾;4.二氧化碳与碳酸钡生成碳酸氢钡。借助反应顺序再对图象进行分析,就容易理解图象。 【例8】(2019·江苏无锡期末)将16.8 g的NaHCO3受热分解后所产生的CO2气体和水蒸气全部通过装有一定量的Na2O2的密闭容器后,充分反应,最后固体质量增加2.9 g,密闭容器内所装Na2O2的物质的量为________。 【答案】0.15 mol 【备考提示】二氧化碳、水蒸气都能与过氧化钠反应,由于水蒸气与过氧化钠反应的产物氢氧化钠还能与二氧化碳反应,因此,可以假设为二氧化碳先于过氧化钠反应,剩余的过氧化钠再与水蒸气反应,这样可以简化问题的分析。 中学化学中涉及与化学反应顺序有关的化学问题很多,虽然在近几年高考试题中不多见,但是梳理清楚化学反应发生的先后顺序,对理解中学化学很多问题很有帮助。分析具体与反应顺序有关的问题时,要首先分析出体系中所有涉及的化学反应,再根据某方面对化学反应进行排序,有可能是依据氧化性、还原性强弱,有可能是依据溶液中离子反应总是向着离子浓度减小的方向进行,有可能某一特殊类型的反应,为了简化计算和理解,人为对反应设定一个顺序,总之,只要合理,一个按照某种顺序进行的化学反应是有助于中学阶段的化学学习的。
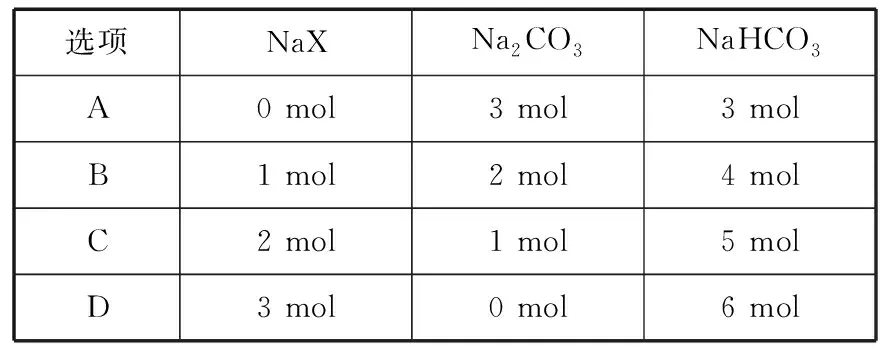

三、铁、铜与硝酸的反应顺序




四、二氧化碳与碱的反应顺序

五、CO2、H2O与Na2O2的反应顺序


