定量突破《难溶电解质的溶解平衡》复习中的若干疑惑点
陕西 葛秋萍 李歆瑞
难溶电解质的溶解平衡是化学平衡的延续,是用化学平衡理论来解释化工生产过程中沉淀的生成、溶解或转化等问题。从实际教学来看,学生从开始学习到高三复习,一些常见错误重复出现,难以纠正过来。究其原因,化工生产中的实际现象及结论与学生的“前概念”认知发生了较大的冲突,出现了知识负迁移,使学生难以从定性的角度思考和理解这些问题。为此,在高三复习时,教师不妨换一个角度来复习,引导学生从定量的角度探析《难溶电解质的溶解平衡》这部分知识中的一些疑惑点,揭示实际现象或结论的本质和规律,提高学生的认知能力,真正促使学生的“前概念”发生转变。
一、沉淀的生成
【例1】在学习盐酸的化学性质时,小明和小芳两位同学分别做了碳酸钠溶液和稀盐酸反应的化学实验(如图)。
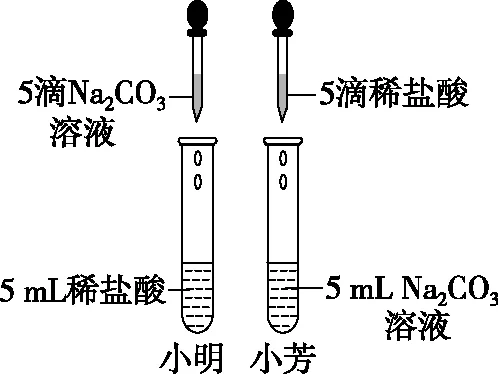
小明的实验中有气泡冒出,小芳的实验中无气泡冒出,对此现象,两位同学进行了如下探究:
【提出问题】小芳的实验中为什么没有明显现象?

②碳酸氢钠与氯化钙溶液混合不发生反应;而碳酸钠溶液与氯化钙溶液反应生成沉淀。
【设计实验】证明小芳实验的溶液中含有碳酸氢钠。

实验步骤实验现象实验结论①取上述溶液少量于试管中,加入足量(写化学式)溶液产生白色沉淀②取步骤①所得上层清液少量,滴加小芳实验的溶液中含有碳酸氢钠
写出步骤①反应的化学方程式:_________________
【实验反思】
(1)Na2CO3和盐酸反应的生成物受盐酸量的影响,稀盐酸________(填“过量”或“不足”)时才有气泡冒出。
(2)由此可见,当反应物的量不同时,产物可能不同,试另举一例来说明:_________________
【拓展延伸】
(3)欲鉴定某敞口试剂瓶中氢氧化钠溶液是否变质,甲同学取5 mL该液体,滴加少量稀盐酸,发现无气泡冒出,由此得出氢氧化钠溶液没有变质的结论。他的结论是否可靠?________(填“可靠”或“不可靠”)。
【查阅资料】氢氧化钠溶液和氯化钙溶液混合,会产生白色沉淀(浓度较大时)请你另选其他合适的试剂探究该氢氧化钠溶液是否变质?

实验步骤实验现象实验结论
【问题1】CaCl2溶液与NaHCO3溶液混合,真的不会产生白色沉淀吗?
(1)学生预测:学生无一例外地认为不会产生白色沉淀。
产生这样的预测结果,是因为学生受前概念“Ca(HCO3)2为可溶性盐”和“资料②”的影响,认为CaCl2溶液与NaHCO3溶液混合时不会发生反应。
(2)实验事实:向2 mL 0.1 mol/L CaCl2溶液中加入2 mL 0.1 mol/L NaHCO3溶液(pH=8.31),结果产生了白色沉淀。
(3)提出问题:试通过定量计算说明产生沉淀的原因。[已知:常温下,H2CO3的电离常数Ka1=4.5×10-7,Ka2=4.7×10-11,Ksp(CaCO3)=2.8×10-9。]
(4)定量计算:NaHCO3溶液中存在电离平衡:

因为Qc>Ksp(CaCO3),所以有白色沉淀生成。
【问题2】向CaCl2溶液中通入CO2气体,会产生白色沉淀吗?
(1)学生预测:许多学生认为会产生白色沉淀。
产生这样的预测结果,是因为学生的一些错误前概念非常顽固,尽管教师再三强调:“较强酸可制备较弱酸”,“向CaCl2溶液中通入二氧化碳气体不会生成白色沉淀”,但许多学生并没有真正实现概念的转变,导致一段时间后,之前的错误前概念又出现了。
(2)实验事实:向2 mL 0.1 mol/L CaCl2溶液中通入CO2气体至饱和,却未见沉淀。
(3)提出问题:试通过定量计算说明产生这一现象的原因。[已知:常温常压下,饱和CO2水溶液的pH=5.60,c(H2CO3)=1×10-5mol/L。H2CO3的电离常数Ka1=4.5×10-7,Ka2=4.7×10-11,Ksp(CaCO3)=2.8×10-9。]
(4)定量计算:碳酸溶液中存在电离平衡:


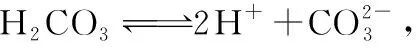
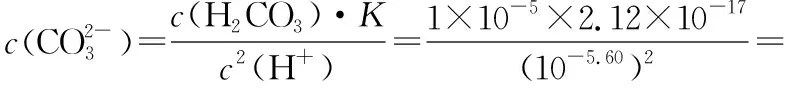
因为Qc 同理可知:向BaCl2溶液中通入CO2气体,不会产生白色沉淀。 实验反思:(1)过量 (2)碳充分燃烧生成二氧化碳,不充分燃烧生成一氧化碳; 拓展延伸:(3)不可靠; 实验探究:取该溶液少许放入试管中,滴加2~3滴氯化钡溶液 产生白色沉淀 该氢氧化钠溶液变质 【解析】由题目的信息可知,设计实验中,①取上述溶液少量于试管中,加入足量CaCl2溶液,产生白色沉淀,除去试管中的碳酸钠;②取步骤①所得上层清液少量,滴加足量的稀盐酸,有气泡冒出,小芳实验的溶液中含有碳酸氢钠。 实验反思中,Na2CO3和盐酸反应的生成物受盐酸量的影响,稀盐酸过量时才有气泡冒出;由此可见,当反应物的量不同时,产物可能不同,试另举一例来说明:碳充分燃烧生成二氧化碳,不充分燃烧生成一氧化碳。 拓展延伸中,欲鉴定某敞口试剂瓶中氢氧化钠溶液是否变质,甲同学取5 mL该液体,滴加少量稀盐酸,发现无气泡冒出,由此得出氢氧化钠溶液没有变质的结论;他的结论不可靠,因为加入的盐酸比较少,盐酸先与氢氧化钠反应。 探究该氢氧化钠溶液是否变质:取该溶液少许放入试管中,滴加2~3滴氯化钡溶液;产生白色沉淀,证明该氢氧化钠溶液变质。 【例2】下列实验中,对应的现象以及结论都正确且两者具有因果关系的是 ( ) 【问题3】向CuSO4溶液中通入H2S气体,会产生黑色沉淀吗? (1)学生预测:许多学生认为不会产生黑色沉淀。 产生这样的预测结果,是因为学生受前概念“较强酸可制备较弱酸”的影响,认为CuSO4溶液不能与较弱的H2S发生反应生成较强的H2SO4。 (2)实验事实:向2 mL 0.1 mol/L CuSO4溶液中通入H2S气体,立即出现黑色沉淀。 (3)提出问题:假设通入H2S气体至饱和,试通过定量计算说明产生沉淀的原因。[已知:常温下,饱和H2S的浓度为0.1 mol/L,H2S的电离常数Ka1=1.3×10-7,Ka2=7.1×10-15,Ksp(CuS)=6.3×10-36。] (4)定量计算:0.1 mol/L CuSO4溶液与H2S气体完全反应后,溶液中c(H+)≈0.2 mol/L,c(Cu2+)=0.1 mol/L。饱和氢硫酸溶液中存在电离平衡: Qc=c(Cu2+)×c(S2-)=0.1×2.3×10-21=2.3×10-22 因为Qc>Ksp(CuS),所以有黑色沉淀生成。实现了“较弱酸制较强酸”,这就是矛盾普遍性和特殊性。同时,也有力地说明了CuS不溶于硫酸或盐酸。 【答案】D 【解析】黑色沉淀为CuS,该反应发生原因是CuS不溶于硫酸,不是强酸制弱酸,实际上H2S的酸性比H2SO4弱,故A错误;向蔗糖中加入浓硫酸,并不断用玻璃棒搅拌,变黑,体积膨胀,放出刺激性气体,反应中生成碳、二氧化硫等,可说明浓硫酸具有脱水性和强氧化性,故B错误;FeCl3与SO2发生氧化还原反应生成硫酸根离子和亚铁离子,硫酸根离子与钡离子反应,生成白色沉淀BaSO4,故C错误;滴入NaOH溶液至过量,先生成氢氧化铝沉淀,后生成偏铝酸钠,然后通入CO2气体,又生成氢氧化铝沉淀,则先出现白色沉淀,后沉淀消失,最后又出现白色沉淀,可知Al(OH)3是两性氢氧化物,但不能溶解在某些弱酸中,故D正确。 通过对问题1、2、3的定量计算分析,引导学生抓住问题的实质,构建认知模型:当Qc>Ksp时,有沉淀生成;当Qc 【例3】已知CuS不溶于醋酸、浓盐酸、浓硫酸,但在浓硝酸中溶解,溶液变蓝并有红棕色刺激性气体产生。下列结论及原因解释正确的是 ( ) A.CuS不溶于弱酸,能溶于强酸 B.CuS不溶于非氧化性酸,能溶于氧化性酸 C.CuS溶于硝酸,是因为硝酸氧化性强于硫酸,S2-被氧化,使沉淀溶解平衡往溶解方向移动 D.CuS溶于硝酸,是因为硝酸的酸性大于硫酸和盐酸的酸性,S2-结合H+,放出H2S气体,使沉淀溶解平衡往溶解方向移动 【问题4】CuS能溶于硝酸吗? (1)学生预测:许多学生认为CuS不溶于硝酸。 产生这样的预测结果,是因为学生受前概念“CuS不溶于硫酸或盐酸”的影响,认为CuS不与硝酸反应。 (2)实验事实:将0.1 mol CuS投入一定量的稀硝酸中,试管内析出淡黄色沉淀,溶液变为蓝色,产生的无色气体,该气体在试管口变为红棕色。 (4)定量计算:CuS在水溶液中存在溶解平衡: 由计算结果可知,CuS能溶于硝酸,这是因为CuS与硝酸发生氧化还原反应,c(S2-)减小,使Qc 【答案】C 【解析】浓硫酸是强酸,但CuS不溶于浓硫酸,故A错误;浓硫酸、硝酸均是强氧化性的酸,但硫化铜不溶于浓硫酸,故B错误;CuS溶于硝酸的过程是硫离子被硝酸氧化的过程,S2-被氧化,浓度减小,所以硫化铜的沉淀溶解平衡正移,使得硫化铜溶于硝酸中,故C正确;CuS溶于硝酸的过程是硫离子被硝酸氧化的过程,S2-被氧化,浓度减小,所以硫化铜的沉淀溶解平衡右移,使得硫化铜溶于硝酸中,故D错误。 【例4】化学学科中运用平衡理论研究的内容主要包括:化学平衡、电离平衡、水解平衡和溶解平衡四种。请回答下列问题: 已知Mg(OH)2能溶于浓度均为3 mol·L-1的NH4Cl溶液和CH3COONH4溶液(中性)。 ①请结合平衡原理和必要的文字解释Mg(OH)2能溶于NH4C1溶液的原因_________________ ②将等体积、等浓度的盐酸和CH3COONH4溶液混合,所得溶液中离子浓度由大到小的顺序为_________________ 【问题5】Mg(OH)2能溶于CH3COONH4溶液吗? (1)学生预测:许多学生认为Mg(OH)2不能溶于CH3COONH4溶液。 产生这样的预测结果,是因为学生受前概念“Mg(OH)2能溶于酸”的影响,认为Mg(OH)2不溶于CH3COONH4溶液。 (2)实验事实:向Mg(OH)2中加入足量饱和CH3COONH4溶液,Mg(OH)2完全溶解。 (3)提出问题:试通过定量计算说明Mg(OH)2溶解的原因。[已知:常温下,Kb(NH3·H2O)=1.75×10-5,Ksp[Mg(OH)2]=1.8×10-11;当K>10-7时,调节反应物或生成物浓度可使反应发生。] (4)定量计算:由实验事实可推知,Mg(OH)2溶于CH3COONH4溶液时,可能发生反应: 由于K≫1.0×10-7,所以Mg(OH)2能溶于饱和CH3COONH4溶液。 通过对问题4、5的定量计算分析,引导学生理清现象的本质,构建认知模型:通过调节反应物或生成物浓度,使Qc 【例5】如果在1.0 L Na2CO3溶液中将0.01 mol BaSO4全部转化为BaCO3。试计算所需Na2CO3溶液的初始浓度。[已知:Ksp(BaSO4)=1.1×10-10,Ksp(BaCO3)=2.6×10-9。] 【问题6】BaSO4在Na2CO3溶液中能转化为BaCO3吗? (1)学生预测:许多学生认为BaSO4不能转化为BaCO3。 产生这样的预测结果,是因为学生受前概念“溶解度小的沉淀转化成溶解度更小的沉淀容易实现”的影响,认为BaSO4不能转化为BaCO3。 (2)实验事实:在分析化学中常常先将难溶强酸盐转化为难溶弱酸盐,然后用酸溶解,使阳离子进入溶液。 (3)定量计算:体系中存在平衡: 平衡浓度(mol/L)x0.10 Na2CO3溶液的初始浓度为0.01+0.24=0.25 mol/L。 【答案】0.25 mol/L 饱和Na2CO3溶液的浓度为1.7 mol/L,所以一般用饱和碳酸钠溶液浸泡BaSO4,经过多次重复,可得到BaCO3,实现了从溶解度小的沉淀向溶解度大的沉淀转化,这就是矛盾普遍性和特殊性。 【例6】已知Ksp(AgCl)=1.8×10-10,Ksp(AgI)=1.0×10-16。下列关于不溶物之间转化的说法中错误的是 ( ) A.向AgI中加一定浓度、一定体积的NaCl溶液,AgI可转化为AgCl C.AgI比AgCl更难溶于水,AgCl可以转化为AgI D.向c(Ag+)=1.8×10-4mol/L的溶液中加入等体积NaCl溶液,开始出现AgCl沉淀,则原NaCl溶液浓度应大于4.0×10-6mol/L 【问题7】AgI在浓度足够大的NaCl溶液中能转化为AgCl吗? (1)学生预测:部分学生认为AgI能转化为AgCl。 产生这样的预测结果,是因为学生受前概念“BaSO4在饱和Na2CO3溶液中能转化为BaCO3”的影响,认为AgI也能转化为AgCl。 (2)实验事实:向AgI中加入饱和NaCl溶液,未出现白色沉淀。 (3)提出问题:如果在1.0 L NaCl溶液中将0.01 mol AgI全部转化为AgCl。试计算所需NaCl溶液的初始浓度。[已知:Ksp(AgI)=8.3×10-17,Ksp(AgCl)=1.8×10-10。] (4)定量计算:体系中存在平衡: 平衡浓度(mol/L)x0.01 NaCl溶液的初始浓度为:0.01+2.17×104≈2.17×104mol/L 而饱和NaCl溶液的浓度为5.0 mol/L,所以AgI不可能在饱和NaCl溶液中转化为AgCl。 【答案】A 通过对问题6、7的定量计算分析,引导学生从本质上明确产生现象的原因,构建认知模型:溶解度相差不大的沉淀虽然可以相互转化,但从溶解度较小的沉淀向溶解度较大的沉淀转化时,转化溶液的浓度必须足够大,才能转化完全。如果两种沉淀的溶解度相差很大,则溶解度小的沉淀实际上不可能完全转化为溶解度较大的沉淀。 以上所有实验事实都与学生的前概念产生了认知上的冲突,出现了知识负迁移。复习时,教师可引导学生通过微观解释和定量分析来获取可靠的证据,构建化学核心观念和认知模型,让学生明确沉淀的生成、溶解、转化实质上就是外界条件变化引起Qc变化,通过比较Qc与Ksp的大小,可得到正确的结论并做出合理的解释。这样的复习方式,不仅能及时转变学生错误的“前概念”,还能有效培养学生的宏观辨识与微观探析、变化观念与平衡思想、科学探究与创新意识、证据推理及严谨的科学态度等化学核心素养,真正使化学核心素养落地生根。


二、沉淀的溶解







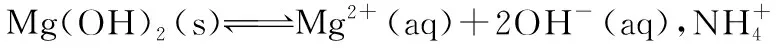


三、沉淀的转化







