miR-183-5p对大肠癌细胞增殖、迁移能力的影响及机制
李治岐,万里新,李晓丹,陶海云,王旸
1 新乡医学院,河南新乡 453000;2 南阳市中心医院
大肠癌(CRC)是全球最常见的恶性肿瘤之一,约占所有癌症的10%[1],每年新发病例约100万。目前主要依靠外科手术及放化疗等常规手段治疗,虽然早期发现的CRC患者中约90%可通过手术治愈,但由于CRC发病早期症状特异性不明,易发生漏诊,发现时往往是中后期,多由于肿瘤转移引起患者死亡[2],导致CRC的5年生存率低于50%[3]。上皮间充质转化(EMT)是指上皮细胞通过特定程序转化为具有间质表型细胞的生物学过程,表现为失去上皮细胞极性,无法与基底膜连接,迁移和侵袭能力增强。重组人抑制蛋白-2(PFN2)属于一类小的G-肌动蛋白结合蛋白,是肌动蛋白聚合的调节剂[4]。研究发现,PFN2在CRC中的表达低于对照,且PFN2的低表达与肿瘤患者不良预后相关[5]。PFN2蛋白能激活三磷酸隣脂酰肌醇(PIP3),阻断PDK/AKT/mT-OR通路,从而达到降低肿瘤细胞生长、迁移侵袭及血管生成的能力[6],是治疗癌症的潜在标靶,具有较强的研究价值。微小RNA(miRNA)是一组长度为20~24个核苷酸的非编码RNA,通过与靶基因3′非翻译区(UTR)结合,抑制该基因mRNA的表达,从而对细胞增殖、分化、迁移和凋亡[7]能力进行调控。2018年10月—12月,我们拟通过数据库的预测功能,寻找PFN2的上游miRNA,探讨miRNA通过PFN2通路介导的EMT过程对CRC进展的影响。
1 材料与方法
1.1 材料 收集2018年10月—12月于河南科技大学第一附属医院行CRC手术的患者新鲜癌组织标本20例份,经病理诊断为CRC,患者无放化疗史、不合并其他器官肿瘤,临床病例资料完整。同时收集其对应的癌旁组织(距肿瘤边缘20 mm,上切缘无瘤黏膜组织)20例份。标本置于液氮中,存放于-80 ℃冰箱内。本研究经医院伦理委员会批准,患者均知情同意。人大肠癌(CRC)细胞系HCT116、HT29购自美国典型培养物保藏中心(ATCC,Manassas,VA,USA)。细胞系HCT116、HT29和正常结直肠细胞系(FHC)按照说明常规保存在实验室中。将细胞在6孔或12孔板(BD Biosciences,Franklin Lakes,NJ,美国)中培养于5%CO2、37 ℃的培养箱中。
1.2 上游靶miRNA的预测 应用miRDB(http://mirdb.org/cgi-bin/search.cgi )预测功能,输入PFN2基因名查询即可。
1.3 组织和细胞中miR-183-5p表达检测 采用qRT-PCR法。根据制造商的说明,使用TRIzol试剂(美国Invitrogen)和miRcute血清/血浆miRNA分离试剂盒(中国TIANGEN),从组织、细胞和血浆样品中提取总RNA。使用miRNA cDNAs合成试剂盒(Applied Biologic Materials,Inc,Canada)通过逆转录反应合成cDNA。应用EvaGreen miRNAqRNA MasteMix试剂盒(加拿大Applied Biologic Materials公司)检测miR-183-5p (5′-UAUGGCACUGGUAGAAUUCACU-3′)表达,内参为U6。miR-183-5p 正向引物:5′-CGCGTATGGCACTGGTAGAA-3′,反向引物:5′-AGTGCAGGGTCCGAGGTATT-3′;U6正向引物:5′-GTGCTCGCTTCGGCAGCACAT-3′,反向引物:5′-AACGCTTCACGAATTTGCGT-3′。相对表达量的计算方法采用2-ΔΔCT法。
1.4 组织和细胞中PFN2 mRNA表达检测 采用qRT-PCR法。对于mRNA,使用PrimeScript RT-PCR试剂盒(Takara,大连,中国)从总RNA中逆转录cDNA。通过SYBR Premix Ex TagTMⅡ(Takara,大连,中国),通过ABI 7500系统(Applied Biosystem),使用特异性引物进行qRT-PCR,检测组织和细胞中 PFN2 mRNA的表达。β-actin作为内参。相对表达量的计算方法为2-ΔΔCT法。PFN2正向引物:5′-GCGGCCGCATGGCCGGTTGGCAGAGCTACG-3′,反向引物:5′-GGATCCTTACACATCAGACCTCCTCAG-3′;β-actin正向引物:5′-CCTGTACGCCAACACAGTGC-3′;反向引物:5′-ATACTCCTGCTTGCTGATCC-3′,反向引物:5′-TACCTTGCGAAGTGCTTAAAC-3′。PFN2 mRNA相对表达量的计算采用2-ΔΔCT法。
1.5 细胞增殖能力检测 应用CCK-8法。慢病毒miR-183-5p转染前24 h,将对数生长的 HCT116、HT29细胞转置于12孔板,分为mimics control组、miR-183-5p mimics组,调整细胞密度为1×105个/孔,当细胞融合度约为50%时进行转染,用含6 μg/mL聚凝胺的2 mL新鲜培养基替换原培养基,miR-183-5p mimics组加入慢病毒miR-183-5p悬液,mimics control组不予干预,37 ℃孵育。于12、24、48、72 h检测细胞增殖情况。操作步骤依据试剂盒说明书,之后使用酶标仪在450 nm波长下检测OD值,进行数据统计分析。
1.6 细胞迁移能力检测 慢病毒miR-183-5p转染前24 h,将对数生长期的 HCT116、HT29细胞转置于12孔板,分为mimics control组、miR-183-5p mimics组,调整细胞密度为1×105个/孔,当细胞融合度约为50%时进行转染,用含6 μg/mL聚凝胺的2 mL新鲜培养基替换原培养基,miR-183-5p mimics组加入慢病毒miR-183-5p悬液,mimics control组不予干预,37 ℃孵育。用200 μL移液器枪头在细胞培养皿中刮擦平行线,然后用 PBS洗涤并在无血清的DMEM中孵育。划痕完成后48 h显微镜下拍摄,统计细胞迁移个数。
1.7 统计学方法 采用SPSS21.0统计软件和GraphPad Prism软件系统。两组间比较采用t检验,多组间比较采用方差分析。采用Spearman检验对miR-183-5p和PFN2表达进行相关分析。P<0.05为差异有统计学意义。
2 结果
2.1 CRC癌组织和癌旁组织中miR-183-5p、PFN2 mRNA表达 CRC癌组织和癌旁组织中miR-183-5p的相对表达量分别为3.346±0.873、1.793±0.427,PFN2 mRNA的相对表达量分别为0.369±0.025、1.853±0.266,癌组织和癌旁组织中miR-183-5p、PFN2 mRNA相对表达量比较,P均<0.05。
2.2 细胞系中miR-183-5p、PFN2 mRNA表达 FHC、HCT116、HT29细胞系中miR-183-5p mRNA的相对表达量分别为0.475±0.012、1.382±0.009、0.983±0.006,与FHC相比,miR-183-5p mRNA在HCT116、HT29细胞系中表达上调(P均<0.05)。FHC、HCT116、HT29细胞系中PFN2 mRNA的相对表达量分别为1.284±0.149、0.513±0.007、0.478±0.005,与FHC相比,PFN2 mRNA在HCT116、HT29细胞系中表达下降(P均<0.05)。
2.3 miR-183-5p和PFN2表达的关系 Spearman相关性分析发现,miR-183-5p和PFN2表达呈负相关(r=-0.398,P=0.042)。
2.4 miR-183-5p对HCT116、HT29细胞系增殖及迁移能力的影响 miR-183-5p对HCT116、HT29细胞系增殖的影响见表1、2。同时点miR-183-5p mimics组细胞增殖能力高于mimics control组。mimics control组HCT116、HT29细胞迁移数分别为(29.41±0.76)、(24.74±0.84)个/HP,miR-183-5p mimics组HCT116、HT29细胞迁移数分别为(72.02±2.63)、(66.69±2.23)个/HP,miR-183-5p mimics组同种细胞迁移数均高于mimics control组(P均<0.01)。
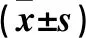
表1 两组HCT116细胞系不同时点增殖能力比较
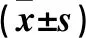
表2 两组HT29细胞系不同时点增殖能力比较
3 讨论
尽管治疗方案的不断发展给CRC的治疗带来了希望,但仍没有针对CRC晚期转移后的有效治疗方案。癌细胞迁移侵袭伴随着复杂的分子调控网络,一般通过入侵淋巴管或者伴随血液循环从原发部位扩散至远端组织,形成继发性肿瘤[8]。EMT是CRC转移的重要一环。EMT的启动和发展涉及复杂的信号通路和转录调节因子网络之间的串扰,如Wnts、Notch、Smads、ERK-MAPK及PI3K-AKT通路等。表现为肿瘤细胞上皮极性丧失,向间质表型细胞转化,导致肿瘤细胞浸润性增强[9]。这些变化使肿瘤细胞能够通过细胞外基质迁移至淋巴/血液血管中,实现肿瘤细胞的侵袭增殖[10]。
肌动蛋白是细胞骨架的重要组成部分,在癌症的转移中起着重要的作用[11],PFN2在头颈癌(HNSC)中显著上调,通过激活Akt和GSK-3β的磷酸化降低β-catenin的表达,促进癌细胞的增殖,迁移和侵袭[6]。但在在口腔鳞癌及大肠癌中却发现PFN2可抑制癌细胞的增殖与侵袭[12]。我们通过qRT-PCR观察到大肠癌旁组织与癌组织相比,正常FHC细胞系与癌HCT116、HT29细胞系中PFN2均显著下调,说明PFN2蛋白表达下调与大肠癌的恶化相关。
研究表明,microRNA的失调调控了肿瘤微环境中炎性细胞因子的异常表达[13],在CRC的进展中发挥着不可忽视的生物学功能,目前已成为调控癌症进展的重要方向[14]。研究发现 miR-183-5p参与多种癌症的进程,如在肺癌中可通过调节 PIK3CA起到抑癌的作用[15],在胃癌中可通过调控EEF2抑制肿瘤细胞的增殖和迁移[16],但同时也有研究发现miR-183-5p在非小细胞肺癌中可通过抑制可以抑制p53,并通过磷酸化激活AKT信号通路促进肿瘤的转移和生长[17]。可见miR-183-5p在不同肿瘤中可调控不同的靶基因,生物作用差异大。本研究结果显示,miR-183-5p在CRC细胞中表达上调,表明miR-183-5p可能在CRC中起促癌作用。最后,我们将模拟物转染HCT116和HT29细胞系控制miR-183-5p的表达,通过qRT-PCR及Western blotting确定了miR-183-5p对PFN2的调控关系,最后通过CCK-8法和划痕实验发现miR-183-5p过表达可促进CRC细胞的迁移和增殖能力,促进CRC的转移。
综上所述,miR-183-5p可促进CRC细胞的增殖、迁移,其机制可能是靶向下调PFN2表达。

