荧光性质的研究吡哆醛双缩二氨基硫脲金属配合物
鲁晓莉,刘宝全,王剑锋
(大连民族大学 生物技术与资源利用教育部重点实验室,辽宁 大连 116605)
1864年Schiff首次报道了伯胺与羰基化合物之间发生的缩合反应,其反应实质为亲和加成反应[1]。亲核试剂为胺类化合物,其结构中所带孤对电子的氮原子进攻羰基中带正电荷的碳原子,形成中间产物α-羟基胺类化合物,进一步脱水形成希夫碱(Schiff base)。氨基硫脲类希夫碱是一类重要的有机化合物,如图1。氨基硫脲是指化合物NH2-NH-CS-NH-NH2,其中氨基与醛或酮羰基缩合,成为缩氨基硫脲,分子中氮原子上的氢,可被烷基、芳香基取代,从而形成一系列性质不同的缩氨基硫脲类试剂,因其结构中的杂原子, 而具有多种生物活性,同时这些杂原子又有很强的配位作用,可以通过 S、N提供电子对和金属离子生成螯合物[2]。
希夫碱在与金属进行配位时其结构优势使得配位方式灵活多样,通常存在硫酮式和硫醇式的互变异构,亦或以中性与阴离子的形式与金属进行配位,其中亚胺的N,肼基的N、S以及胺基N均可参与配位,是胺基硫脲类希夫碱与金属配位结构稳定的重要原因之一[3]。希夫碱及金属配合物在医药、催化、染料、腐蚀以及分析化学等众多领域均有重要应用[4]。在医药领域,希夫碱金属配合物具有抗癌[5]、抑菌[6]、抗病毒[7]等生物活性;在催化领域,希夫碱的钴和镍配合物已作为催化剂使用[8];在染料领域,该配合物因受pH调控具有颜色的变化,色度丰富饱满[9];在腐蚀领域,某些芳香族的希夫碱常作为铜的缓蚀剂[10];在分析领域,希夫碱作为良好的配体,可以用来鉴别鉴定金属离子以及定量分析金属离子的含量[11];希夫碱金属配合物也展示出了荧光性[12-13],荧光探针灵敏度高、选择性好、不受外界电磁场影响,在化学生物学和分析化学相关领域具有广泛应用,本文对具有希夫碱结构的吡哆醛双缩二氨基硫脲及其金属配合物荧光性质进行了研究。
1 材料与方法
1.1 仪器与试剂
仪器:Varian Mercury plus400核磁共振仪;Bruker Daltonics Bio TOF型质谱仪,美国布鲁克·道尔顿公司(Bruker DaltonicInc.);荧光分光光度计为Perkin Elmer公司;紫外分光光度计为日本岛津公司;精密酸碱计为上海理达仪器厂;显微熔点测定仪为北京泰克仪器有限公司。
试剂:盐酸吡哆醛(98%,日本Wako);硫代氨基脲(99%,福晨化学);二硫化碳;80%水合肼;硫酸铜;醋酸铅;氯化镍;硫酸锰;醋酸锌;氯化铁;硝酸钴,均为科密欧分析纯试剂。
1.2 方 法[14]
1.2.1 1,3-二氨基硫脲的合成
取80%水合肼100 mL于圆底烧瓶中,加入适量去离子水,冰水浴,使用磁力搅拌器搅拌30 min,量取41.5 mL CS2加入到恒压分液漏斗中,缓慢滴加,时长在1h左右,室温搅拌30 min,至黄色沉淀析出后,加入6 g NaOH,水浴加热升温至75~85 ℃,反应10 h,产生的H2S气体用导气管导入氢氧化钠溶液中进行吸收,反应完毕后冷却至室温,抽滤得到析出的白色颗粒状固体;再用甲醇对滤渣进行洗涤,重复三次,最后用无水乙醇重结晶,得白色棒状结晶,真空干燥24 h,得目标产物1,3-二氨基硫脲,产率90%。
1.2.2 吡哆醛双缩二氨基硫脲(PyMAT)的合成
称取1,3-二氨基硫脲0.1327 g(1.25 mmol)倒入小烧杯中,加入少许去离子水和两滴浓盐酸,50 ℃预热至完全溶解;另取一小烧杯称取盐酸吡哆醛0.5000 g(2.5 mmol)加入15 mL无水乙醇溶解,50 ℃加热至完全溶解,缓慢倒入1,3-二氨基硫脲水溶液,快速搅拌,水浴加热至80 ℃反应30 min,冷却至室温,有棕色沉淀析出,减压抽滤,用去离子水反复冲洗数次,至滤饼变为橙色;再用80%的经HCl酸化的乙醇溶液溶解滤饼,加热至固体完全溶解,冷却至室温后抽滤,真空干燥的黄色粉末,产率82.5%,熔点253~256 ℃。1H-NMR in DMSO-d6/ppm:12.85(s,2H,-NH-), 8.31(d,2H,pyridoxal), 8.20(d,2H,-CH=), 4.77(d,2H,-CH2-), 2.63(d,6H,-CH3)。HRMS: C17H21N6O4S for +, found 405.1335, calculated 405.1340。
1.2.3 吡哆醛双缩二氨基硫脲金属配合物的合成
以铜配合物为例:吡哆醛双缩二氨基硫脲100 mg (0.25 mmol)溶解于50mL乙醇中,加入CuSO450 mg (0.25 mmol),水浴加热60 ℃回流反应1 h,冷却至室温后抽滤,沉淀用甲醇洗涤3次,真空干燥,得深棕色产品。金属盐水溶液具有不同的颜色,反应过程中可根据颜色变化判断反应是否完成。
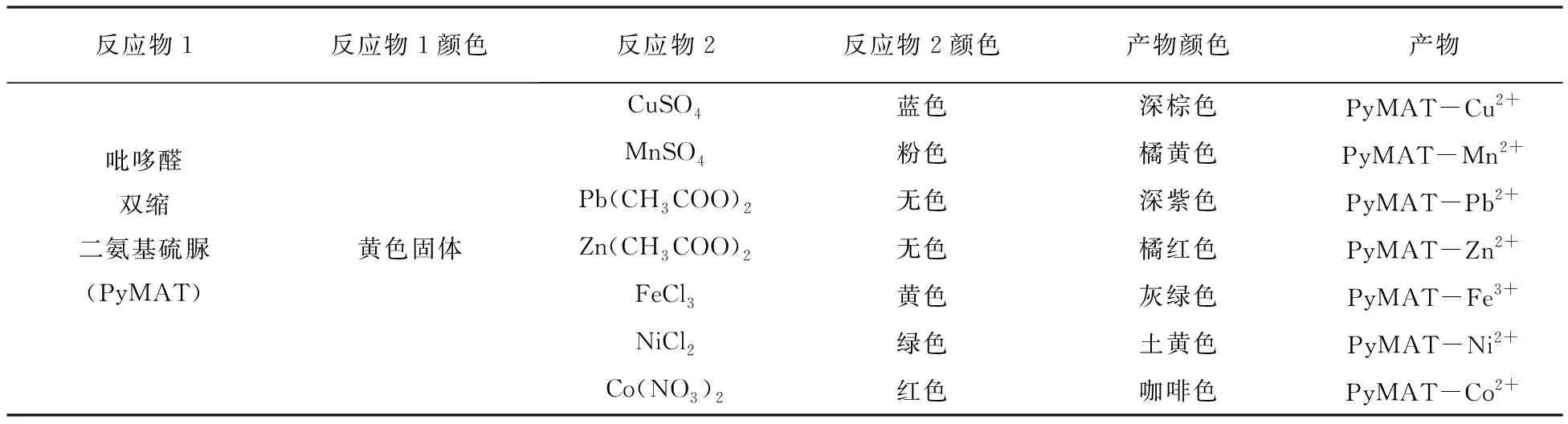
表1 吡哆醛双缩二氨基硫脲与金属离子形成的配合物
2 结果与讨论
2.1 吡哆醛双缩二氨基硫脲(PyMAT)的荧光检测结果
PyMAT荧光检测结果如图2。
吡哆醛双缩二氨基硫脲的激发光波长为291 nm,在酸性条件下,发射光波长为390 nm,在中性与碱性条件下,发射光波长为442 nm,荧光强度为600~1 000 a.u.。吡哆醛双缩二氨基硫脲原溶液pH为3.09,荧光强度为896 a.u,随着pH值的改变,荧光强度也有所改变,几乎都大于500 a.u.,pH 2.49和pH 12.43时,均出现较大荧光强度,只有当pH 5.50时,荧光强度明显减弱。通过紫外光谱分析,pH 2~12之间,出现明显的吸收减小到吸收增大的过程。
2.2 吡哆醛双缩二氨基硫脲与不同金属配合物的荧光检测
将吡哆醛双缩二氨基硫脲分别与Cu2+,Mn2+,Pb2+,Zn2+,Fe3+,Ni2+,Co2+形成金属离子配合物,并对其所形成的金属离子配合物进行荧光检测,结果如图3。随着pH的变化,不同配合物的发射波长和荧光强度都有明显的变化,发射波长均呈现出先增大后减小的趋势。
综上所述,总结得出吡哆醛双缩二氨基硫脲与其不同金属离子所形成的配合物均有荧光现象,且发射波长不同,但是随着pH值的变化,荧光强度会随之变化,见表2。
吡哆醛双缩二氨基硫脲本身具有荧光性质,与不同的过渡金属离子形成的配合物具有不同的颜色,也展示出不同的荧光光谱的特征,这主要是金属离子的加入改变了吡哆醛双缩二氨基硫脲的配位键合性能;pH对吡哆醛双缩二氨基硫脲与金属离子配合物的荧光性质具有明显的影响,这主要是酸碱度对其配位能力的改变。其中PyMAT-Cu2+,PyMAT-Mn2+,PyMAT-Pb2+,PyMAT-Ni2+四种金属离子配合物受pH的影响较大,只有在强酸获强碱的条件下才具有较强的荧光现象,弱酸弱碱时荧光强度均低于200 a.u.,且发射波场均随着pH值的增大而增大;而PyMAT-Fe3+,PyMAT-Co2+两种金属离子配合物随pH值增大同一发射波长处的荧光强度逐渐减弱,但最小荧光强度均高于200 a.u.;但最有意思的是PyDith-Zn2+配合物,该配合物的荧光强度在37 6 nm时随pH增大而减小,当pH 8.4时荧光强度最低,再随着pH逐渐增大,447 nm处的荧光强度又逐渐增大,呈现一种U型变化趋势。
3 结 论
吡哆醛双缩二氨基硫脲(PyMAT)与过渡金属离子形成的配合物展示出了一定的荧光性质,且此荧光现象随pH的变化而变化。本实验主要选择了七种不同金属离子化合物与PyMAT形成金属配合物,其中受pH影响较大的金属离子配合物为PyMAT-Cu2+,PyMAT-Mn2+,PyMAT-Pb2+,PyMAT-Ni2+,随着溶液由强酸至强碱的变化,它们的荧光强度变化十分明显,只有在强酸强碱时才具有较强的荧光现象,弱酸弱碱时荧光强度几乎没有,可作为水溶液中酸碱变化的荧光指示剂;虽然PyDith-Zn2+配合物也有类似的变化现象,但是该配合物随着pH的变化呈现处U型趋势,在pH8~14时荧光强度逐渐增大,可作为荧光标识剂;而PyMAT-Fe3+,PyMAT-Co2+两种金属离子配合物则与其他的配合物相反,随着pH的增大,荧光强度显现出逐渐递减的趋势,但最低荧光强度均比其他配合物的荧光强度高,可作为一种酸碱变化较大的荧光指示剂。

