不同碳含量包覆磷酸锰铁锂正极材料的研究
马国轩,刘 瑞,刘洪权,谷亦杰,2
(1.山东科技大学 材料科学与工程学院,山东 青岛 266590;2.潍坊学院 机电与车辆工程学院,山东 潍坊 261061)
随着能源危机的日益加重,锂离子二次电池一直是被认为最具发展前景的能量转换和储能装置,其中磷酸铁锂由于其低廉的价格、较强的安全性、较高的循环稳定性和环境友好性而备受关注[1],但其较低的能量密度制约了在新能源电动车上的应用[2]。通过对磷酸铁锂材料进行锰掺杂,合成磷酸锰铁锂固溶体材料,能够提高磷酸铁锂的能量密度[3],使磷酸锰铁锂成为高能量密度、高安全性一体的优异储能材料。
然而,对磷酸铁锂进行高锰掺杂会使磷酸铁锂的离子导电性和电子导电性降低[4],而且在反应过程中Mn3+离子产生的Jahn-Teller效应,以及Mn在反应过程中的溶解会使材料的电化学性能急剧降低[5]。目前主要通过控制颗粒形貌[6-8]、纳米化[9-10]和离子掺杂[11-12]等手段来改善磷酸锰铁锂的电化学性能。磷酸铁锂材料碳包覆的探讨已经很深入[13],但对于磷酸锰铁锂材料,不同方法包覆碳以及包覆碳的含量仍是值得讨论的问题[14-17]。磷酸锰铁锂材料的充放电曲线在3.6和4.2 V处显示两个电压平稳段,分别对应于Fe2+/ Fe3+和Mn2+/ Mn3+氧化还原对,并且两个电压平台的长度之比与Mn、Fe元素的含量成正比[18]。其中,Zou等[19]通过固相反应以炭黑和蔗糖为碳源合成的LiFe0.2Mn0.8PO4/C,在炭黑和蔗糖比例为1∶1且碳含量为20%时得到最佳性能0.1C下为104 mAh/g,认为过量的碳会导致碳颗粒偏析,从而阻碍电子传输并降低材料的电导率。但没有讨论在样品中出现的Mn、Fe平台长短之比变化的现象。周雪[20]通过固相反应使用不同碳源酚醛塑酯、蔗糖、PEG-2000对LiFe0.15Mn0.85PO4进行碳包覆,发现以酚醛塑酯为碳源合成的材料有着最佳电化学性能,在0.1C下为115.7 mAh/g,其中以PEG-2000为碳源的样品Mn平台较短且极化较大。碳包覆影响着材料的容量和极化程度以及磷酸锰铁锂平台的长短。本研究通过简单的两步法考察磷酸锰铁锂最佳的包覆碳含量以及不同碳含量对Mn、Fe平台长度的影响。
1 实验部分
1.1 材料的合成与制备
按照物质的量比n(Mn):n(Fe)=8∶2称取FeSO4·7H2O,MnSO4·2H2O制备成1 mol/L的锰铁盐混合溶液,加入0.2 g柠檬酸防止氧化。将所得Mn、Fe溶液与配置的0.5 mol/L (NH4)2C2O4溶液使用恒流泵滴入到玻璃反应釜中,50 ℃搅拌反应,同时滴入1 mol/L的硫酸和氨水控制反应pH=4,将反应得到的沉淀经去离子水和乙醇反复抽滤洗涤后,50 ℃干燥8 h,得到黄色粉末Fe0.2Mn0.8C2O4·2H2O前驱体。
按照物质的量比n(Li)∶n(Fe0.2Mn0.8)∶n(PO4)=1∶1∶1的比例称取前驱体与Li2CO3和NH4H2PO4混合,不同质量份数(4%、5%、6%、8%)的葡萄糖作为碳源,以无水乙醇为介质,400 r/min行星球磨6 h。将球磨后的浆料80 ℃干燥6 h,然后在氮气气氛下300℃预烧3 h,700 ℃煅烧10 h。自然降温后研磨得到不同质量比的样品。
为获得实际碳含量,使用盐酸溶解法进行测试,取出1 g制得的LiFe0.2Mn0.8PO4/C样品加入到25 mL浓盐酸中,煮沸15 min后使用G4漏斗过滤,将过滤物使用稀盐酸溶液与蒸馏水洗涤多次,180 ℃干燥后称重,得到实际碳含量。葡萄糖加入量为4%、5%、6%和8%的LiFe0.2Mn0.8PO4/C样品实际碳含量分别为3.09%、3.85%、4.64%和6.41% 。
1.2 材料的电化学性能测试
按照质量比80∶8∶12称取LiFe0.2Mn0.8PO4/C粉末、乙炔黑、聚偏氟乙烯(polyvinylidene fluoride,PVDF)溶于N甲基吡咯烷酮中混合搅拌成浆料,将浆料均匀涂抹在铝箔上,80 ℃干燥8 h,使用冲片机裁剪成12 cm的正极圆片,在手套箱中将正极、隔膜、负极锂片和LiPF6电解液组装成CR2016电池,使用蓝电测试系统进行充放电和循环测试,使用Zahner电化学工作站进行阻抗测试,扰动电压为5 mV。
1.3 材料的表征测试
物相表征采用日本理学公司生产的D/max2500pc X射线衍射仪(X-ray diffraction,XRD),Cu靶辐射,电压为40 kV,电流为100 mA,扫描速率为4°/min,扫描范围为10°~90°。形貌表征采用美国FEI公司的NOVA NANO SEM450高分辨扫描电镜。
2 结果与讨论
2.1 XRD与SEM分析
碳含量4%、5%、6%、8%的LiFe0.2Mn0.8PO4/C样品X射线衍射图谱如图1,所制得四个样品的衍射峰与LiMnPO4样品的标准卡片(JCPDS 33-0804)相吻合。没有观察到其他杂峰且峰型尖锐,证明合成的样品具有较高的纯度和结晶度。此外,样品中没有发现结晶碳的衍射峰,证明加入葡萄糖所形成的碳是以无定型碳的状态存在的。与纯相LiMnPO4的衍射峰相比,样品的(200)峰都有一定程度朝着大角度的偏移,这是由于离子掺杂导致的,由于Fe离子的离子半径小于Mn离子的离子半径,Fe离子取代Mn离子会使衍射峰朝着大角度偏移[3],证明已经成功合成出LiFe0.2Mn0.8PO4/C固溶体。
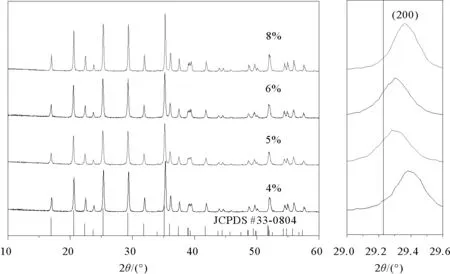
图1 不同碳含量LiFe0.2Mn0.8PO4/C样品XRD图Fig.1 XRD patterns of LiFe0.2Mn0.8PO4/C with different carbon content
碳含量4%、5%、6%、8%的LiFe0.2Mn0.8PO4/C的扫描电子显微镜(scanning electron microscope,SEM)图如图2,由于球磨所制得的样品均呈现不规则形状,一次颗粒的粒径200~500 nm,二次颗粒粒径4~6 μm,碳含量的改变没有对球磨法的样品颗粒形貌产生太大影响。

图2 不同碳含量LiFe0.2Mn0.8PO4/C样品的SEM图Fig.2 SEM image of LiFe0.2Mn0.8PO4/C with different carbon content
2.2 电化学性能
碳含量0、4%、5%、6%、8%的LiFe0.2Mn0.8PO4/C样品在0.1C倍率下首次充放电曲线如图3,碳含量0、4%、5%、6%、8%的LiFe0.2Mn0.8PO4/C样品首次放电比容量分别为16、77、97、108、50 mAh/g。相比于没有包覆碳的样品来说,包覆过碳的样品容量极大增加,碳可以提高材料的电子导电性,且使材料分布在形成的碳网络中,有利于电子的传递[13]。由图3可以看出,样品在3.5和4 V左右有两个明显的电压平台,分别对应着充放电反应中Fe2+/Fe3+和Mn2+/Mn3+的氧化还原反应[18]。此外,在不同样品的充放电平台中,Fe2+/Fe3+氧化还原反应中所对应的3.5 V的充放电平台随着碳含量的增加并没有显示出明显的电压平台升高或降低的现象。相反Mn2+/Mn3+所对应的4.1 V氧化还原反应平台随着碳含量的增加,充放电平台之间的电压差呈先减小后增大的规律,充放电电压平台差代表着电极极化程度,平台差越小电极极化越小[4]。
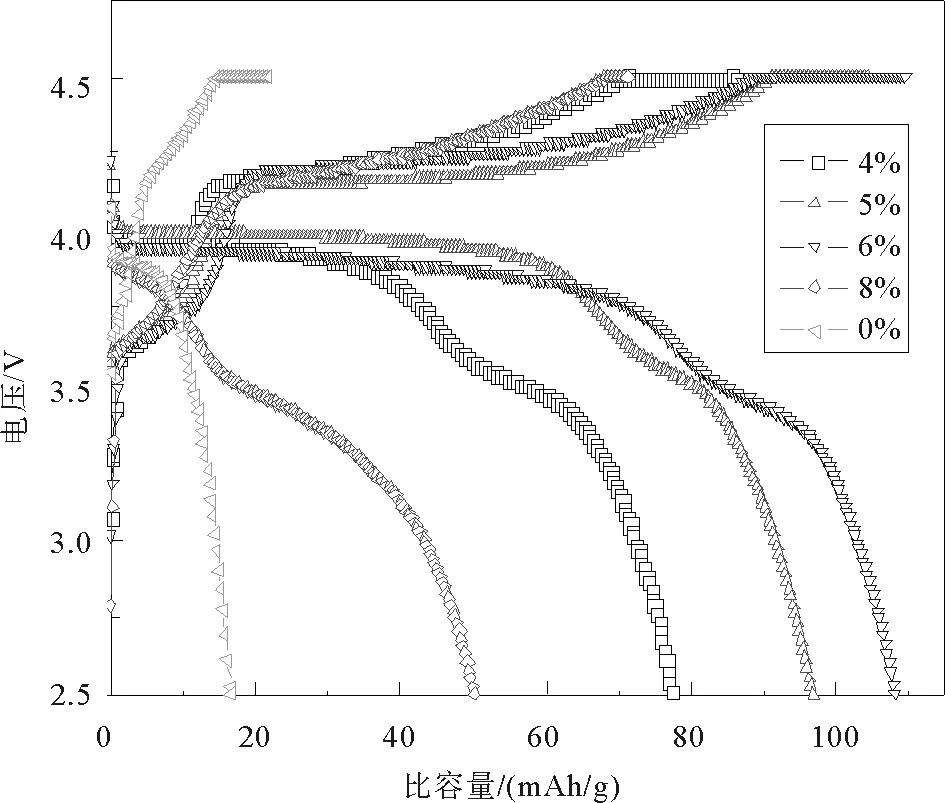
图3 不同碳含量LiFe0.2Mn0.8PO4/C样品在电流密度为0.1C首次充放电曲线图Fig.3 Initial charge-discharge curves (0.1C) of LiFe0.2Mn0.8PO4/C with different carbon content
图4为首次充放电曲线的微分曲线图,3.4~3.6 V所对应的峰为Fe2+/Fe3+的氧化还原峰。3.9~4.2 V对应的峰为Mn2+/Mn3+的氧化还原峰。如图所示,不同碳含量下Fe元素的氧化还原峰并没有较大区别,而Mn元素对应的氧化还原峰差别较大,其中碳含量为4%、5%、6%、8%所对应的Mn2+/Mn3+氧化还原峰分别为4.19 V/3.96 V、4.15 V/3.99 V、4.21 V/3.96 V、4.20 V/3.86 V。Mn2+/Mn3+所对应的氧化还原峰电压之差如图5所示,可以看出,随着碳含量的增加,电压差呈现先减小后增大的趋势,在5%碳含量下电压差最小为0.16 V。证明随着碳含量的增加,电极极化程度先增大后减小,在5%碳含量下电极极化程度最小。
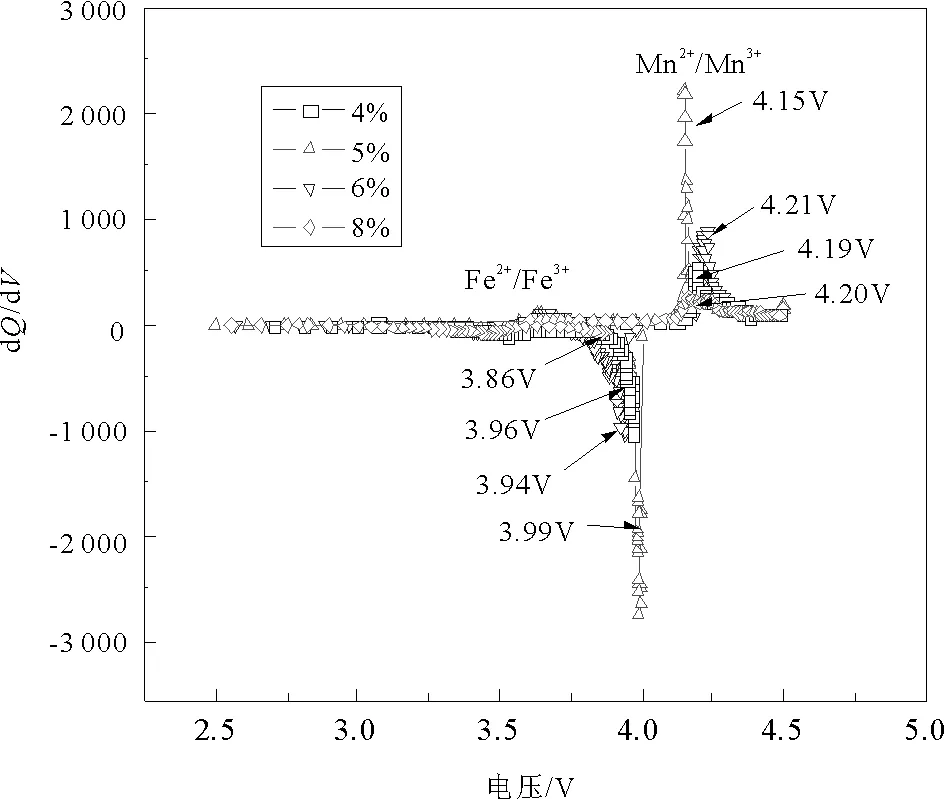
图4 不同碳含量LiFe0.2Mn0.8PO4/C样品在电流密度为0.1C首次充放电的微分曲线图Fig.4 Differential curves of first charge and discharge of LiFe0.2Mn0.8PO4/C with different carbon content
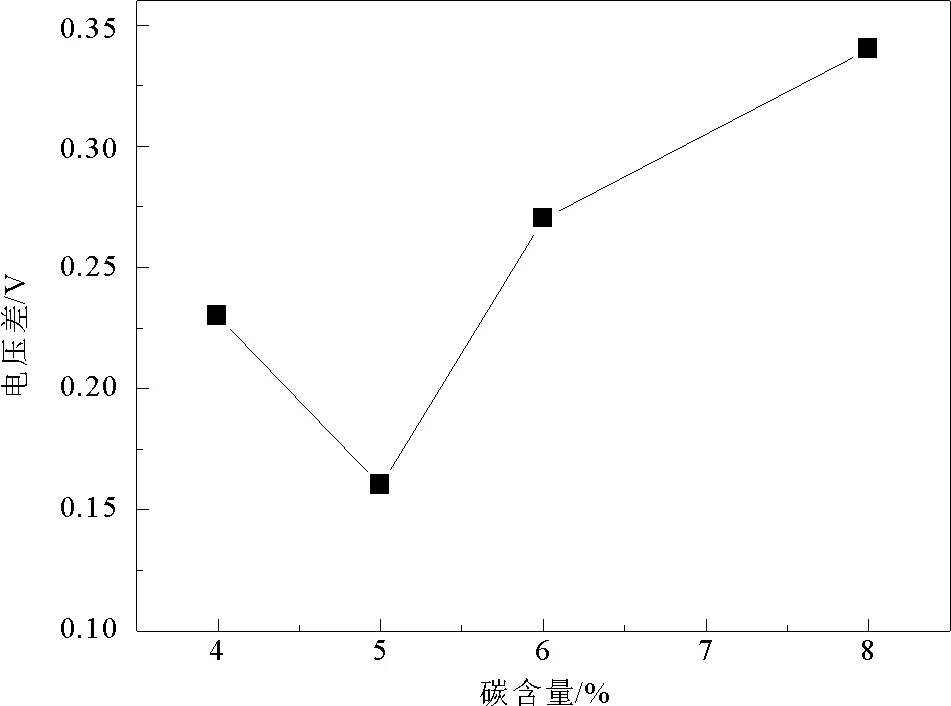
图5 不同碳含量LiFe0.2Mn0.8PO4/C样品Mn平台充放电电压差Fig.5 Voltage difference of Mn platform with different carbon content
通过微分曲线图将Mn2+/Mn3+与Fe2+/Fe3+提供的比容量作图6。由图6可以看出,碳含量分别为4%、5%、6%、8%的样品,Fe2+/Fe3+提供的比容量分别为32.6、30.1、29.7、37.6 mAh/g,Mn2+/Mn3+提供的比容量为44.6、66.7、78.5、12.6 mAh/g。可以看出,随着碳含量的增加,Fe2+/Fe3+提供的比容量并无明显变化,而Mn2+/Mn3+提供的比容量呈现先增大后减小的趋势,在碳含量为6%时最大。因此Mn2+/Mn3+提供的比容量直接影响样品的最终比容量,导致首次充放电下6%碳含量的样品拥有最高比容量(108 mAh/g)。
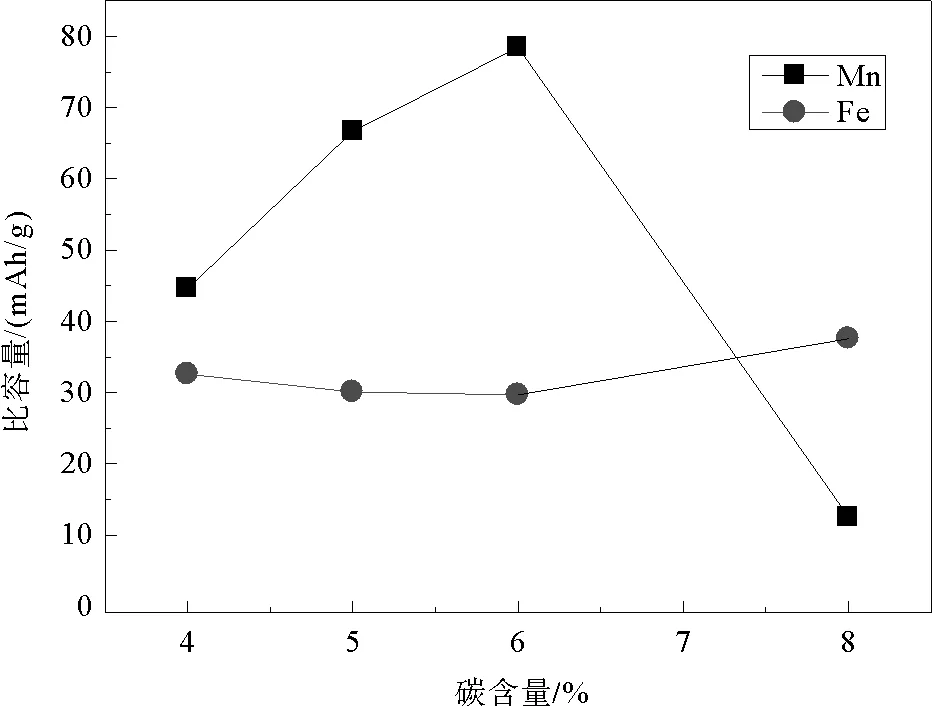
图6 不同碳含量下LiFe0.2Mn0.8PO4/C样品Mn2+/Mn3+与Fe2+/Fe3+提供的容量变化图Fig.6 Capacity variation of Mn2+/Mn3+ and Fe2+/Fe3+ in LiFe0.2Mn0.8PO4/C at different carbon content
图7为不同碳含量(4%、5%、6%、8%)的LiFe0.2Mn0.8PO4/C样品的倍率性能图,可以看出,6%碳含量的LiFe0.2Mn0.8PO4/C样品有着最好的倍率性能,在0.2C、0.5C、1C、2C、5C的比容量分别为106、102、97、90、75 mAh/g,在5C下仍保有初始放电容量72%的比容量,且由于电极的活化,当容量回到0.1C时为121 mAh/g,是首次充放电的116%。

图7 不同碳含量LiFe0.2Mn0.8PO4/C材料倍率性能图Fig.7 Rate capabilities of LiF65e0.2Mn0.8PO4/C with different carbon content
图8为碳含量分别为4%、5%、6%、8%的LiFe0.2Mn0.8PO4/C样品在1C倍率下的循环性能图。经过100次循环,碳含量4%、5%、6%、8%的LiFe0.2Mn0.8PO4/C样品的放电比容量分别为70.7、96.6、106.3和15.4 mAh/g,容量保持率分别为109.6%、105.3%、101.4%和80.6%。其中,由于前几次循环中的过充和后续循环电极活化导致部分碳含量的样品在循环性能中库伦效率大于100%,可以看出随着碳含量的增加,电极极化增大样品倍率性能下降。
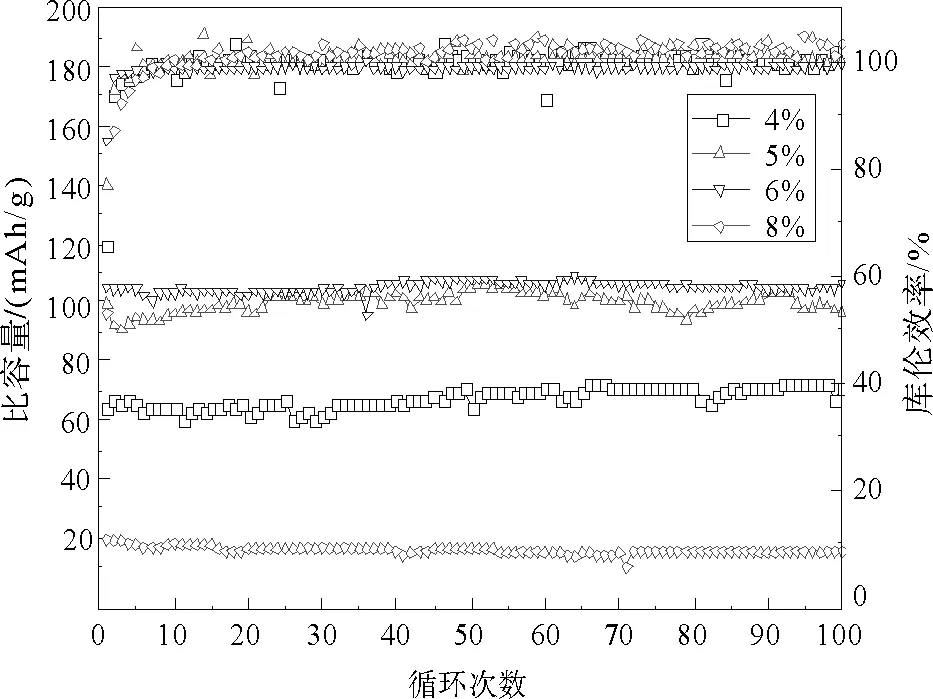
图8 不同碳含量 LiFe0.2Mn0.8PO4/C材料在电流密度为1C下的循性能图Fig.8 Cycling performances at current density of 1C of LiFe0.2 Mn0.8PO4/C with different carbon content
图9为不同碳含量样品在0.1C倍率下进行3个充放电循环后,对样品进行电化学阻抗测试所得到的电化学阻抗图(electrochemical impedance spectroscopy,EIS)。如图9所示,样品的电化学阻抗由高频区和中频区两个半圆和低频区的斜线组成。对图谱进行如图9内所示的电路拟合,得到如表1所示的数据。在这个等效电路图中Re代表电解液和电极电阻,Rsf代表固体电解质膜(solid electrolyte inerphase,SEI)膜电阻,Rct代表电荷转移阻抗。由表可以看出,随着碳含量的增加,Rsf和Rct呈上升趋势,证明碳的增加会导致电池内阻的提高,也印证了电池的循环性能随着碳含量的增加而降低。

图9 不同碳含量LiFe0.2Mn0.8PO4/C材料电化学阻抗图Fig.9 EIS plot of LiFe0.2Mn0.8PO4/C with different carbon content
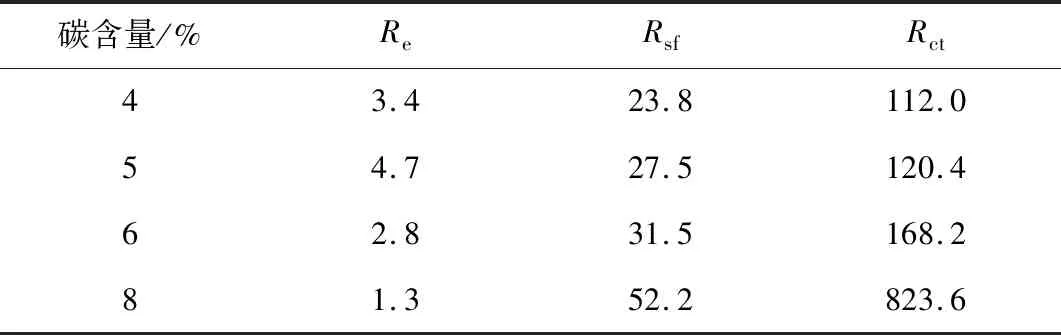
表1 不同碳含量LiFe0.2Mn0.8PO4/C材料阻抗表Tab.1 Impedance parameters of LiFe0.2Mn0.8PO4/C with different carbon content
3 结论
两步法合成了LiFe0.2Mn0.8PO4/C样品,并探究了不同含量的碳包覆对样品电化学性能的研究。结果表明,适当的碳含量能提高样品的电化学性能,随着样品碳含量的提高,样品的电化学性能呈现先增大后减小的趋势,碳含量对Mn离子放电影响较大,对Fe离子影响较小,在碳含量为6%时有着最佳的电化学性能和优异的倍率性能,0.1C下的比容量为121 mAh/g,在5C下仍保有初始放电容量72%的比容量。碳含量对LiFe0.2Mn0.8PO4/C的电化学性能影响较大,选择适当碳含量可以最大程度发挥电化学性能中Mn离子的活性,可以让磷酸锰铁锂材料的电化学性能进一步提升,为以后的研究提供了基础。

