miRNA-192在肝细胞癌组织中的表达及意义
孙玉珍 李世朋 赵建龙
(1阜外华中心血管病医院,河南 郑州 450000;2焦作市人民医院普外科;3河南科技大学医学院)
miRNA家族是长度约22个碱基的小分子非编码单链RNA,具有广泛性和多样性的特点,能够阻遏mRNA的翻译,进而影响蛋白质的表达。人们发现miRNA具有重要的监管职能并能调控多种生物进程,其表达的改变能够导致癌症的发生及进展〔1〕。其中miRNA-192在肿瘤的发生发展及转移过程中所起的作用受到人们的广泛关注,但miRNA-192在肝细胞癌中的表达情况及临床意义还需进一步研究。本研究探讨miRNA-192在肝细胞癌中的表达及意义。
1 资料与方法
1.1一般资料 收集河南科技大学第一附属医院2009年6月至2013年 8月接受肝细胞癌手术治疗的肝细胞癌组织43例及癌旁组织33例,组织学分级按Edmondson-Steiner分级法分为Ⅰ~Ⅳ级,Ⅰ~Ⅱ级归为高中分化组,共31例,Ⅲ~Ⅳ级归为低未分化组,共12例。TNM分期按照UICC/AICC 2010年标准,Ⅰ~Ⅱ期25例,Ⅲ~Ⅳ期18例。有淋巴转移6例,无淋巴转移37例。所有患者术前未行放化疗,临床资料完整。另取正常肝脏组织25例作为对照。病理诊断由两位病理科医生采用双盲法认定。
1.2主要试剂与仪器 mirVanaTM miRNA提取和分离试剂盒(Ambion,美国),Taq DNA 聚合酶、限制性核酸内切酶和T4 DNA 连接酶(Fermentas,深圳),M-MLV反转录酶(Promega 美国),RiboLock RNA 酶抑制剂(Fermentas,深圳);DYY-7型转移电泳仪(北京市六一仪器厂),PTC-200型PCR热循环仪(Bio-Rad,美国),iQ5荧光定量PCR检测系统(Bio-Rad,美国),LabWorksTM凝胶成像及分析系统(UVP,美国),F-4500型突光检测仪(HITACHI,日本),UV-2000型可见/紫外分光光度计(UNICO,美国)。地高辛标记的miRNA-192探针(稀释至100 nmol/L),原位杂交试剂盒(博士德,武汉),二氨基联苯胺(DAB)显色液试剂盒(中杉金桥,北京),其余试剂为分析纯。
1.3原位杂交 原位杂交检测 microRNA-192,将组织切片脱蜡和水化,蛋白酶 K(1 μg/ml)室温孵育30 min。滴加0.1 mol/L甘氨酸-磷酸盐缓冲液(PBS)终止消化,滴加预杂交液,预杂交30 min。0.2×SSC缓冲液冲洗后滴加杂交液,90℃孵育10 min,将切片置于盛有0.2×SSC缓冲液的湿盒中37℃孵育过夜 。冲洗后滴加封闭液,37℃孵育30 min。滴加兔抗地高辛IgG,湿盒37℃孵育30 min。PBS冲洗,滴加辣根过氧化物酶(HRP)山羊抗兔IgG,湿盒37°孵育30 min。滴加DAB显色。杂交过程以U6探针(1 nmol/L)作为阳性对照,去除探针作为阴性对照。microRNA-192以肿瘤细胞质中出现明显的棕黄色颗粒为阳性染色。采用半定量积分法判断结果。染色强度分级:1分,无染色,为阴性;2分,低等强度染色,为弱阳性;3分,中等强度染色,为中等阳性,>3分,强染色,为强阳性。阳性细胞数分级:1分为阳性表达率<10%;2分为阳性表达率 10%~50%;3分为阳性表达率>50%。以上两项分数相乘,得分1~3分者为低表达,>3分为高表达。
1.4实时定量RT-PCR 将组织脱蜡及水化,蛋白酶K消化后,按mirVanaTM miRNA提取和分离试剂盒说明书提取总miRNA 。根据miRNA-192的基因信息及内参U6的基因信息,运用Primer Premier 5.0软件分别设计RT及PCR引物,miRNA-192 RT引物序列:5′-GAGGCACAGCUUGACCUAUG AAUUGCAGCCAGGCUCCGUGUUGAACUGGAUACUU AACGUCGGUC GGCTGT-3′;PCR引物序列:正义链5′-CTGACCTATGAATTG-3′,反义链5′-GACCTATGAATT-3′。U6 RT引物序列:5′-CGCTTCACGAATTTGCGTGTCAT-3′;PCR引物序列正义链5′-GCTTCGGCAGCACATATACTAAAAT-3′,反义链5′-CGCTTCACGAATTTGCGTGTCAT-3′。按照 Taqman microRNA assay 荧光实时定量 PCR 试剂盒的方法,首先对各组织的miRNA进行逆转录,然后在实时定量PCR仪上进行荧光实时定量 PCR,条件:50℃,10 s;95℃,9 min;95℃,12 s;循环35次,60℃,1 min,50 μl反应体系。iQ5荧光定量PCR检测系统读出各组织的 Ct 值,miRNA-192相对表达量的 microRNA分析用 U6 作内参,结果用 ABI自带软件分析。
1.5统计学方法 应用SPSS19.0 统计软件进行t、χ2检验。
2 结 果
2.1原位杂交的结果分析 miRNA-192探针结果显示呈棕黄色颗粒的阳性信号,定位于胞质,见图1。miRNA-192在正常肝组织、癌旁和肝细胞癌组织中的表达率差异有统计学意义(χ2=23.698,P<0.000 1),见表1。
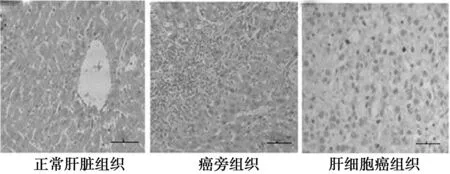
图1 miRNA-192在不同组织中的表达(DAB,×200)
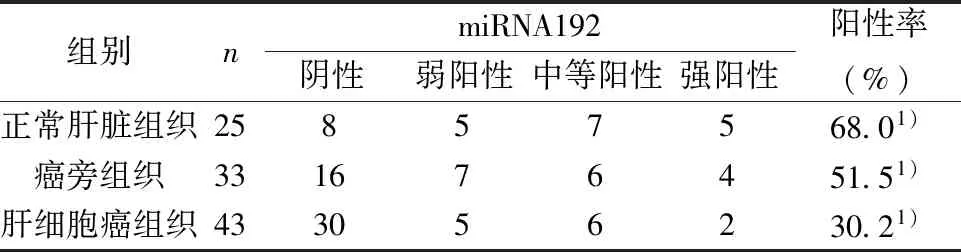
表1 miRNA-192在不同组织中的表达(n)
2.2RT-PCR的结果分析 在肝细胞癌组织中 miRNA-192的含量(1.83±0.43)显著低于正常肝脏组织(4.05±0.32,P<0.01)及癌旁组织(2.89±0.19,P<0.05),且癌旁组织miRNA-192的含量明显低于肝细胞癌组织(P<0.05)。
2.3miRNA-192的表达与肝细胞癌临床病理参数的关系 miRNA-192在低未分化肝细胞癌中的阳性率明显低于高中分化者(P<0.05);Ⅲ~Ⅳ期肝癌组织中miRNA-192的表达水平低于比Ⅰ~Ⅱ期(P<0.05);有淋巴结转移肝癌中的阳性率明显低于无淋巴结转移者(P<0.05),见表2。

表2 肝细胞癌中miRNA-192表达与临床病理学参数的关系
3 讨 论
肝细胞癌占全世界原发性肝癌的70%~85%〔2〕,在我国约占90%〔3〕。研究证明,肝细胞癌发生过程中有的microRNA含量上升,有的microRNA含量下降,异常表达的microRNA影响其发生侵袭性和预后〔4,5〕,它们能通过特异性结合于蛋白mRNA的3端非编码区(3′-UTR),从而影响该蛋白的表达。miRNA-192(MI0000234)定位在11号染色体(64658609-64658718),在肝脏、结肠和肾脏组织中表达丰富〔6〕。miRNA-192目前已被证实在多种肿瘤中均存在表达异常的现象,提示其参与了肿瘤发生发展及侵袭转移的生物功能。吴蔚芸等〔7〕采用实时定量RT-PCR技术发现结直肠癌组织中miRNA-192的表达下调,显著低于非肿瘤组织,并发现miRNA-192的低表达与淋巴结转移及远处转移有关;Feng等〔8〕的研究表明与正常肺组织相比,miRNA-192在肺癌组织中表达下调,在体外实验中,过表达miRNA-192通过作用于RB1基因可以抑制肺癌细胞的增殖和促进凋亡。李娟〔9〕发现在胃癌miRNA-192低表达组中,miRNA-192的低表达与肿瘤的大小、大体分型和pT分级相关。肿瘤越大,分型分级越重,miRNA-192表达量越低。谢琼慧等〔10〕初步证实HepG2细胞中miRNA-192的下调能够降低p53和CD-KNIA的表达水平,抑制p53介导的细胞周期阻滞,促进癌症的发生。下调RB1表达很可能是miRNA-192促进HepG2细胞凋亡的机制之一〔11〕。於雷〔12〕利用microRNA芯片发现miRNA-192在肝癌组织中表达下调,体现出抑癌作用,肿瘤组织中miRNA-192与患者术后无瘤生存率显著相关。本结果说明miRNA-192表达水平的下降与肝细胞癌的组织类型、TNM分期、淋巴转移情况存在相关性。这些特征都与肿瘤的发展及不良生物学行为密切相关,其中淋巴结转移更是患者预后不良的重要标志,因此我们推测miR-192表达下调在肝细胞癌发生发展、侵袭转移过程中起重要作用,并影响肝细胞癌患者的远期生存预后。microRNA-192 有望作为一种预测肝细胞癌病情进展及预后的潜在生物学标志物。

