地鳖虫醇提物对肿瘤细胞侵袭与凋亡的作用机制
张慧明 富尧 白淑菊 刘爽 吕冬云
(佳木斯大学 1基础医学院,黑龙江 佳木斯 154002;2生命科学学院)
前列腺癌在世界范围内发病率与死亡率呈逐年上升的趋势,早期诊断可以通过手术治疗提高前列腺癌患者的治愈率〔1〕。然而,晚期前列腺癌患者的死亡率较高,同时患者存在癌细胞多器官转移的现象〔2〕。化学疗法在前列腺癌患者晚期治疗阶段起重要的作用,但是化学疗法比较敏感,治疗过程中机体会对化学药物产生抗性,一旦复发化学疗法由于抗化学性而变得无效〔3〕,需要寻找安全并且长久的靶向药物来治疗并减缓癌症的转移现象。
实验证明,中药对于恶性肿瘤有着很好疗效〔4〕。地鳖虫(ESW)是众多常用作食物的昆虫之一,是我国传统的中药,从古至今被用于治疗许多不同的疾病,如瘀斑、创伤后伤口、肝纤维化和肿瘤。ESW有效成分中纤维蛋白物质抗肿瘤作用有报道〔5〕,但其醇提物对前列腺癌的作用方式尚未明确,本实验研究ESW无水乙醇提取物(ESWE)抗肿瘤作用和潜在的信号传导机制。
1 材料与方法
1.1材料 ESW粉末(国家标准物质网:编号121533),PC3细胞,DMEM高糖培养液,F-12培养液,胎牛血清(FBS)Gibco进口分装,青霉素,链霉素,吖啶橙溴乙锭(AO/EB)试剂盒(品牌solarbio),实时定量聚合酶链反应(qPCR)试剂盒(生工生物公司),磷酸盐缓冲液(PBS),无水乙醇,培养瓶,培养皿等。细胞购于博士德公司。
1.2仪器 激光共聚焦显微镜(奥林巴斯FV1000),倒置显微镜(莱卡),酶标仪(BioTek),超声机(KQ-250DE型医用数控超声机),竖式电泳仪(北京六一)。
1.3细胞培养 细胞购自中国博士德生物科技有限公司,PC3细胞培养在含有10%FBS的F-12培养液中,均在37℃,5%的CO2条件下培养。
1.4醇提物的制备 将ESW粉末在无水乙醇中浸泡6 h,超声温度50℃,超声时间40 min,旋转蒸发仪提纯,醇提物溶于二甲基亚砜(DMSO)4℃储存,对照组加入相同剂量DMSO作为对照。
1.5ESWE对肿瘤细胞的抑制作用 将PC3细胞(1×104个)在96孔板中培养,醇提物浓度梯度为2、4、6、8、10、12 mg/ml。种板后24 h加药同时设置对照组,每组3个复孔。药物作用48 h。加入CCK8液100 μl/孔(CCK8∶培养液=1∶9),1 h后酶标仪波长450 nm下检测吸光度值A。实验重复3次。用公式计算细胞增殖抑制率。Graphpad软件分析IC50值。
1.6划痕实验 取对数生长期细胞PC3(1×105个)接种于6孔板,3个复孔。细胞生长完全融合后,用黄色的枪头在孔板底部轻轻划直线,PBS清洗2次继续培养。取药物浓度低剂量(2.0 mg/ml)、高剂量(4.0 mg/ml)为实验组,正常培养为对照组。药物作用48 h,倒置显微镜观察细胞融合度并拍照。PC3细胞的运动能力用划痕愈合百分率来表示。
1.7迁移侵袭实验 transwell小室做细胞迁移侵袭能力测定,将PC3细胞血清饥饿24 h,然后在含有醇提物的无血清培养基中铺板(1×104细胞/孔)在24孔板的上室中浓度为2.0 mg/ml,4.0 mg/ml。下室填充1.5 ml含有10%FBS的培养基。作用48 h后,用棉签刮下保留在膜上表面的细胞,甲醇∶冰乙酸(3∶1)固定30 min,吉姆萨染色15 min,清洗,晾干,倒置显微镜下拍照并计数。每组3个小室,每个小室选10个视野计数。
1.8AO/EB凋亡实验 取对数生长期细胞(PC3)1×105个/ml接种于6孔培养板中,爬片处理,分别取2.0 mg/ml,4.0 mg/ml为实验组,正常培养为对照组,每组分别铺3个复孔,37℃培养,细胞密度达到70%时,应用AO/EB试剂盒观察细胞凋亡现象,激光共聚焦显微镜观察。AO/EB 测细胞凋亡,AO与核内DNA结合呈现绿色荧光,可以透过完整的膜。EB与核内DNA结合呈现橘红色荧光,不能透过完整核膜。凋亡的细胞核呈现荧光加强,形态皱缩成块状或圆珠状。
1.9检测细胞中Integrin(ITG)β1、ITG连接激酶(ILK)、纤维型肌动蛋白(F-actin)、半胱氨酸天冬氨酸蛋白酶(Caspase)3 mRNA相对表达量 PC3细胞常规培养,90%融合度时加入不同剂量组药物作用。48 h后加入TRIzol裂解细胞收集裂解液,提取总RNA,PCR反转录,qPCR均使用生工试剂盒构建,按说明书完成,所用引物为GAPDH正义链:5′AGAAGGCTGGGGCTCATTTG-3′,反义链:5′AGGGG CCATCCACAGTCTTC-3′。ITGβ1正义链:5′-ACCTG CCTTGGTGTCTGTG-3′,反义链:5′-CAACTTCTCCC TGCTTTCCA-3′。ILK正义链:5′-GACGAAGCTCA ACGAGAA-3′,反义链:5′-AGTCCCTGCTCTTCCTTGT-3′。F-actin正义链:5′-CTCCATCCTGGCCTC GCTGT-3′,反义链:5′-GCTGTCACCTTCACCGTTCC-3′。Caspase3正义链:5′-ACTGGAAAGCCGAAACTC TTCATCA-3′,反义链:5′-GGAAGTCGGCCTCCACTGGTATC-3′。
1.10免疫印迹(WB)实验 蛋白制备:取对数生长期细胞(PC3)1×105个/ml接种于6孔培养板中,细胞密度接近90%时,加药。分别取2.0、4.0 mg/ml为实验组,正常培养为对照组,每组分别铺3个复孔,37℃培养,48 h后提蛋白。沸水使其变性,-80℃保存。WB:蛋白样品上样-电泳-转膜-5%的血清白蛋白(BSA)封闭-封一抗(ITGβ1、ILK、F-actin、Caspase3)分别1∶1 000配比,4℃摇动过夜。次日,洗膜-封入抗兔、抗鼠二抗,1∶4 000配比,洗膜。条带显色3 min,曝光时间根据蛋白的不同而有差异(5 s至5 min)。
1.11数据分析 采用Graphpad8.0软件进行独立样本t检验。
2 结 果
2.1ESWE对肿瘤细胞的抑制作用 不同浓度的ESWE对PC3细胞具有比较明显的抑制作用,2.0、4.0、6.0、8.0、10.0、12.0 mg/ml的抑制率分别为(7.58±2.60)%、(20.92±5.40)%、(42.55±12.60)%、(68.47±4.80)%、(86.47±1.79)%、(90.15±1.11)%。其中对PC3的IC50值为6.265 mg/ml。
2.2ESWE对PC3细胞迁移能力的影响 与0 h对比,作用48 h后对照组迁移率为93.6%±2.3%,2.0、4.0 mg/ml组迁移率分别为70.2%±2.0%、60.6%±1.8%,见图1,随着药物浓度的增加迁移率逐渐降低。

图1 划痕实验检测作用不同时间PC3细胞迁移能力(×50)
2.3ESWE对PC3细胞侵袭能力的影响 用生长48 h的PC3细胞通过transwell小室的数目来计算细胞的侵袭能力,对照组侵袭数为(107.6±2.0)个,2.0、4.0 mg/ml组分别为(70.8±1.6)个、(42.8±1.5)个,随药物浓度的升高侵袭能力逐渐减弱(P<0.01)。见图2。
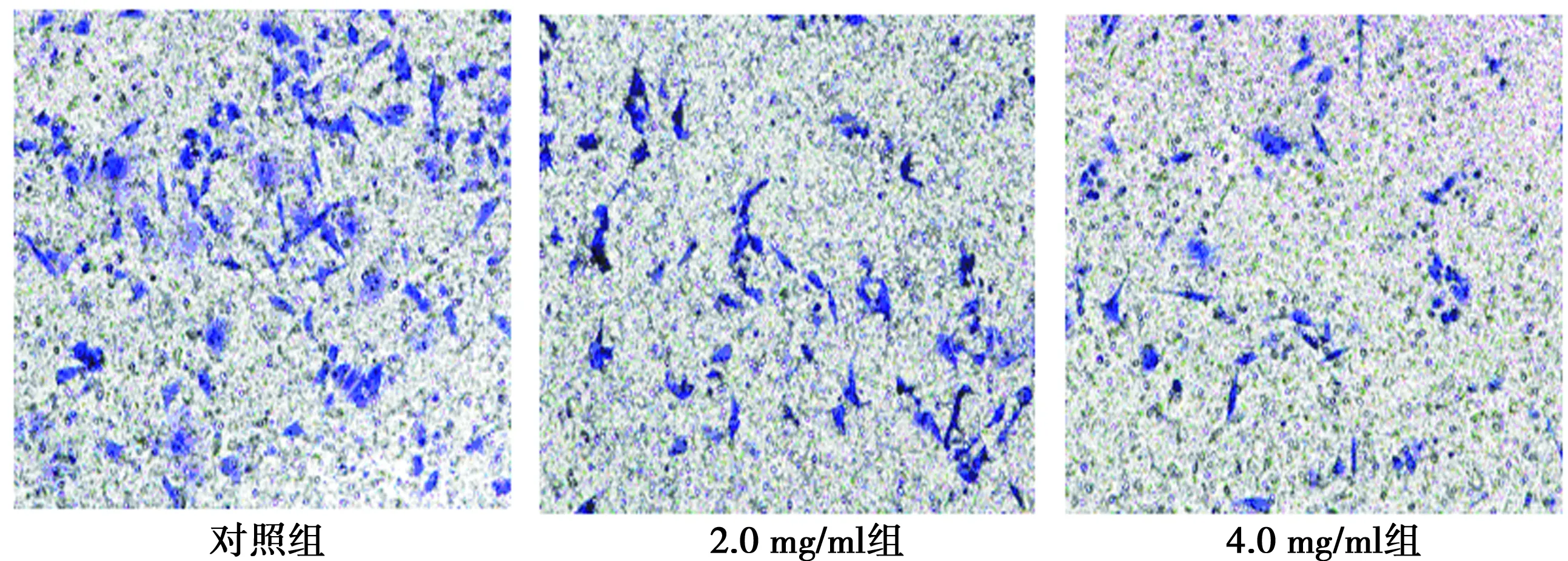
图2 transwell实验检测PC3细胞株侵袭能力(吉姆萨染色,×100)
2.4ESWE对PC3细胞凋亡的影响 对照组细胞核呈规则形态,未见凋亡现象。2.0 mg/ml组细胞核出现明显的皱缩现象,呈早期凋亡的现象。4.0 mg/ml组多个细胞核呈现皱缩、块状,呈晚期凋亡现象,见图3。药物可促进PC3细胞凋亡,并呈剂量依赖。
2.5ESWE对PC3细胞 ITGβ1、ILK、F-actin、Caspase3 mRNA表达的影响 随着ESWE浓度的增加ITGβ1 mRNA表达量4.0mg/ml组显著低于2.0 mg/ml组,2.0、4.0 mg/ml组显著低于对照组(P<0.05);ILK mRNA表达量2.0、4.0 mg/ml组低于对照组且具有显著性差异(P<0.05),4.0 mg/ml组与2.0 mg/ml组无显著差异性(P>0.05);F-actin mRNA表达量没有明显变化;而Caspase3 mRNA表达量2.0、4.0 mg/ml组与对照组比较有显著性差异(P<0.05),4.0 mg/ml组与2.0 mg/ml组不具有显著差异性(P>0.05)。见表1。
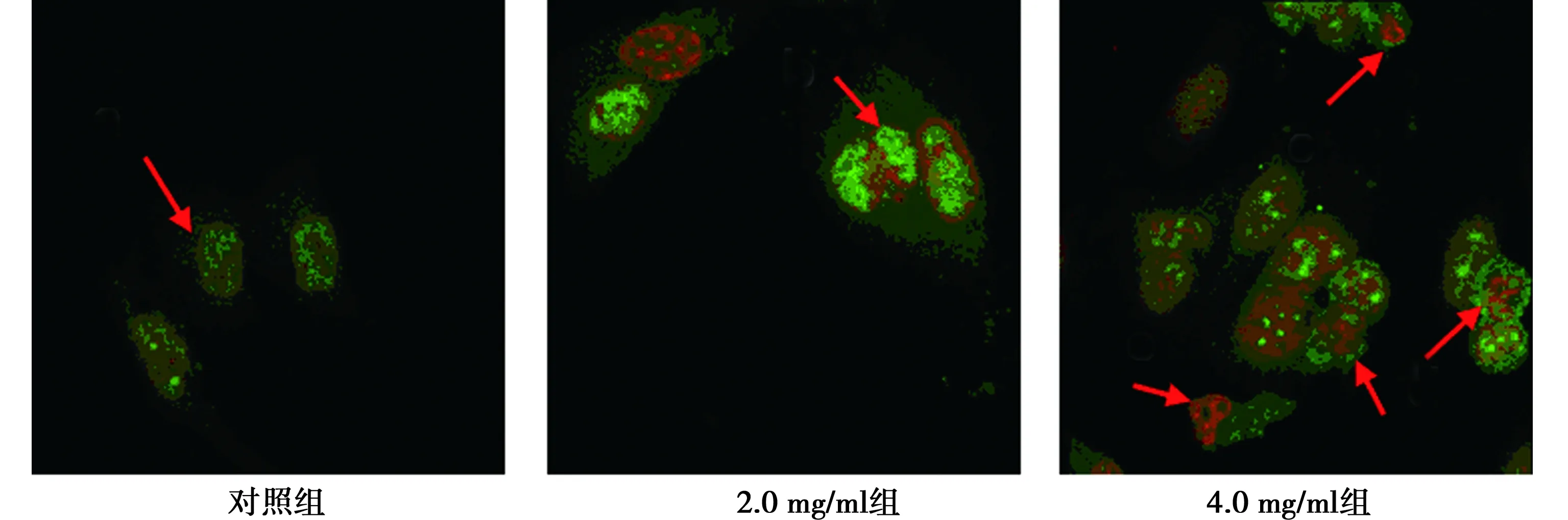
箭头所示为细胞凋亡图3 PC3细胞凋亡(AO/EB染色,×600)
表1 ITGβ1、ILK、F-actin、Caspase3mRNA相对表达量比较
2.6ESWE对PC3细胞ITGβ1、ILK、F-actin、Capase3蛋白表达的影响 随ESWE浓度升高ITGβ1、ILK、F-actin表达量均下降,ITGβ1 2.0 mg/ml组与对照组差异不显著(P>0.05),4.0 mg/ml组与2.0 mg/ml组、对照组比较有显著性差异(P<0.05);ILK 2.0 mg/ml组与对照组、4.0 mg/ml组比较具有显著性差异(P<0.05),F-actin 2.0 mg/ml组与对照组比较差异不显著(P>0.05),2.0 mg/ml组与4.0 mg/ml组比较有显著性差异(P<0.05);Caspase3表达量随ESWE浓度升高逐渐上升,2.0 mg/ml组与对照组比较有显著性差异(P<0.05),4.0 mg/ml组与2.0 mg/ml组比较有显著性差异(P<0.05)。见图4,表2。
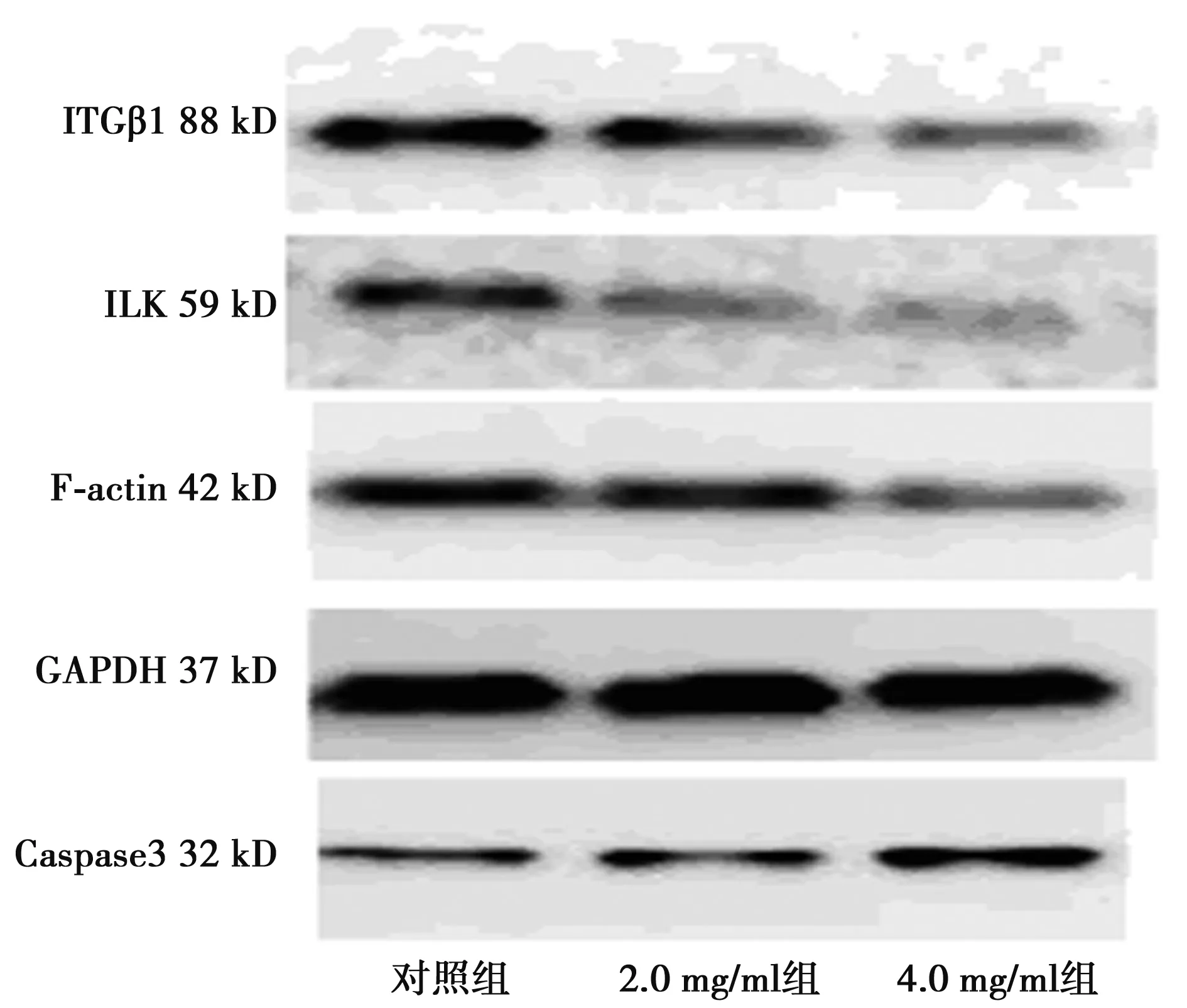
图4 WB检测各组ITGβ1/ILK/F-actin及Caspase3蛋白水平
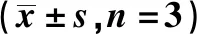
表2 各组ITGβ1/ILK/F-actin及Caspase3灰度值
3 讨 论
ESW为中国著名的食用和药用昆虫,用作传统医学骨损伤、血瘀和免疫相关疾病的治疗。现代药理研究表明ESWE可以抑制各种肿瘤的生长〔6〕。本实验从ESW粉末中通过化学提纯的方法提取醇提物〔7〕体外作用前列腺癌细胞PC3。本实验得出ESWE可以降低ITGβ1、ILK并上调Caspase3蛋白质表达,ESWE的抗侵袭作用是前列腺癌细胞通过ITGβ1降解细胞外基质(ECM)成分调节ILK与F-actin表达,上调Caspase3表达促进细胞凋亡。
肿瘤细胞侵袭与转移是肿瘤细胞的特点,这与ECM层黏连蛋白与肿瘤表面受体相互结合从而降解ECM,构成局部溶解通道,从而降低细胞黏附性有直接联系〔8〕。 ITGβ1介导细胞与ECM层黏连蛋白的黏附能力〔9〕,ITGβ1表达量高则细胞黏附性弱,反之则强。ITG家族本身不具有激酶的活性,与ECM结合后激活ILK招募Paxillin、Parvin、Plectin等与actin相结合从而启动ITG信号通路,调节骨架蛋白F-actin的组装〔10〕。ILK靶向催化丝/苏氨酸蛋白激酶(PKB/Akt),PKB磷酸化下游蛋白底物糖原合成酶激酶(GSK)-3β调节细胞凋亡〔11〕。PKB/GSK3β活化后可以减少因线粒体膜通透性改变所引起的细胞凋亡,并显著降低Caspase3的表达及活性〔12〕。
在一些研究中已经报道了ESW可溶性蛋白的抗肿瘤活性〔5〕,醇提物与肿瘤的抑制作用相关研究很少,其抗肿瘤机制尚不清楚。本研究证明ESWE通过 ITGβ1/ILK/F-actin信号途径参与前列腺癌细胞的迁移与侵袭过程,在此过程中影响了微丝骨架蛋白F-actin重构,但并不影响其总量的表达。同时ILK可调节下游蛋白Caspase3促进PC3细胞凋亡。本研究结果可为新的肿瘤治疗药物的研究提供理论实验依据。
致谢:黑龙江省北药与功能食品优势特色学科建设项目提供资助!

