牛OPU卵子体外受精和早期胚胎培养的方法研究
王志仙,朱宏波,张普,冯春涛,蔺惠良,刘玉,李树静,余文莉
(1.石家庄天泉良种奶牛有限公司,石家庄 050200;2.北京安伯胚胎生物技术有限公司,北京 100089;3.河北天和肉牛养殖有限公司,石家庄 050200)
在牛胚胎生产中,通过经阴道超声穿刺吸取卵泡中的卵细胞(Ovum Pick-Up:OPU)的技术,完全与体外胚胎生产技术相关联,已成为有竞争力的、可替代超数排卵的一项技术(IVEP)[1]。据国际胚胎移植协会2016年的统计,2016年全球共生产OPU-IVP胚胎666 215枚,超过体内胚胎632 638枚的生产数量,占2016年牛胚胎生产总量的51.29%,比2015年OPU胚胎生产提高了8.73%;鲜胚及冻胚移植总量达448 113枚,占2016年移植胚胎总量的46.45%。
随着基因组选择技术在牛上的迅速发展,人们越来越有兴趣使用OPU-IVP技术来增加每个供体的胚胎数和后代数,从而增强下一代的选择强度。基因组选择将DNA标记技术和基因组学整合到传统的评价体系中,使经济性状的遗传进展速度提高了一倍,缩短了世代间隔,提高了选择准确性[2]。
自OPU-IVP技术兴起以来,如何优化体外胚胎生产的各个环节,提高OPU胚胎的生产效率,一直是众多研究的重点。本研究的目的是通过对OPU来源的卵母细胞使用不同系列的培养液培养、不同精子处理方法、不同脱颗粒细胞方法,比较其体外受精卵裂率和体外培养桑囊率,以从胚胎生产效率和操作简便程度两方面综合考虑,确定适合的培养液系统和操作方法,为进一步建立完善、高效的OPU胚胎生产体系提供试验依据。
1 材料和方法
1.1 主要仪器及设备
活体采卵操作系统(深圳迈瑞生物医疗电子股份有限公司);采卵针(MISAWA);CO2培养箱(Thermo 3131、Thermo 371,Thermo公司);恒温台(HP-4530,HOTPLATE);台式离心机(L-550,湘仪离心机仪器有限公司);生物显微镜(OLYMPUS SZ-STS);移液枪(Eppendorf);35mm培养皿(FALCON公司);15mL、50mL离心管(Corning公司);0.22μm滤器(美国Millipore公司)。
1.2 培养液系统
1.2.1 成品液
从美国MOFA公司购买的OPU全流程溶液(表1)。
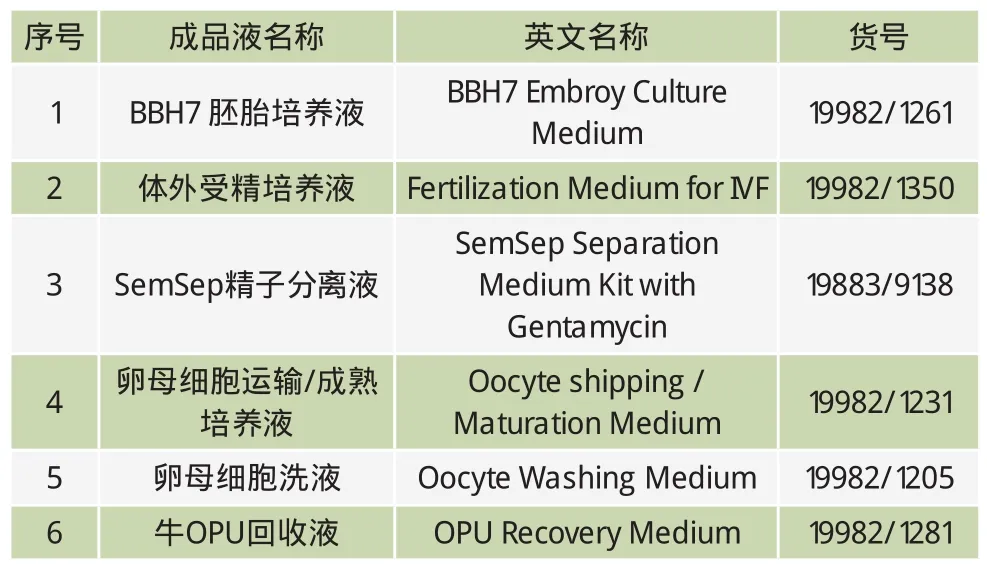
表1 美国MOFA公司OPU胚胎生产系列溶液
1.2.2 自配液系统
本试验所用TCM 199购自Gibco、胎牛血清购自赛默飞,其他试剂均购自Sigma。采卵液:0.22mg/mL丙酮酸钠,3.58mg/mL Hepes-钠,0.1mol/mL TCM199(10X),0.1461mg/mL L-谷氨酰胺,0.168mg/mL NaHCO3,0.01mg/mL肝素,0.060mg/mL青霉素,0.130mg/mL链霉素。卵母细胞体外成熟培养液:以TCM199(1x)为基液,加入10%FBS,0.01IU/mL FSH,0.01IU/mL LH,1μg/mL 雌二醇,50μg/mL肝素,100ng/mL IGF,50ng/mL EGF,双抗各100IU/mL。洗精液:以BO液为基液,加入10mmol/L咖啡因。受精液:以BO液为基液,加入20mg/mL BSA,20μg/mL肝素,双抗各100IU/mL。胚胎体外培养液:以mCR1aa为基液,加入6mg/mL BSA,20μL/mL EAA(50X),10μL/mL Non-EAA(100X),1.5mg/mL谷氨酰胺。
1.3 活体采卵
用石家庄天泉良种奶牛有限公司饲养的空怀或妊娠3个月以内的泌乳牛,在非超排情况下或经CIDR-FSH程序处理后40h,用深圳迈瑞B超仪(DP-50Vet)和B超探头(65C15EA)安装17G×600mm长针(MISAWA,日本)或18G短针(DI-0207-10,WTA,巴西),通过阴道穿刺采集OPU卵子。
1.4 体外培养
1.4.1 卵子体外成熟培养
取35mm培养皿,用完全成熟液做20μL的液滴,做6滴,覆盖3.5mL矿物油;之后,在每个20μL液滴中再加入30μL完全成熟液,做成50μL培养液滴。将培养盘放入38.5℃、5% CO2培养箱平衡3~5h。将用洗卵液洗好的COCs放入微滴中于CO2培养箱中培养22~24h。
1.4.2 精子处理方法
精子梯度离心法: 配制90% PS和45% PS的精液梯度离心液,进行梯度离心。第一次离心:700g、15min,去除上清液,留下一团约100μL的沉淀物,加900μL平衡好的受精液,将其混匀;第二次离心:300g、5min,去除上清液,留下一团约50μL的沉淀物。
精子非梯度离心法:在15mL离心管中加6mL洗精液及解冻后精子,进行两次离心:600g、6min。两次离心之间吸出上清液并补加相同体积洗精液,两次离心后轻轻吸出全部上清液,留下一团约50μL的沉淀物。
上述两种方法都要使用血细胞计数板进行精子计数。调节离心后精子浓度。
1.4.3 体外受精培养
成品液体外受精培养:取35mm培养皿,用完全受精液做50μL的液滴,做6滴,覆盖3.5mL矿物油;之后,在每个50μL液滴中再加入48μL完全受精液,做成98μL培养液滴。将培养盘放入38.5℃、5% CO2培养箱平衡3~5h。把用受精液洗好的成熟卵子放入微滴中,加2μL的精子悬液到每个受精滴中,使精子最终浓度为1×106/mL。将受精盘放回CO2培养箱中培养18~22h。
自配液体外受精培养:取35mm培养皿,用完全发育培养液做50μL的液滴,做6滴,覆盖3.5mL矿物油,将培养盘放入38.5℃、5% CO2培养箱中平衡3~5h。把用受精液洗好的成熟卵子放入微滴中,加50μL的精子悬液到每个受精滴中,使精子最终浓度为1×106/mL。将受精盘放回CO2培养箱中培养8~16h。
1.4.4 脱颗粒方法
机械洗涤法:准备4个35mm培养皿,其中均充入2/3平衡好的剥卵液,分别标注0、1、2、3;将假定的受精卵放入35mm培养皿中,用100μL移液枪轻轻吹打,直至卵丘细胞剥脱,然后依次在1、2、3号培养皿中洗卵。
涡流器震动法:把预温到38.5℃的BoviPRO 体外培养洗液点滴到培养皿里;将合子依次在 BoviPRO 体外培养洗液滴中转移洗涤之后放入40μL的体外培养洗液的1.5mL的离心瓶中;把离心瓶置涡流器上涡流2min;往离心瓶中加入500L体外培养洗液冲洗瓶壁,保证合子得到全部收复。
1.4.5 体外发育培养
将用完全发育培养液洗好的假定受精卵放入微滴培养盘,在38.5℃,5% O2、5% CO2、90% N2三气培养箱中培养7d,在第3天时快速统计卵裂率,第7天统计桑囊率。以上各步骤的微滴培养中,每滴里卵子或受精卵不超过10枚。
1.5 数据分析
采用SPSS 软件对试验数据进行分析,百分数比较时经反正旋转化后采用方差分析,结果以平均数±标准差表示,P<0.05为差异显著性标准。每头牛为一个重复处理,培养COCs数小于5枚的在统计数据中剔除。
2 结果与讨论
2.1 美国进口OPU成品液与自配溶液的OPU胚胎生产效率比较

表2 美国进口OPU成品液与自配溶液的OPU胚胎生产效率比较
本试验成品液组从活体采卵到OPU胚胎体外培养全过程全部使用美国MOFA公司OPU胚胎生产系列溶液,自配液组在OPU胚胎生产各环节中所用的溶液全部用Sigma制剂自行配制。两组IVC培养均在38.5℃,5% O2、5% CO2、90% N2三气培养箱中进行。如表2所示,成品培养液与自配液的卵裂率和桑囊率之间无显著差异(P>0.05)。虽然在实际操作中采用成品液能简化实验操作,提高稳定性,但自配液可以大大降低生产成本。同时,基于建立自主研发培养体系的目标,很有必要进一步对自配液的成分进行筛选优化。
2.2 不同精子处理方法的OPU胚胎生产效率比较
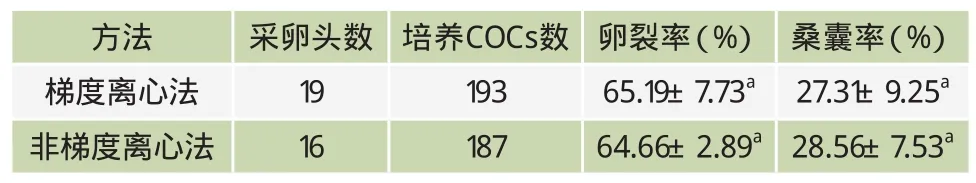
表3 不同精子离心方法的OPU胚胎生产效率比较
本试验两组全部采用自配溶液,在38.5℃,5% O2、5% CO2、90% N2三气培养箱中进行。如表3所示,两种精子处理方法获得的精子悬液对OPU卵子的受精能力无显著差异(P>0.05)。梯度离心法是规范的操作方法,离心效果稳定。在实际操作中非梯度离心法更简便易行,成本较低,但需要操作快速、准确,以免活精子与死精子再度发生混合。
2.3 不同脱颗粒细胞方法的OPU胚胎生产效率比较
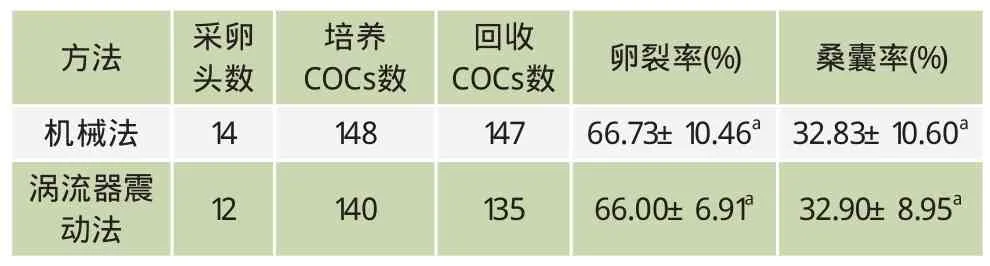
表4 不同脱颗粒细胞方法的OPU胚胎生产效率比较
本试验两组全部采用成品液,在38.5℃,5% O2、5% CO2、90% N2三气培养箱中进行。如表4所示,两种脱颗粒细胞方法的合子回收率、卵裂率、桑囊率均无显著差异(P>0.05)。涡流器震动法相对更快、更容易脱净颗粒细胞,但需要掌握适合的震动力度和时间、液体容量等参数,否则容易损伤和丢失卵子。机械法操作比较简单,但有时颗粒细胞不易吹打干净,需要稍长时间。试验显示,在技术娴熟的情况下,两种方法都可获得较好的效果。当卵子达15枚以上时选择涡流器震动法脱颗粒细胞效率更高。
3 讨论
本试验对卵母细胞体外培养中不同的培养液、不同的精子处理方法以及不同的脱颗粒细胞方法进行了对比,结果表明,进口成品培养液的桑囊率高于自配溶液(36.78% vs 24.10%),但差异不显著,不同的精子离心方法和扒卵方法也没有显著差异。在实际操作中采用成品液能简化操作,提高稳定性和效率。自配液不仅可以大大降低生产成本,而且可以根据不同的实验环境对自配液的成分进行筛选优化,实现建立自主研发培养体系的目标。
牛的精子离心大多采用两次离心法[3]。因为冻精或鲜精中含有许多可能阻碍受精的物质,如保护剂、精清、稀释液、死精及一定量的细菌等,对精子进行洗涤有助于筛选出高活力的精子及减少细菌污染的可能性。采用90%和45% Percoll 两种浓度形成梯度,可有效地去除精液中的白细胞、生精细胞、死精子、畸形精子等成分,能提取到高活力精子,明显提高精子前向运动率[4]。但也有研究报道,离心对精子DNA 完整性的改变并不是单向的,甚至有部分参数比处理前更差[5],离心过程容易对精子产生损伤,离心时间越长精子活力越低[6],离心过程中额外产生的氧化活性物质,包括超氧阴离子、过氧化氢、氢氧基、过氧羟自由基等可引起DNA的损伤[7]。本试验采用不同的方法对精子进行处理,结果表明没有显著差异。梯度离心法是规范的操作方法,离心效果稳定。非梯度离心操作更加简单,选择适当的离心力不仅能富集精子提高精子活力,还能得到更多DNA完整的精子,保证良好的受精效果。
卵子受精前颗粒细胞通过自分泌和旁分泌影响牛体外受精效果,在体外受精前,成熟卵母细胞部分脱除卵丘细胞组,体外受精胚胎卵裂率显著高于不脱除卵丘细胞组[8]。据报道,体外受精后不同颗粒细胞脱除方法对胚胎发育也有一定影响,采用振荡法脱除颗粒细胞的卵裂率和囊胚率均高于机械法[9]。采取人工机械吹打脱除卵丘细胞,操作耗时长且效率较低,卵母细胞过长时处于外界环境容易造成卵母细胞死亡或影响后期发育。本试验中两种方法的卵裂率和桑囊率差异均不显著。而且采用振荡法脱颗粒需要将胚胎放入离心管中利用涡流器震动脱除颗粒细胞,存在胚胎丢失风险。但在技术娴熟的情况下,两种方法都可获得较好的效果。

