基于钙激活氯离子通道的Piezo1通道调节剂高通量筛选模型的构建
丁 旭,肖云萍,郭佳琦,解宇浩,张嘉琪,聂文营,郝 峰
(1.吉林医药学院检验学院,吉林 吉林 132031;2.北华大学医学技术学院,吉林 吉林 132031)
2010年末,PATAPOUTIAN教授等[1]发现了感受机械力刺激并促使钙离子内流的机械压电通道Fam38A和Fam38B,并命名为Piezo1和Piezo2,之后相关研究快速成为热点,这2种通道的生理功能也逐渐清晰。机械压电通道Piezo在多种哺乳动物内皮细胞中均有表达[2],其中Piezo1能感受牵拉或按压的机械刺激并引发细胞外Ca2+内流[3],进而参与一系列非常重要的生理功能。有研究发现,Piezo1在血管及淋巴管发育、血压和红细胞体积调控上起到了重要的作用,抑制Piezo1的表达会导致淋巴管发育不良和溶血性贫血[4-5]。研究表明,Yoda1,Jedi1和Jedi2虽然可特异性地激活Piezo1通道,但Yoda1作为激活剂激活作用周期长,而Jedi1和Jedi2与Piezo1结合亲和力较低,需要较高浓度的Jedi才能引起激活[6]。现有的抑制剂Gd3+和钌红(ruthenium red,RR)均是广谱钙离子通道抑制剂[7],缺乏特异性。
电生理技术是研究离子通道的金标准,但此法不仅需要特定的仪器设备,对技术人员也有很高的要求。有研究者使用放射性离子和阴离子敏感的荧光染料以及化学发光的方法筛选激活剂和抑制剂,但需要特殊材料和复杂技术,且局限性较强[8-9],同时,每次实验均要重新制备样品,限制了方法的推广和应用。
钙激活氯离子通道蛋白anoctamin-1(ANO1)作为一种钙激活氯离子通道(calcium-activated chlo⁃ride channel,CaCC)能在Ca2+的作用下开放并向胞浆中转运Cl-和I-等卤素阴离子[10],但细胞内外均含有大量Cl-,细胞内Cl-会在一定程度上影响检测结果。不同于细胞内丰富的Cl-,I-在细胞内外含量极低,选用I-进行实验具有干扰低和易控制的优点。黄色荧光蛋白(yellow fluorescent protein,YFP)可在细胞内长久表达,其相对荧光强度高。YFP具有多种突变体,有遇卤素离子淬灭的特性,不同的突变体对不同的卤素离子敏感[11],其中双突变体YFP-H148Q/I152L对I-具有极高的亲和力[12]。基于此原理,本研究通过共表达ANO1-增强型绿色荧光蛋白(enhanced green fluorescent protein,EGFP,ANO1-EGFP)和YFP-H148Q/I152L的Fischer大鼠甲状腺(Fischer rat thyroid,FRT)上皮细胞,构建可用于研究Piezo1通道生理功能的高通量筛选模型,当Piezo1通道被激活时,内流的Ca2+引起CaCC开放,细胞外的I-内流可以引起YFP-H148Q/I152L淬灭。模型模式图见图1。本模型经济,快捷,可敏感地反映细胞内钙信号的变化,为Piezo1通道激活剂、抑制剂的筛选提供更优的解决方案,以及为其他Ca2+通道的调节剂高通量筛选方法的建立提供新的思路。

Fig.1Model diagram of Piezo1 channel screening model based on calcium-activated chloride channel(CaCC)and yellow fluorescent protein-H148Q/I152L(YFP-H148Q/I152L).A:Piezo1 channel was not activated and YFP emitted yellow fluorescence.B:Piezo1 channel was activated and the yellow fluorescence from YFP was quenched.
1 材料与方法
1.1 细胞、主要试剂和仪器
FRT细胞由Alan S VERKMAN教授馈赠,本实验室保存。所用引物由上海生工生物工程股份有限公司合成;胎牛血清(fetal bovine serum,FBS)(以色列Biological Industries公司);F-12培养基、Fura-2/AM、Yoda1、Jedi1、Jedi2和离子霉素(ionomycin)(美国Sigma公司);转染试剂Lipofectamine 3000(美国Thermo Fisher公司);Trizol、新霉素(neomycin)和平阳霉素(博来霉素,bleomycin)(美国Invitrogen公司);切胶回收试剂盒(上海生工生物工程股份有限公司);逆转录试剂盒、PCR试剂盒、全蛋白提取试剂盒和BCA蛋白测定试剂盒(全式金公司);兔抗大鼠Piezo1和Piezo2多克隆抗体、兔抗大鼠β肌动蛋白单克隆抗体和HRP标记的山羊抗兔IgG抗体(英国Abcam公司)。
FLUOstar Omega全自动多功能酶标仪(德国BMG公司),倒置荧光显微镜(日本Nikon公司),CO2培养箱(日本Panasonic公司),PCR仪(美国ABI公司),凝胶成像仪(美国Bio-Rad公司),Nano⁃drop 2000(美国Thermo Fisher公司)。
1.2 RT-PCR检测FRT细胞Piezo1 mRNA表达
设计大鼠Piezo1和Piezo2的引物各2对,取生长状态良好的FRT细胞株,按TRIzol说明书提取FRT细胞总RNA,Nanodrop2000测量总RNA浓度。使用逆转录试剂盒逆转录合成cDNA:将RNA模板和试剂盒成分按试剂盒说明书推荐的用量混匀,65℃孵育5 min后冰浴2 min,再加其余组分,在PCR仪中25℃孵育10 min后42℃孵育30 min。使用Nanodrop2000测定合成的cDNA浓度。PCR扩增,葡聚糖凝胶电泳60℃溶胶5 min,过柱纯化,得纯化的PCR产物。回收后的DNA溶液进行核酸测序。测序工作由上海生工公司完成。使用chro⁃mas软件检查测序峰,并用NCBI-BLAST对比核酸序列与测序结果。
1.3 Western印迹检测FRT细胞Piezo1和Piezo2蛋白表达
取生长状态良好的FRT细胞,按全蛋白提取试剂盒提取FRT细胞总蛋白,提取完成后使用Nano⁃drop 2000微量分光光度计在280 nm波长下测定浓度,并计算总蛋白量。加5×上样缓冲液20 μL,于100℃金属浴 15 min,13 523×g离心 5 min,取上清。每个孔上样20 μg总蛋白,恒压80 V电泳30 min。彩色marker分离后,更换电压120 V电泳60 min。切胶,转膜,100 V持续120 min。转好的膜置于5%的脱脂奶粉中进行封闭,于室温摇床上孵育2 h。TBS洗膜,洗膜完成加入一抗,4℃过夜,回收一抗,PBS洗膜3~4次,再加二抗孵育1 h,一抗和二抗均1∶1000稀释。洗完膜后,显色,成像。
1.4 FRT模型细胞构建和检测
1.4.1 共表达ANO1-EGFP和YFP-H148Q/I152L的FRT模型细胞构建
取已转入ANO1-EGFP/pcDNA3.1的大肠杆菌接入50 mL 2×YT培养基,过夜培养,按质粒小提取试剂盒说明书裂解细菌提取质粒。提取完成后,用Nanodrop 2000检测质粒的浓度和纯度,按Lipo⁃fectamine 3000试剂要求,取浓度500~5000 mg·L-1质粒备用。FRT细胞接种至24孔板,细胞密度达到70%~90%,按Lipofectamine 3000说明书在EP管中加入转染试剂、质粒和F-12基本培养液,室温孵育20 min。孵育前用PBS清洗细胞,去除残留的血清。每孔加F-12完全培养液450 μL。脂质体-质粒混合溶液孵育完成后,每孔滴加50 μL混合溶液,摇匀后置CO2培养箱37℃孵育48 h,在荧光显微镜下观察到绿色荧光,表示ANO1-EGFP转染成功。再加入含有平阳霉素的筛选培养基进行筛选。筛选2周后,对得到的细胞株进行有限稀释,利用倒置荧光显微镜观察,并选取荧光强度较高的细胞,即为表达量高的克隆株。得到高表达的克隆后,扩大培养细胞,并用倒置荧光显微镜观察荧光是否表达于细胞膜上。用同法提取YFP-H148Q/I152L质粒并转染表达ANO1-EGFP的FRT细胞,扩大培养细胞,并用倒置荧光显微镜观察荧光是否表达在细胞胞浆中。
1.4.2 荧光淬灭动力学实验鉴定转染ANO1-EGFP和YFP-H148Q/I152L后FRT模型细胞的生物学功能
将生长状态良好的FRT模型细胞铺于黑壁96孔板中,37℃过夜培养。PBS清洗2遍后,分别在FRT模型细胞中加含ANO1激活剂离子霉素(终浓度为 10 μmol·L-1)的 NaI-PBS 溶液(离子霉素组)和仅加Nal-PBS(PBS组),并应用FLUOstar Omega全自动多功能酶标仪动态检测相对荧光强度变化(0.2 s检测1次,共检测14 s)。原始数据由GraphPad Prism 8.0绘图,证实ANO1是否具有转运I-的功能以及YFP-H148Q/I152L是否对I-敏感,从而确定FRT模型细胞是否具有生物学功能。
1.5 模型细胞功能检测和Z′因子计算
1.5.1 荧光淬灭动力学实验检测模型细胞功能
实验分为PBS组、Piezo1激活剂和抑制剂组。PBS组仅向FRT模型细胞中加Nal-PBS,激活剂组包括Jedi1组(终浓度为 200 μmol·L-1)、Jedi2 组(终浓度为150 μmol·L-1)和Yoda1组(终浓度为20 μmol·L-1),抑制剂组为Gd3++Yoda1组(Gd3+和Yoda1终浓度均为20 μmol·L-1),激活剂组和抑制剂组均加NaI-PBS。应用FLUOstar Omega动态检测相对荧光强度,利用自定义的三次方程计算相对荧光强度变化(slope)值[11],并经统计学分析证实FRT模型细胞是否可用于Piezo1调节剂的筛选。
1.5.2 检测FRT模型细胞对不同激活剂的浓度效应
将生长状态良好的FRT模型细胞铺于黑壁96孔板中,37℃过夜培养。实验分为PBS组和激活剂组:PBS组仅向FRT模型细胞中加NaI-PBS,激活剂组包括离子霉素、Jedi1、Jedi2和Yoda1组,每组按 0.2,1,5,10,25,50,75,100,200,300,400,500,600,700,800,900和1000 μmol·L-1设置浓度梯度,激活剂组同时加NaI-PBS,每个浓度重复3次。记录各组相对荧光强度动态变化,并利用自定义的三次方程计算相对荧光强度变化值,GraphPad Prism 8.0软件绘制浓度依赖曲线。
1.5.3 Fura-2荧光探针法检测FRT模型细胞Ca2+浓度
FRT模型细胞消化离心后制成细胞悬液,加Fura-2/AM(终浓度为 5 μmol·L-1),37℃孵育30 min,并轻轻振动。采用无钙镁PBS缓冲液洗涤细胞1次,以去除细胞外残留的Fura-2/AM。离心后,加含钙镁PBS(Ca2+浓度为 2 μmol·L-1)缓冲液制成细胞悬液。在FLUOstar Omega全自动多功能酶标仪中使用340 nm和380 nm双激发源在510 nm处记录荧光强度,测定时记录静息时和加入Yoda1 0.2,1,5,10,25,50,75,100,200,300,400,500,600,700,800,900 和 1000 μmol·L-1的340 nm/380 nm荧光比值,按说明书中的计算方式根据荧光比值计算Ca2+浓度,结合FRT模型细胞检测Yoda1的浓度效应分析细胞内Ca2+浓度和相对荧光强度变化值的关系。
1.5.4 Z′因子评估
96孔板的前6列加Yoda1 100 μmol·L-1作为实验组,后6列加PBS缓冲液作为对照组,检测相对荧光强度变化值并计算Z′因子值。计算公式如下:Z′=1-3×(|sYoda1|+|sPBS|)/(|xYoda1|-|xPBS|)。式中,s为标准差,x为平均数。
1.6 统计学分析
所有实验重复3次,实验结果数据用±s表示,采用GraphPad Prism 8.0进行作图与统计学分析,使用单因素方差分析,配对样本t检验,以P<0.05为差异有统计学意义。
2 结果
2.1 FRT细胞中Piezo1 mRNA表达
以FRT细胞的cDNA为模板,应用2种Piezo1特异性引物分别扩增出401 bp和479 bp条带,β肌动蛋白基因在对应的泳道出现260 bp条带,与预期的目的片段大小相符(图2A)。2种Piezo2特异性引物均未扩增出条带(数据未显示)。Piezo1引物设计如表1。

Fig.2 Piezo1 mRNA expression in FRT cells by RT-PCR.A:the electropherogram of RT-PCR;B:gene sequencing peak map by chromas software;C:gene sequence alignment by NCBI-BLAST.
Piezo1条带的切胶回收产物测序结果在chromas软件上进行分析,测序峰图如图2B,测序峰峰型整齐,无重叠峰,竖线位置为内含子。所测核苷酸序列在NCBI-BLAST进行比对,与GenBank数据库收录的Piezo1的基因序列相似性为100%(图2C)。表明FRT细胞表达Piezo1mRNA。
2.2 FRT细胞中Piezo1蛋白表达
Western印迹结果显示,FRT细胞中β肌动蛋白表达清晰,有分子质量为287 ku的Piezo1蛋白表达,符合其理论值[13](如图3),Piezo2蛋白未出现对应条带。表明FRT细胞表达Piezo1。

Fig.3 Piezo1 protein expression in FRT cells by Western blotting.
2.3 FRT模型细胞的鉴定
荧光显微镜见,ANO1-EGFP清晰表达于胞膜上(图4A),YFP-H148Q/I152清晰表达于胞浆中(图4B)。离子霉素10 μmol·L-1组荧光淬灭;PBS组荧光不淬灭。表明表达于FRT细胞中的ANO1-EGFP具有I-转运的功能,YFP-H148Q/I152具有I-敏感的特性,证实FRT模型细胞构建成功(图5)。

Fig.4 Transfection of enhanced green fluorescent protein labled anoctamin-1(ANO1-EGFP)(A) and yellow fluorescent protein(YFP)-H148Q/I152L(B)to FRT cell,identification by fluorescence microscope.
2.4 FRT模型细胞筛选Piezo1调节剂的功能
FRT模型细胞加入Piezo1的3种激活剂Jedi1,Jedi2和Yoda1后荧光淬灭。Gd3++Yoda1组和PBS组荧光不淬灭(图6A)。与Yoda1组相比,PBS组和Gd3++Yoda1组slope值显著降低(P<0.01)(图6B),说明FRT模型细胞可用于Piezo1调节剂的筛选。

Tab.1 Design of Piezo1 primers
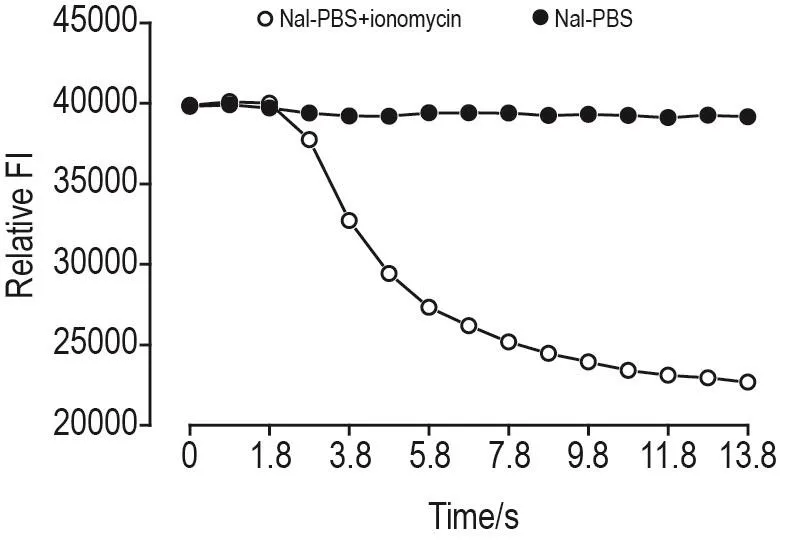
Fig.5 Effect of ionomycin 10 μmol·L-1on FRT model cells′relative fluorescence intensity(FI)by FLUO⁃star Omega.PBS:phosphate buffered saline
2.5 FRT模型细胞检测不同激活剂的浓度效应
FRT模型细胞离子霉素的EC50(μmol·L-1)为7.76±0.53,Yoda1的EC50为17.27±1.21,Jedi1的EC50为200.60±4.46,Jedi2的EC50为158.10±4.65(图7)。
2.6 FRT模型细胞相对荧光强度变化值与细胞内Ca2+浓度关系
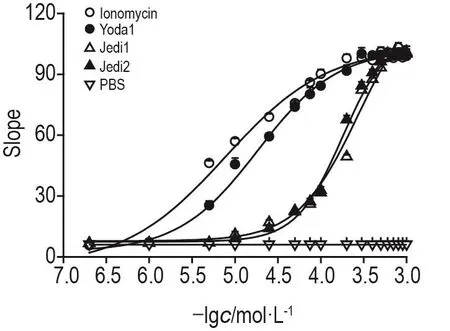
Fig.7 Concentration effect of different activators of ionomycin,Yoda1,Jedi1 and Jedi2 on FRT model cells.All test groups had concentration gradients of 0.2,1,5,10,25,50,75,100,200,300,400,500,600,700,800,900 and 1000 μmol·L-1.±s,n=4.
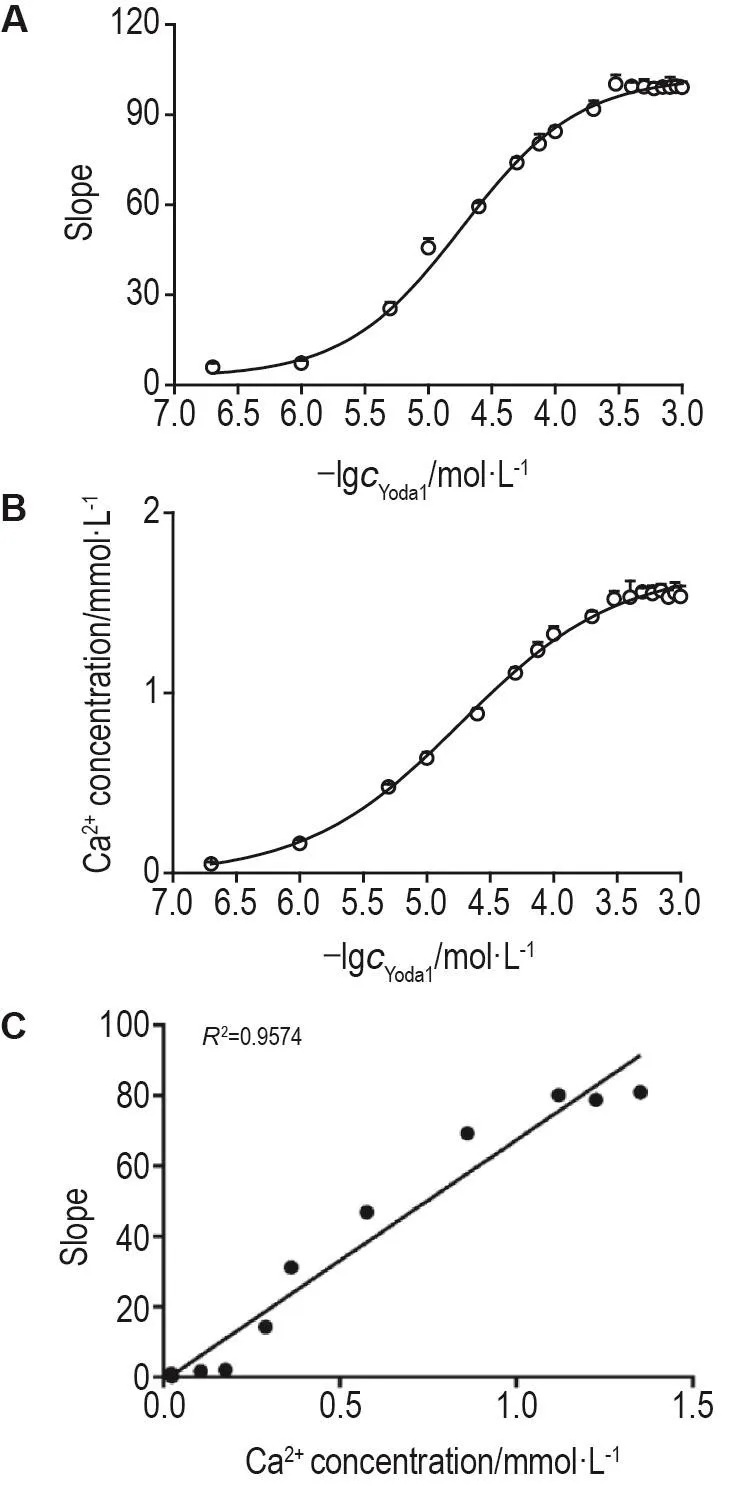
Fig.8 Relationship between fluorescence quenching slope of FRT model cells and intracellular Ca2+concen⁃tration.Fura-2/AM 5 μmol·L-1was added to FRT model cells,the 340 nm/380 nm fluorescence ratio was recorded at rest and after adding Yoda1 at concentrations of 0.2,1,5,10,25,50,75,100,200,300,400,500,600,700,800,900 and 1000 μmol·L-1,before the Ca2+concentration was calculated based on the fluorescence ratio(A);FRT model cells were added with Yoda1 at concentrations of 0.2,1,5,10,25,50,75,100,200,300,400,500,600,700,800,900 and 1000 μmol·L-1,the relative fluorescence intensity changes were recorded,and the slope was calculated(B);GraphPad Prism 8.0 software was used to discribe the relationship between slope and intracel⁃lular Ca2+concentration(C).±s,n=4.
结果显示(图8),随着Yoda1浓度的升高,Ca2+浓度越高,其浓度与Yoda浓度呈浓度依赖关系(R2=0.9924,P<0.05)〔图 8B,EC50为(18.68±1.28)μmol·L-1〕。结合FRT模型细胞相对荧光强度变化值对Yoda1的浓度效应(图8A),利用GraphPad Prism 8.0软件做出斜率值与细胞内Ca2+浓度关系(图8C),FRT模型细胞相对荧光强度变化值与细胞内Ca2+浓度呈正相关,且FRT模型细胞相对荧光强度变化值比细胞内Ca2+浓度值信号窗口更大。因此利用FRT模型细胞检测相对荧光强度变化值可敏感地反映细胞内Ca2+浓度的变化。
2.7 FRT模型细胞评估Piezo1调节剂Yoda1的Z′因子
经软件分析得Yoda1组的相对荧光强度变化值为85.60±2.21,PBS组的相对荧光强度变化值为6.44±1.55(图9B),信噪比为13.29∶1,计算得FRT模型细胞Piezo1调节剂Yoda1的Z′因子为0.82,大于0.5,表明细胞模型可用于Piezo1调节剂的高通量筛选(图9A)。

Fig.9 Z′factor of Piezo1 modulator Yoda1 evaluated with FRT model cells.Yoda1 100 μmol·L-1was added in the first 6 columns of a 96-well plate,and PBS was added as the control group in the last 6 columns,the slope value was detected(A)and the Z′factor value was calculated.Arrow in A shows magnified 4H;B:statistical chart of Z′factor test results.±s,n=4.**P<0.01,compared with PBS group.
3 讨论
通过向FRT细胞共转染ANO1-EGFP和YFPH148Q/I152L,本研究构建了可用于Piezo1通道调节剂高通量筛选的FRT模型细胞。通过验证结果表明,本研究建立的FRT模型细胞可用于筛选Piezo1通道调节剂,信噪比为13.29∶1。FRT模型细胞对离子霉素、Yoda1、Jedi1和Jedi2的浓度效应EC50(μmol·L-1)分别为7.76±0.53,17.27±1.21,200.60±4.46和158.10±4.65。Fura-2荧光探针实验证实,FRT模型细胞内Ca2+浓度对Piezo1激活剂呈浓度依赖关系,且Ca2+浓度变化与FRT模型细胞相对荧光强度变化值呈正相关,由于相对荧光强度变化值可反映离子通道开放情况,且比Ca2+浓度信号窗口更大,因此FRT模型细胞可以敏感反映细胞内Ca2+浓度的变化,模型Z′因子高达0.82,符合高通量筛选要求。
由于本模型本质上是通过荧光信号反映细胞内Ca2+浓度的变化进而筛选Piezo1,在快速、灵敏的同时存在一定的缺陷,以下因素可能会影响筛选结果:首先,考虑到FRT细胞可能内源性表达的如瞬时受体电位通道、酸敏感型离子通道1a、毒蕈碱型乙酰胆碱受体和嘌呤能受体等其他一些能升高细胞内Ca2+的G蛋白偶联受体或者通道[14-17],它们的激活和抑制都会影响到Piezo1通道调节剂的筛选。其次,一些对荧光信号有干扰作用的化合物也会严重影响筛选结果。此外,一些极性较高,且作用位点于细胞内的化合物,因其不能进入到细胞内,故很难通过本模型筛选。但本模型仅作为Piezo1的初筛模型,假阳性结果可通过后续实验分辨真伪。尽管本模型存在一些问题,但本模型快速、简便、经济和稳定性好的优点,仍可为筛选工作带来极大的便利。本团队目前已筛选300余种中药小分子化合物,尚未发现高活性的激活剂和抑制剂,下一步拟扩大筛选范围,如从核酸适配体和天然抗体库中筛选,以期发现高效特异的Piezo1调节剂。
综上,本模型是高通量筛选Piezo1通道调节剂的优秀解决方案。本模型的成功构建不仅为后续Piezo1通道调节剂筛选提供了优秀的解决方案,为Piezo1调节剂的临床应用奠定了基础,同时还为其他钙离子通道调节剂筛选方法的构建提供新思路。

