厄洛替尼联合全脑局部推量放射治疗肺腺癌伴多发性脑转移患者的临床疗效观察
瞿霏霏 钱晓涛 洪波 张华 王明慧 林琳
1中国科学院合肥肿瘤医院肿瘤科(合肥230011);2中国人民解放军联勤保障部队第902 医院肿瘤科(安徽蚌埠233000)
随着人类肿瘤疾病谱的改变,肺癌成为全世界发病率和死亡率排名首位的恶性肿瘤[1]。根据病理类型分类,80%以上为非小细胞肺癌(nonsmall cell lung cancer,NSCLC)。由于临床缺乏特异性表现,近半数NSCLC 患者在确诊时已发生脑转移,预后变差,自然生存期<3 个月[2]。其中腺癌发生脑转移的机率更大,可能是腺癌富含血管进而导致肿瘤细胞容易经血道播散而转移至颅内。由于肺腺癌传统一线化疗耐药性增加,临床疗效进入“瓶颈期”,晚期NSCLC 靶向治疗取得突破性发展,其中EGFR 第一代代表药物厄洛替尼成为关注最多的靶向治疗药物,不良反应少,一定程度上可以提高生活质量,且可延长患者中位生存期[3-4]。传统的脑转移瘤治疗模式为立体定向放疗(stereotactic radiosurgery,SBS)、全脑放疗、3DCRT 等,其中SRS 为针对颅内<4 个转移瘤的初始治疗[5]。由于临床上开展SRS 不仅受限于硬件和定位精度的高要求,同时限制于脑转移瘤体积与数目,全脑局部推量放疗(whole brain radiotherapy with simultaneous integrated boost,WBRT-SIB)在一定程度弥补这个缺陷,是SRS 的优质替代选择。WBRT-SIB 针对多发性脑转移瘤具有较强剂量优势,既可以提高肿瘤控制率又大限度减少对正常脑组织损伤[6]。本研究旨在探讨WBRT-SIB 联合厄洛替尼的临床应用价值,对该方案的可行性进行探讨,进一步为临床治疗提供参考。
1 资料与方法
1.1 临床资料选取我院2017年6月至2019年7月连续收治的45 例EGFR 突变的肺腺癌伴多发脑转移患者,所有患者均通过组织学或病理细胞学诊断肺腺癌明确。采用ARMS 法检测EGFR 基因敏感突变阳性;患者均经过含铂类一线化疗后检查发现多发脑转移,且颅内有可测量病灶且转移灶≥2个,治疗前无脑转移瘤手术及放疗史;入组患者均伴有脑转移瘤导致的中枢神经症状,具有放疗指征。预计患者生存期≥1个月;ECOG评分0 ~3分;放化疗前检查患者外周血中白细胞>4.0 × 109/L,血红蛋白≥110 g/L,血小板≥100 g/L,中性粒细胞计数≥1.5 × 109/L;本次治疗方案患者获知并签署知情同意书,得到医院伦理委员会审查批准。其中女24 例,男21 例,年龄41 ~82 岁(中位数57 岁)。按随机数字方法分为放疗组(23 例)和联合治疗组(22 例)。两组一般资料对比差异无统计学意义(P>0.05),见表1。
1.2 治疗方法放疗组:采用瑞典医科达公司Axesse 医用直线加速器,配备80 对在等中线处5 mm 投影宽度的多叶准直器叶片(MLC),具有旋转调强功能和四维图像引导功能。选择治疗能量为6 MV X 线,采用VMAT(旋转容积调强放射治疗)进行放疗,患者采取仰卧位,双手放置身体两侧,头部热塑面模固定头部,大孔径CT 模拟定位机进行增强CT 定位扫描,层厚3 mm,图像CT 通过网络传入放射治疗计划系统。采用MONACO5.11治疗计划系统,根据RTOG 全脑局部推量勾画指南勾画靶区,在增强扫描图像上勾画CTV 为全脑,GTV 为颅内肿瘤原发灶,考虑摆位误差,GTV 外扩0.3 cm 为PGTV,处方剂量:全脑放疗剂量,40 Gy/20F,2 Gy/F,5 次/周,脑转移瘤同期三维适形放疗剂量,50 Gy/20F,2.5 Gy/F,5 次/周,见图1。同时勾画危及器官,如双侧晶状体、眼球、脑干、双侧视神经、视交叉、和垂体。其中危及器官脑干最大剂量≤5 400 cGy;眼球最大剂量≤5 000 cGy;晶状体最大剂量≤500 cGy;视神经最大剂量≤5 400 cGy;视交叉最大剂量≤5 400 cGy,见图2。放疗物理师根据以上要求在TPS 上进行计划设计,采用双弧技术,±360°旋转,由两名医生确认放疗计划,放疗物理师做好计划验证后开始实施治疗。放化疗组:放疗期间同步口服厄洛替尼150 mg/d(上海罗氏制药有限公司,批号:国药准字J201220060,规格:150 mg,7 粒),至少服用28 d,放疗结束后继续 服用至患者无法耐受或疾病继续进展。
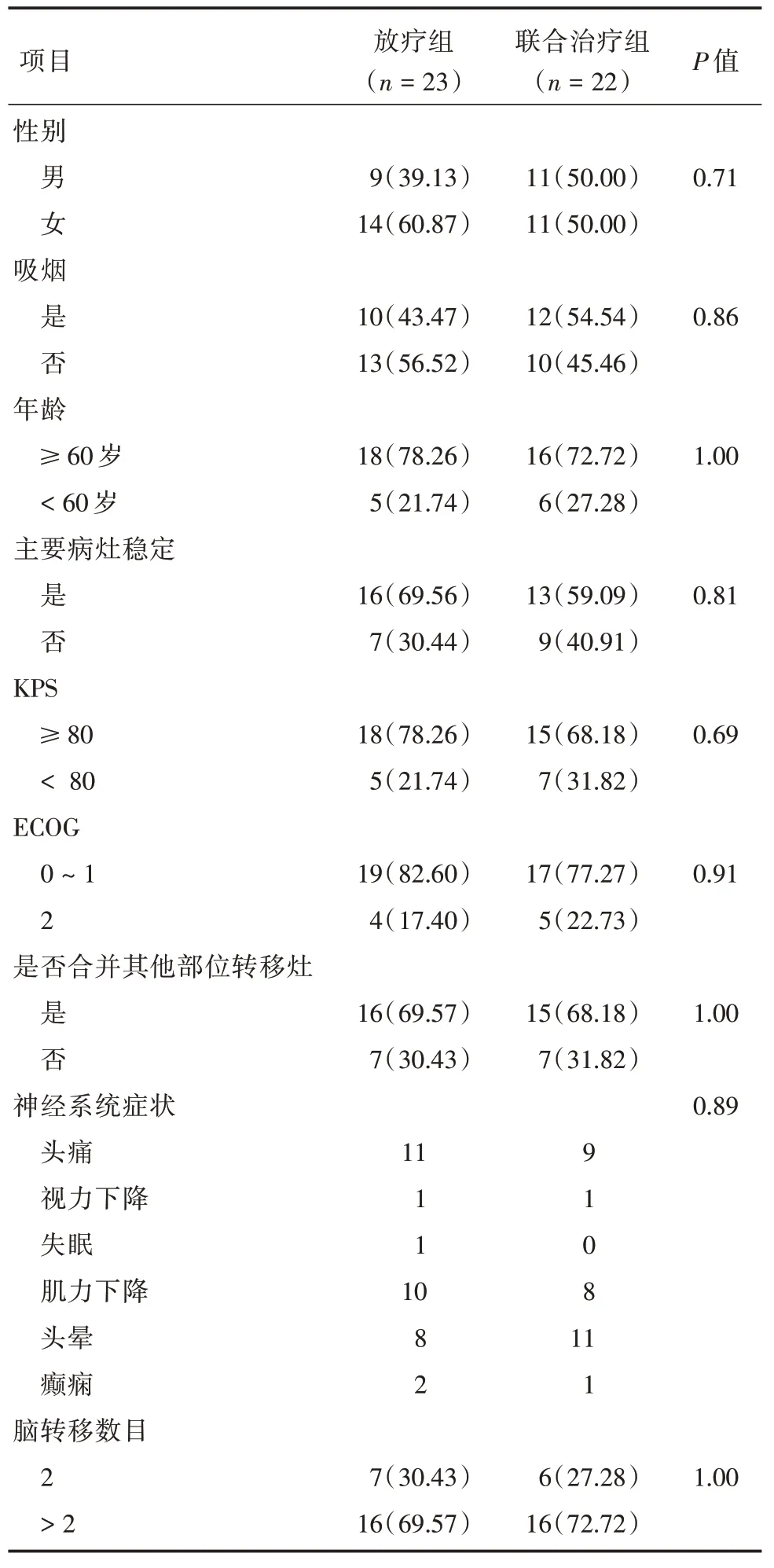
表1 两组临床资料比较Tab.1 Comparison of characteristics between two groups例(%)
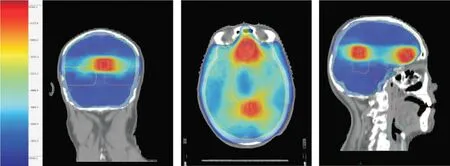
图1 肺癌脑转移全脑3 600 cGy 剂量分布图Fig.1 Dose distribution of 3 600 cGy for wholebrain radiotherapy on lung cancer patients with multiple brain metastases

图2 肺癌多发脑转移患者放疗靶区及正常组织DVH 图Fig.2 DVH for different targets and oragants at risk inlung cancer patients with multiple brain metastases
1.3 观察指标住院期间观察病情变化情况及治疗导致的相关不良反应,治疗结束后所有患者定期入院复查或门诊随访(头颅MRI、血常规及生化指标)。不良反应评价方法参照美国通用的药物毒性反应标准NCI-CT-CAE 3.0 分级标准进行评价,记录所有不良反应事件,例如骨髓抑制(白细胞、红细胞或血小板减少)、胃肠道反应(恶心、呕吐)及皮肤反应(脱发、皮疹)等。两组患者在放疗结束后约2 个月复查头颅MRI 评价疗效,严格按照实体瘤近期疗效标准(response evaluation criteria in solid tumors,RECIST1.1)进行评价,其中完全缓解(complete remission,CR):影像学上肿瘤病灶消失,所有新发或陈旧性病理性淋巴结短轴值必须小于10 mm;部分缓解(partial remission,PR):所有目标病灶直径及长径的总和缩小大于30%;稳定(stable disease,SD):肿瘤变化既达不到缓解标准,也达不到恶化标准;进展(progressive disease,PD):所有影像学可见目标病灶直径总和至少增大20%,且直径增加绝对值大5 mm,当机体出现其他部位新发癌灶同样视为病情进展恶化。临床治疗近期缓解率(response rate,RR)以CR+PR 计算。总生存期(OS)总生存期定义为:患者从入组参加临床试验直至死亡的时间,其中死亡时间包括任何原因造成的死亡。
1.4 统计学方法本研究采用回顾性研究方法,所有数据应用SPSS 19.0 统计软件进行统计学分析处理。两组计数资料组间比较采用卡方检验,计量资料采用t检验,疗效之间比较采用秩和检验。用Kaplan-Meier 方法计算术后生存期之间差异,同时绘制生存曲线,用Log-Rank 法检验两组生存率之间差异。P<0.05 为差异具有统计学意义。
2 结果
2.1 近期疗效观察指标两组患者的近期疗效比较:随访至2019年7月,联合治疗组CR 3 例(13.63%),PR 13 例(59.09%),SD 5 例(22.73%),PD 1例(45.45%)。放疗组CR1例(4.34%),PR 10例(43.47%),SD 9 例(39.13%),PD 3 例(13.04%)。两组RR 分别为77.72%和47.82%(P= 0.038),见表2。
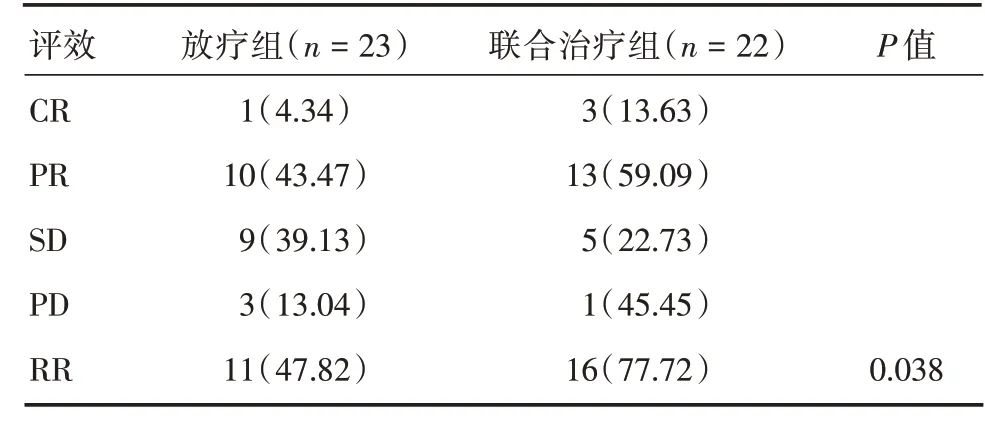
表2 两组近期疗效Tab.2 Comparison of the short-term effect of two groups例(%)
2.2 长期疗效观察指标两组患者中位随访11.5个月,放疗组失访1 例,联合治疗组失访1 例,长期存活1 例。联合治疗组的1年生存率59.09%(13/22)显著高于放疗组43.47%(10/23);联合治疗组中位生存时间14 个月显著高于放疗组10 个月,差异具有统计学意义(χ2= 5.013,Log Rank(Mantel-Cox)=9.314,P<0.05),见图3。
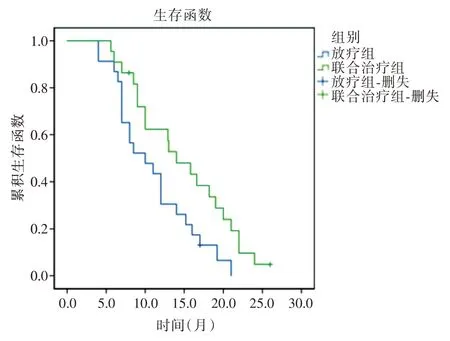
图3 两组患者生存曲线分析Fig.3 Kaplan-Meier survival curves of two groups
2.3 两组患者的不良反应情况治疗过程中两组患者除了颅内转移灶外均未出现新发转移灶。治疗过程中均未发生严重放射性脑坏死、脑出血及行为障碍等,不良反应均可耐受。放疗组表现出不良反应主要是骨髓抑制和乏力不适,1 例患者治疗中神经系统损伤可能与放射性脑水肿有关,最高度为3 度,发生率在4.34%左右。联合治疗组主要不良反应为皮疹和乏力,1 例患者出现Ⅲ级骨髓抑制,发生率4.54%,考虑由于入组前铂类化疗导致骨髓抑制。两组患者出现颅高压引起的相应症状时,经过甘露醇、地塞米松降颅压后均可好转。两组患者未观察到Ⅳ度以上不良反应,其中两组患者在皮疹、腹泻方面差异具有统计学意义(P<0.05),见表3。
3 讨论
NSCLC 是人类肿瘤发病率最高的肿瘤之一,主要类型包括鳞癌、腺癌、大细胞癌及小细胞癌等[7],约30%NSCLC 患者在就诊时即发现肺癌脑转移,其中约一半患者仅发生脑转移,伴随EGFR基因突变的肺腺癌患者发生脑转移机率会更高[8]。目前NSCLC 伴多发脑转移已经进入了化疗、手术、放疗及靶向治疗等综合治疗时代,其中放疗仍占据主导地位,放疗方式主要以WBRT 和SRS 为主,WBRT 曾是治疗肺癌脑转移的标准选择,在控制脑转移瘤的生长同时又可以消灭潜在微小转移瘤的产生,但由于剂量限制及会造成短期内认知能力下降,造成颅内肿瘤病灶控制不理想[9-10]。随着现阶段放疗技术的飞速发展,全脑放疗的地位逐渐下降,局部精确脑放疗地位得以提高[11],MOGRANAHAN 等[12]回顾性研究发现,SRS 的优势体现在于精准定位肿瘤,靶区剂量集中,保护周围组织等特点,逐渐代替全脑放疗的位置,但伴随目前研究的进展,单用SBS 治疗肺癌脑转移瘤由于仅针对转移病灶进行治疗,从而造成短期内增加新发转移的风险显著增加[13]。
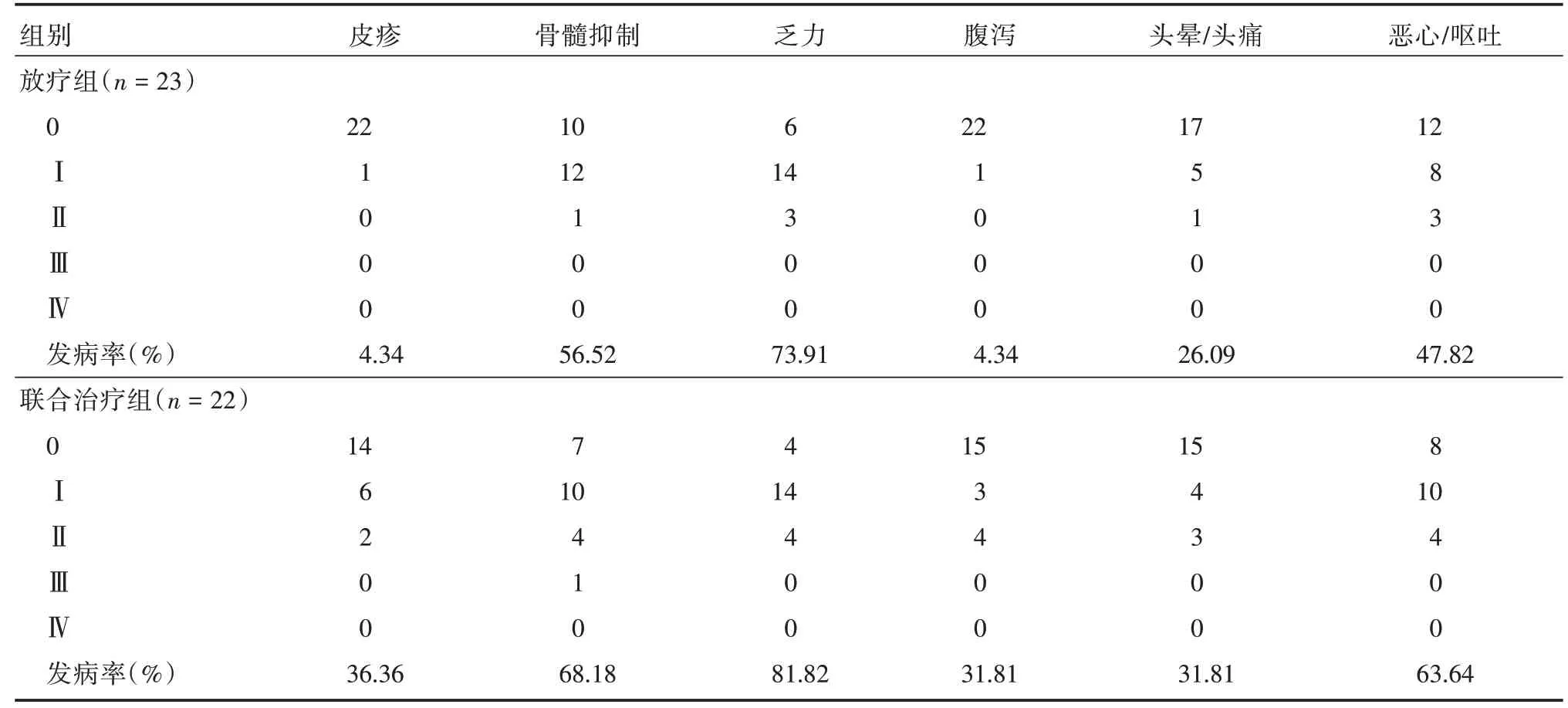
表3 两组不良反应发生率比较Tab.3 Comparison of adverse effects rate between two groups
厄洛替尼是第一代表皮生长因子受体酪氨酸激酶抑制剂(EGFR-TKI),作用机制主要是通过与AFP 竞争性结合EGFR,与细胞内部的有关成分相互竞争,对EGFR 磷酸化过程进行阻碍,抑制信号传导从而达到抑制肿瘤细胞的增殖和促进凋亡的目的,进而发挥抑癌作用[14]。针对EGFR 突变的肺腺癌多发脑转移的治疗,推荐以铂类为基础的两药联合化疗方案,由于化疗不良反应大,多数患者无法耐受,尤其是老年患者,同时由于多数化疗药物无法透过血-脑屏障,从而导致脑多发肿瘤控制欠佳。厄洛替尼相较于化疗药物分子结构小,其代谢活性产物能够有效的透过血-脑屏障,脑脊液渗透率高达近5%[15],与放疗联合使用时增加放疗诱导的肿瘤细胞凋亡,抑制细胞再增殖,同时修复放疗引起的损伤,进而放疗发挥协同作用,提高治疗效果[16]。
本次研究选择WBRT-SIB 联合厄洛替尼对比WBRT-SIB 治疗EGFR 阳性肺腺癌伴多发脑转移,WBRT-SIB 在保证局部控制率同时减少正常脑组织损伤及危及器官小剂量照射[17-18],兼顾GTV 与CTV 不同剂量的需求,实现非均匀照射,缩短治疗周期又能迅速改善因脑肿瘤引发的症状而提高患者的医从性。两组患者经过治疗后,WBRT-SIB 同步厄洛替尼较WBRT-SIB 近期有效率明显提高(77.72%vs. 47.82%,P= 0.038)。截止随访结束,WBRT-SIB 同步厄洛替尼较WBRT-SIB 的1年生存率(59.09%vs. 43.47%,P= 0.68)和中位生存时间(14个月vs.10个月,P=0.38)虽然对比无显著差异,但联合治疗患者1年生存率和中位生存时间均有所延长。此项结果进一步证实了WBRT-SIB 同步厄洛替尼可以提高EGFR 突变阳性肺腺癌伴脑转移的治疗效果,这与国内外研究结果相似[19-20],考虑原因为厄洛替尼可以极大的提高了放疗的敏感度[21],而放疗也进一步提高血脑屏障的通透性,使得厄洛替尼可以更好的被人体吸收,两者治疗上起到了相互协同作用。两组患者经过治疗后,仅一名患者视力下降未得到改善外,所有的症状均有所缓解。所有不良反应中联合组的主要不良反应为皮疹和乏力,皮疹发生率约36.36%,这与LEE等[22]研究结果相似,两组均未观察到Ⅳ度不良反应,患者可以较好的耐受治疗。
综上所述,对EGFR 突变的肺腺癌伴多发脑转移患者,采取WBRT-SIB 联合厄洛替尼治疗较单纯采用WBRT-SIB 能提高脑转移瘤局部控制率,中位生存期延长,不良反应小,使用方便,为临床治疗提供了另一种新的治疗选择。不足之处在于本次研究为回顾性分析,病例样本量较少,随访时间短,两组患者在随访截止均出现终点事件,存在删失数据,导致研究结果可能会存在偏倚,且未从神经认知功能评分方向进行专业性系统分析,以后工作将扩大样本量研究并长期随访以提高结论的说服力,同时将偏保护海马和前额叶等重要脑部结构放疗结构优化和相关预后因素等是今后研究方向。

