盐酸法舒地尔联合甲泼尼龙琥珀酸钠干预百草枯中毒致大鼠肺纤维化的效果
刘丰进 孙斌 马士鹏 孙凡婷 李瑞 张琼震 王曦 邱建清
滨州医学院附属医院(山东滨州256600)
百草枯(paraquat,PQ)中毒可致多器官损害,以肺损害更为突出,早期表现为急性肺损伤,晚期形成肺纤维化。临床中给予PQ 中毒患者有效的救治及时减轻毒性反应,是治疗的关键。转化生长因子-β1(transforming growth factor-β1,TGF-β1)具有广泛的细胞学作用,参与肺纤维化的形成,有研究表明减少该因子含量可减轻肺纤维化的程度[1-2]。盐酸法舒地尔(fasudil,FAS)是一种新型Rho/Rock 激酶抑制剂,近年来许多研究用其干预器官纤维化,已小有成效[3-5]。甲泼尼龙琥珀酸钠(methylprednisolone sodium,MSS)具有多种治疗用途,对于PQ中毒患者或动物的救治有一定效果[6-7]。
1 资料与方法
1.1 实验动物选取75 只健康Wistar 雄性大鼠(SPF 级),周龄7~8 周,体质量(200 ± 10)g,来源动物公司:山东省济南市朋悦实验动物繁育有限公司,饲养条件:滨州医学院附属医院SPF 级动物饲养房,实验已通过滨州医学院附属医院动物伦理委员会审批。
1.2 相关实验试剂20%百草枯试剂(山东天海科技有限公司),盐酸法舒地尔注射液(天津红日药业股份),注射用甲泼尼龙琥珀酸钠(Pfizer Manufacturing Belgium NV),苏木精-伊红染色液(北京索莱宝公司),MASSON 染色试剂盒(北京索莱宝公司),兔抗大鼠TGF-β1 抗体(北京中衫金桥公司),TGF-β1 酶联免疫分析ELISA 试剂盒(上海酶联生物科技公司)。
1.3 实验方法
1.3.1 分组与造模将75 只Wistar 雄性大鼠按照随机数表法分为5 组,每组15 只,即正常对照组(Cont 组)、百草枯中毒组(PQ 组)、甲泼尼龙琥珀酸钠干预组(MSS 组)、盐酸法舒地尔干预组(FAS组)、甲泼尼龙琥珀酸钠+盐酸法舒地尔干预组(MSS+FAS组)。预适养1周,造模前禁食禁水12 h。Cont 组采用一次性腹腔注射生理盐水1 mL 造模,其余4 组按PQ 20 mg/kg 用生理盐水将其稀释到1 mL一次性腹腔注射造模。在造模后1 h,给予Cont组、PQ 组腹腔注射1 mL 生理盐水,MSS 组、FAS 组、MSS+FAS 组分别给予腹腔注射0.5 mg/1 mL MSS、0.5 mg/1 mL FAS、MSS+FAS 各0.5 mg/1 mL,每日选取统一时间注射各组干预试剂,共计21 d。观察并记录各组大鼠的日常行为,在造模后于第7、14、21 天三个时间点每次处死5 只,给予水合氯醛麻醉后开胸取肺,将左肺组织固定于4%多聚甲醛用于制备石蜡切片,用于第21 天苏木精-伊红染色(HE 染色)、MASSON 染色、免疫组化,余下肺组织储存于-80 ℃冰柜中,用于制备3 个时间点肺组织匀浆完善酶联免疫分析(ELISA)。
1.3.2 HE、MASSON 染色取出已固定于4%多聚甲醛24 h的肺组织,流水冲洗,酒精梯度脱水,透明,浸蜡,包埋,修块和切片,展片、捞片、烘片,之后脱蜡进行HE、MASSON 染色。在400×光镜下观察各组肺组织病理学改变及肺组织纤维化程度。
1.3.3 免疫组化法测定TGF-β1已脱蜡好的石蜡切片采用高压锅热修复法进行抗原修复,抑制过氧化物酶活性,封闭,滴加一抗后过夜,按照(1∶200)滴加TGF-β1 抗体,DAB 显色,复染,脱水,透明,封片。在400×光镜下观察TGF-β1 的表达情况,采用Image Pro Plus 6.0计算TGF-β1的平均光密度值(OD值),进行半定量分析。
1.3.4 ELISA 测定TGF-β1 含量取出各时间点储存于-80 ℃的肺组织,制备匀浆,采用双抗体夹心法测定TGF-β1 的ELISA 试剂盒,严格按照试剂盒步骤操作,最后测定各反应孔吸光度值,根据吸光度值折算出肺组织匀浆中TGF-β1 实际含量。
1.4 统计学方法所得TGF-β1 的免疫组化OD值和ELISA 测定TGF-β1 含量的数据应用SPSS 24.0软件进行统计分析,用均值±标准差表示,多组间比较采用单因素方差分析,两组间比较采用LSD-t检验。若方差不齐用秩和检验。P<0.05 为差异有统计学意义。同时应用GraphPad Prism 5.0 绘制统计图。
2 结果
2.1 各组大鼠日常表现PQ 造模前,所有大鼠在预养适应期内均正常饮食饮水、行动活跃、精神状态饱满。用PQ 染毒造模后,大鼠中毒最典型的表现是早期鼻翼煽动加快及呼吸急促,精神状态不佳,人为刺激后躲避性差,行动极为迟缓,活动平衡性差,毛发黯淡无光且蓬松,PQ 组大鼠中毒表现最为严重,甚至PQ 组中有些大鼠出现了肉眼血尿。PQ 组大鼠进食量在中毒后明显减少,随着时间进展PQ 组大鼠体重较前明显下降。而FAS 组、MSS 组、FAS+MSS 组相对于PQ 组来说中毒症状较轻,精神状态尚可,对于刺激反应相对敏感。
2.2 解剖后大鼠肺脏外观解剖后可见各时间点Cont 组大鼠肺脏颜色红润,表面光滑,触碰后质地柔软、弹性极佳。PQ 组第7 天大鼠肺脏较Cont 组略有增大,称重后重量比Cont 组肺脏重,提示有肺水肿的可能,弹性尚可。第14 天可见肺脏表面有红白交替的团块,弹性与Cont 组比较明显变差。第21 天肺脏颜色暗淡,表面粗糙且凹凸不平,弹性差。FAS 组、MSS 组、FAS+MSS 组各时间点肺脏较Cont 组均有不同程度的改变,但不如PQ 组明显。
2.3 HE 染色、MASSON 染色、TGF-β1 免疫组化结果见图1-3,Cont 组肺组织结构清楚,未见炎性细胞、成纤维细胞的聚集,TGF-β1 无明显阳性表达。PQ 组肺组织结构紊乱,有大量炎性细胞的浸润和成纤维细胞增生,形成弥漫性纤维化,同时TGF-β1 有明显的强阳性表达。FAS 组、MSS 组、FAS+MSS 组与Cont 组相比,仍有弥漫性纤维化,但与PQ 组相比,病变区域多呈局灶性分布,炎性细胞及成纤维细胞的数量少于PQ 组,肺纤维化程度不如PQ 组,TGF-β1 的阳性表达弱于PQ 组。
2.4 TGF-β1 免疫组化OD值、ELISA 测定TGFβ1 含量与PQ 组比较,FAS 组、MSS 组、FAS+MSS组OD值明显降低(P<0.05)。FAS+MSS 组分别与FAS 组、MSS 组比较差异有统计学意义(P<0.05),而FAS 组与MSS 组比较差异无统计学意义(P>0.05)。见表1。

图1 第21 天各组大鼠肺组织HE 染色Fig.1 HE staining of the lung tissues of rats in each group on day 21
表2 各时间点每组大鼠肺匀浆中TGF-β1 的含量Tab.2 The contents of TGF-β1 in lung homogenate in each group at each time point ±s,pg/g

表2 各时间点每组大鼠肺匀浆中TGF-β1 的含量Tab.2 The contents of TGF-β1 in lung homogenate in each group at each time point ±s,pg/g
注:与Cont 组比较aP <0.05;与PQ 组比较bP <0.05;与FAS+MSS 组比较cP <0.05
分组Cont组PQ组FAS组MSS组FAS+MSS组例数15 15 15 15 15第7天159.898±11.835 291.425±9.595a 254.176±8.724abc 246.269±7.627abc 216.187±7.657ab第14天162.691±8.959 388.598±11.519a 341.471±12.204abc 337.793±13.446abc 303.169±10.887ab第21天163.329±10.544 571.377±17.427a 494.359±20.809abc 486.849±20.525abc 446.644±20.751ab
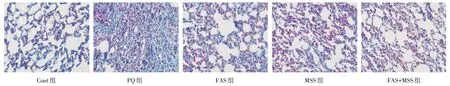
图2 第21 天各组大鼠肺组织MASSON 染色Fig.2 MASSON staining of the lung tissues of rats in each group on day 21

图3 第21 天各组大鼠肺组织TGF-β1 免疫组化Fig.3 TGF-β1 immunohistochemicaling of the lung tissues of rats in each group on day 21
表1 第21 天各组大鼠肺组织TGF-β1 的表达Tab.1 Expression of TGF-β1 in lung tissues of rats in each group on day 21 ±s

表1 第21 天各组大鼠肺组织TGF-β1 的表达Tab.1 Expression of TGF-β1 in lung tissues of rats in each group on day 21 ±s
注:与Cont 组比较aP <0.05;与PQ 组比较bP <0.05;与FAS+MSS 组比较cP <0.05
分组情况Cont 组PQ 组FAS 组MSS 组FAS+MSS 组例数5 5 5 5 5 TGF-β1 0.116±0.071 0.234±0.019a 0.188±0.089abc 0.190±0.078abc 0.152±0.073ab
除Cont 组外,各时间点PQ 组TGF-β1 含量最多,FAS+MSS 组含量最少。药物干预组在各时间点TGF-β1 含量与PQ 组相比差异均有统计学意义(P<0.05),以FAS+MSS组最为显著。FAS组与MSS组相比差异无统计学意义(P>0.05),FAS+MSS 组效果优于FAS 组、MSS 组(P<0.05)。见表2、图4。
3 讨论
PQ 中毒患者的生存及预后取决于PQ 中毒时间及服毒量,尽早给予洗胃、导泻、透析、血液灌注等治疗是减少PQ 吸收的有效途径,PQ 随着血液循环蓄积在体内各个脏器,造成多器官损伤,以肺损害最为突出,而肺纤维化是PQ 中毒死亡的主要原因[8]。PQ 所致肺纤维化与多种因素有关,如氧化应激、线粒体损伤、细胞因子的激活等[9-10]。TGF-β1 表达上调是PQ 致肺纤维化过程中的重要因素,正常情况下仅有少量表达,受到PQ 刺激后,TGF-β1 加速在肺组织表达使细胞外基质过度蓄积[11-12],不仅自身加速肺纤维化的进程,又与多种促纤维化因子相互联系,如:α-SMA、CTGF 等均起到协同作用,共同促进纤维化[13-14]。

图4 各时间点每组大鼠肺匀浆中TGF-β1 的含量Fig.4 The contents of TGF- β1 in lung homogenate in each group at each time point
Rho/Rock 通路能够参与多种生物学效应[15],在某些刺激因素作用下,通过激酶连锁反应,使炎性细胞激活促进氧化应激,也使致肺纤维化因子异常增多,进而产生过多的细胞外基质造成肺纤维化[16]。作为Rho/Rock 通路激酶抑制剂的盐酸法舒地尔,在治疗缺血性脑疾病方面已卓有成效。随着Rho/Rock 通路研究的开展,在方建江等[17]研究中可知,PQ 组大鼠随着中毒时间的进展,CTGF、ROCK1 mRNA 及蛋白的表达逐渐增多,证实Rho/Rock 通路参与肺纤维化的形成,盐酸法舒地尔通过抑制CTGF、ROCK1 mRNA 及蛋白的表达减轻PQ 中毒所致的大鼠肺纤维化程度。何旭娟等[18]研究,PQ 组大鼠较法舒地尔干预组有典型的病理学改变,法舒地尔干预组通过下调α-SMA mRNA及蛋白的表达来减弱肺纤维化的程度,证实Rho/Rock 通路可以通过调控α-SMA 来参与PQ 所致肺纤维化的进程。也有研究[19-20]发现,盐酸法舒地尔可以通过调控致肺纤维化因子的表达、减轻炎性细胞的浸润和氧化应激反应、抑制成纤维细胞的分化,降低肺组织中羟脯氨酸的含量,表明盐酸法舒地尔可以有效的抑制肺纤维化。
甲泼尼龙琥珀酸钠作为经典的糖皮质激素,具有广泛的非特异性,能迅速地在抗炎、抑制免疫功能等方面发挥重要作用。它能够稳定溶酶体、线粒体膜,防止细胞因中毒而溶解,又抑制如白介素、肿瘤坏死因子等炎性因子的激活,干预氧化应激反应,从而减轻中毒导致的肺损伤[21]。可是,长期应用激素干预PQ 中毒患者,很容易诱发二次感染、骨坏死等并发症,对于激素剂量的选择和干预时间,目前仍有争议。FENG 等[22]通过构建PQ 中毒大鼠模型,给予甲强龙冲击干预后延续治疗,可以明显改善大鼠存活率及肺纤维化程度,取得较好收益。结合PQ 中毒患者的临床表现、检查指标等,确定激素的干预时间,采取合理的剂量和疗程,尽可能减少并发症,甲泼尼龙琥珀酸钠可以大大提高PQ 中毒患者的生存率并改善PQ 中毒所致的肺纤维化[7,23]。
本研究通过构建PQ 中毒致大鼠肺纤维化模型,通过观察各组大鼠中毒后表现,采用HE 染色、MASSON 染色、免疫组化等方式发现除Cont 组外各组大鼠均有不同程度的中毒表现和肺纤维化的形成,ELISA 测定各组各时间点TGF-β1 的含量表明,盐酸法舒地尔和甲泼尼龙琥珀均可减轻肺纤维化的程度,二者联合效果更佳。综上所述,很多动物研究表明Rho/Rock 通路与肺纤维化的形成有密切联系,盐酸法舒地尔可以有效抑制肺纤维化的程度,在此基础上联合应用甲泼尼龙琥珀酸钠可取得更好的治疗效果。目前,PQ 所致肺纤维化仍是不可逆转,甚至在采用体外膜肺(ECMO)技术下[24],患者治疗花费较大且结局也不乐观,同样地各种因素导致的肺纤维化疾病也是临床救治的重点和难点,盐酸法舒地尔作为临床上目前唯一的Rho/Rock 通路抑制剂,在原有治疗的基础上,可能为肺纤维化的治疗提供一个新的思路,也为其自身研究提供了新的方向。由于条件所限,本实验未完善Rho/Rock 通路参与PQ 所致的肺纤维化的相关机制的研究,后续可进一步扩大样本量,深化相关机制的研究,为其能够应用于临床治疗肺纤维化提供更为充足的理论基础。

