依沙佐米通过mTOR/p70S6K信号通路诱导食管鳞癌细胞凋亡
杨亮 石科 李敏霞 郭丹
河南医学高等专科学校微生物与免疫学教研室(郑州451191)
食管鳞癌是我国高发的恶性肿瘤之一,其发病率和病死率都很高[1],预后差且易复发,75%的患者确诊后1年内死亡,5年生存率仅为5%~10%[2]。
最近研究表明蛋白酶体抑制剂是临床上有效的抗癌治疗方法,蛋白酶体抑制剂通过抑制26S蛋白酶体的活性,阻断参与细胞凋亡调控及信号传导的蛋白质的降解,诱导细胞凋亡,在靶向癌症治疗中变得越来越重要[3-5]。依沙佐米(Ixazomib)是一种可口服的蛋白酶体的可逆性抑制剂,通过结合并抑制20S 蛋白酶体的β5 亚基而发挥作用,目前用于治疗多发性骨髓瘤[6-8],研究表明依沙佐米也可以抑制多种实体瘤的生长[9-12],然而依沙佐米对食管鳞癌细胞的影响未见报道。
食管鳞癌细胞中存在异常激活的mTOR 信号通路,并且分化程度越低mTOR 信号通路的激活水平越高[13-14]。此外,在食管癌组织标本中mTOR信号通路也处于激活状态,mTOR 和p-mTOR 以及下游分子的表达升高,而磷酸酶和tensin 蛋白的表达降低[15]。依沙佐米对食管鳞癌细胞的作用是否与mTOR/p70S6K 信号通路有关仍不清楚,因此本研究将探讨蛋白酶体抑制剂依沙佐米是否通过调控mTOR/p70S6K 信号通路参与食管鳞癌细胞的凋亡。
1 材料与方法
1.1 材料
1.1.1 细胞人食管鳞癌细胞系KYSE-140和KYSE-150 用含10%胎牛血清的RPMI 1640 培养基,置37 ℃,5%CO2培养箱中进行培养。
1.1.2 试剂依沙佐米(Selleck,美国),CCK-8细胞增殖检测试剂盒(Beyotime,中国),Cell-Light EdU细胞增殖检测试剂盒(RoboBio,中国),Annexin VAPC/7-AAD 细胞凋亡检测试剂盒(KeyGEN Biotech,中国),细胞总蛋白提取试剂盒(Solarbio,中国),增强型化学发光试剂盒(Thermo,美国),Caspase-3 荧光测定试剂盒(BioVision,美国),SYBR®Green RT-qPCR(Sigma,美国),mTOR 抗体、p70S6K抗体、p-mTOR 抗体、p-p70S6K 抗体、4E-BP1 抗体和GAPDH 抗体(Sant Cruze,美国)。
1.2 方法
1.2.1 细胞活力的检测分别采用CCK-8 法和Edu 法检测蛋白酶体抑制剂依沙佐米对食管鳞癌细胞KYSE-140 和KYSE-150 增殖的影响。将细胞接种在6 孔板中过夜培养,用不同浓度的依沙佐米(0、10、20、30、40 nmol/L)处理细胞24 h,CCK-8试剂盒检测细胞增殖能力。同时用Cell-Light EdU细胞增殖检测试剂盒检测细胞增殖,即向细胞培养基中加入EdU(50 μmol/L)继续培养2 h,用4%多聚甲醛固定细胞30 min,加入100 μL Apollo 染色液,避光室温孵育30 min,用含0.5%Triton X-100的PBS 清洗,加入Hoechst 33342 避光孵育30 min使DNA 染色。
1.2.2 细胞凋亡检测将细胞接种于6 孔板过夜培养,用不含EDTA 的胰酶消化细胞,并用含2%BSA 的PBS 清洗三遍,Annexin V-APC/7-AAD 细胞凋亡检测试剂盒检测细胞凋亡,FACSCalibur 流式细胞仪分析细胞凋亡,Annexin V-APC 阳性细胞判定为凋亡细胞。用Cell Quest 3.0 软件进行参数获取和数据分析,计算凋亡细胞的百分比。
1.2.3 Caspase-3 激酶活性检测用caspase-3 荧光测定试剂盒检测细胞caspas-3 活性,将细胞和DEVD-AFC 底物于37 ℃孵育1 h 对细胞进行染色,DEVD 多肽断裂后产生荧光,用FACSCalibur 流式细胞仪进行检测。
1.2.4 RT-qPCR检测基因mRNA表达水平用Trizol法提取细胞总RNA,反转录后用SYBR®Green RTqPCR 试剂盒检测mTOR、p70S6K 及4E-BP1 基因的表达,引物如表1 所示,反应体系:SYBR Master Mix溶液15 μL,cDNA模板1 μL,上下游引物各1 μL,双蒸水7 μL。反应程序为:95 ℃预变性3 min;95 ℃30 s,58 ℃30 s,72 ℃5 min,共30 个循环;4 ℃终止反应。

表1 RT-qPCR 基因引物序列Tab.1 Gene primer sequences of RT-qPCR
1.2.5 Western blot检测蛋白表达水平用细胞总蛋白提取试剂盒提取食管鳞癌细胞总蛋白,SDSPAGE 分离样品蛋白质并转移至PVDF 膜,与一抗4 ℃过夜孵育,再与HRP 标记的二抗室温孵育2 h,然后用增强型化学发光试剂盒进行显色。Image J软件对各条带进行灰度分析。
1.3 统计学方法所有实验至少重复三次,计量资料以均数±标准差表示。两组之间的差异进行t检验分析,P<0.05 为差异具有统计学意义。
2 结果
2.1 依沙佐米对食管鳞癌细胞增殖能力的影响分别用不同浓度(0、10、20、30、40 nmol/L)的依沙佐米处理食管鳞癌细胞(KYSE-140 和KYSE-150)24 h,CCK-8 法检测细胞增殖能力。结果显示低浓度的依沙佐米(10 nmol/L)即可抑制KYSE-140 和KYSE-150 细胞的增殖,与对照组(0 nmol/L)相比差异有统计学意义(P<0.05)。细胞的增殖能力随着依沙佐米浓度的增加而下降,说明依沙佐米对食管鳞癌细胞增殖的抑制存在剂量依赖性。当依沙佐米的浓度达40 nmol/L 时,KYSE-140 和KYSE-150 细胞活力仅有31.3%和20.3%(图1A)。用20 nmol/L 的依沙佐米处理细胞12 h 即可显著抑制细胞的增殖(P<0.05),且抑制程度随着时间的延长而升高(图1B)。Edu 结果显示依沙佐米可以抑制食管鳞癌细胞的增殖,与对照组相比差异有统计学意义(P<0.05,图2),与CCK-8 结果一致。
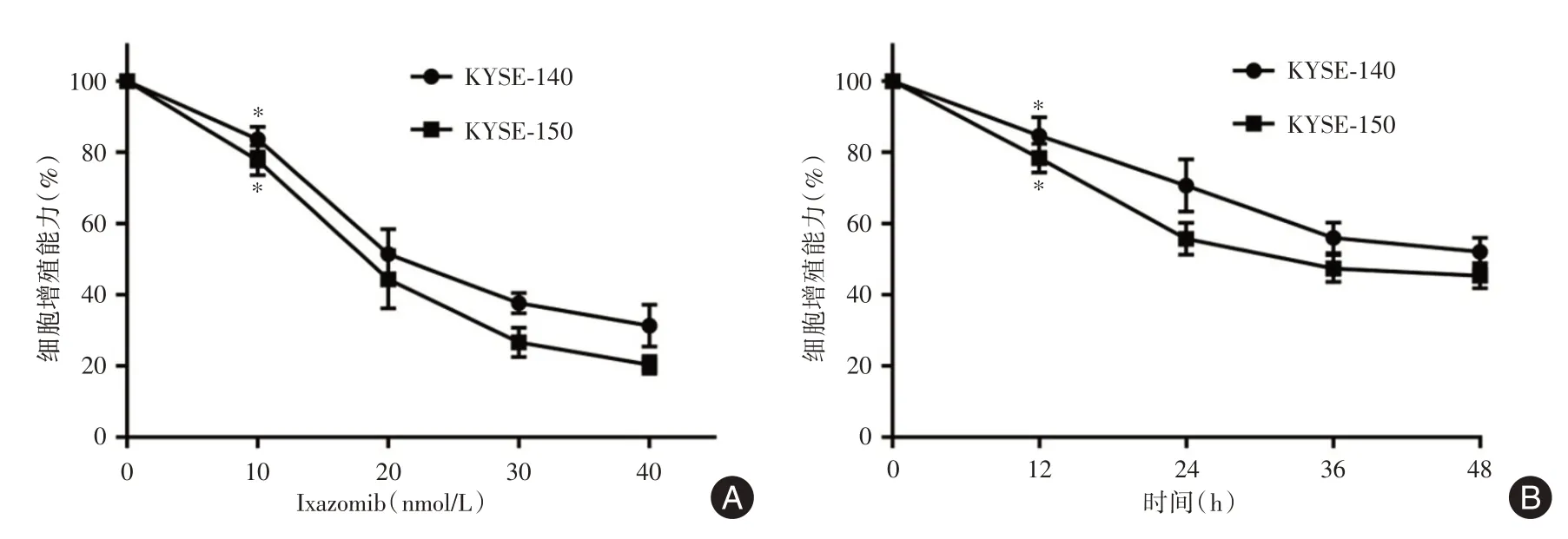
图1 CCK-8 检测细胞增殖结果Fig.1 Results of cell proliferation by CCK-8

图2 Edu 检测细胞增殖结果Fig.2 Cell proliferation results by Edu assay
2.2 依沙佐米对食管鳞癌细胞凋亡的影响用流式细胞仪检测依沙佐米(20 nmol/L)对食管鳞癌细胞凋亡的影响结果见图3A 和3B,依沙佐米处理KYSE-140 和KYSE-150 细胞24 h 后,细胞凋亡率分别为30.67%和34.33%,与对照组相比细胞凋亡率显著升高(P<0.05,图3C)。此外,依沙佐米可以增强食管鳞癌细胞的caspase-3 活性(P<0.05,图3D)。Western blot结果显示与对照组相比,依沙佐米处理组的cleaved caspase-3 的表达显著增高(P<0.05),其中KYSE-140 细胞增加了2.16 倍,KYSE-150 细胞增加了3.07 倍(图3E、F),并且处理组出现了PARP的裂解产物cleaved PARP,而对照组未见PARP 的裂解(图3E)。磷酸化的p38 被鉴定为凋亡激活标志物[7],依沙佐米处理后p-p38 的表达显著升高(P<0.05),其中在KYSE-140细胞中升高了1.74倍,在KYSE-150 细胞中升高了2.17 倍(图3G),说明依沙佐米可以诱导食管鳞癌细胞的凋亡。
2.3 依沙佐米对mTOR/p70S6K信号通路的影响与对照组相比依沙佐米处理后KYSE-140 和KYSE-150 细胞mTOR 基因的mRNA 表达水平均显著下降(P<0.05),且mTOR 两个下游靶基因p70S6K 和4E-BP1 的mRNA 表达也受到了抑制(P<0.05)。见表2。Western blot 结果显示,依沙佐米处理后KYSE-140和KYSE-150细胞中mTOR蛋白的表达显著下降,与对照组相比差异有统计学意义(P<0.05,图4A、B),p70S6K 和4E-BP1 蛋白的表达没有明显变化(P>0.05),而p-p70S6KThr421/Ser424 和p-4EBP1Thr36蛋白的表达显著下降(P<0.05,图4C-F),说明依沙佐米可以抑制食管鳞癌细胞的mTOR/p70S6K 信号通路。
3 讨论
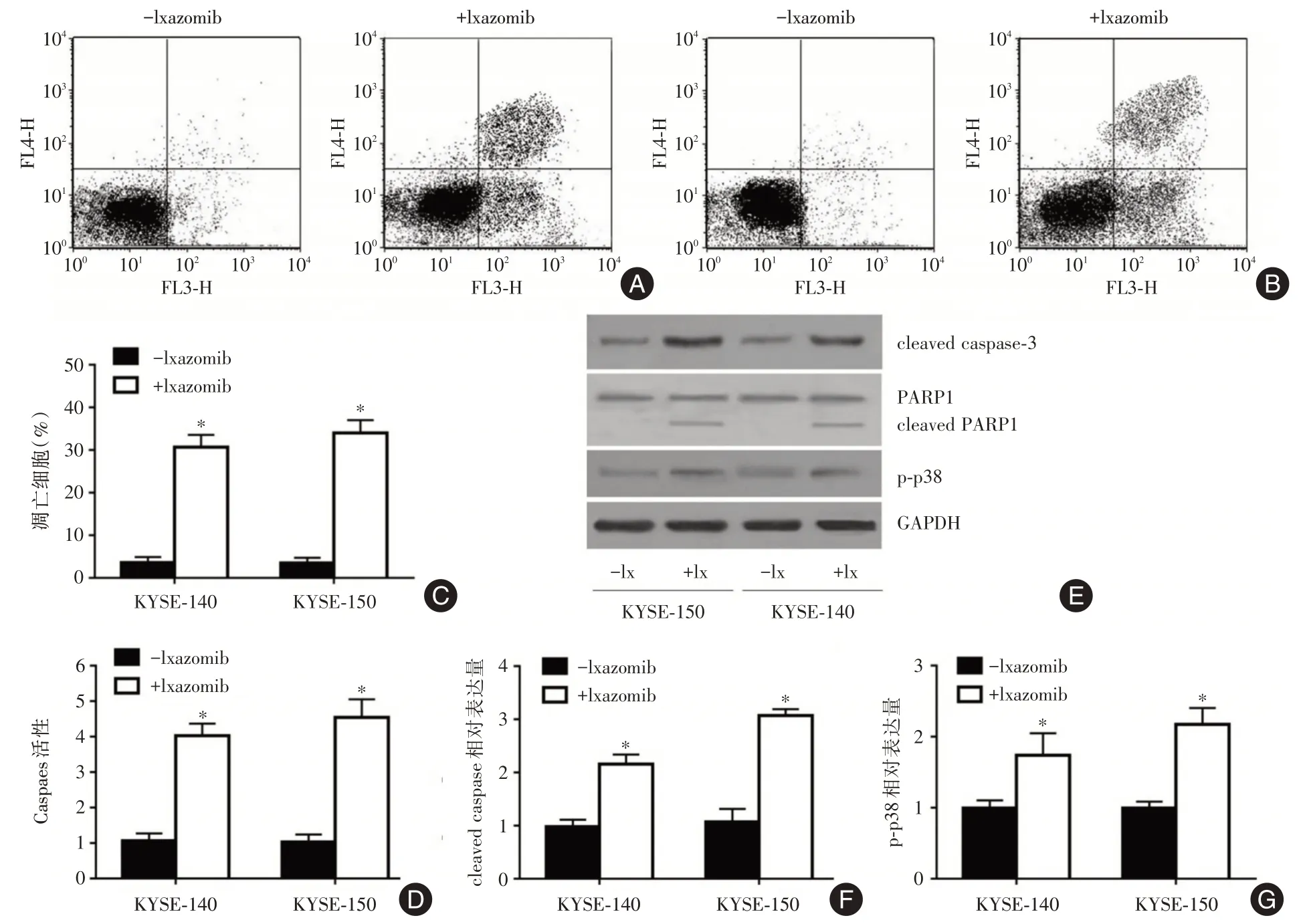
图3 依沙佐米对食管鳞癌细胞凋亡的影响Fig.3 Effect of Ixazomib on the apoptosis of esophageal squamous cell carcinoma cells

图4 mTOR 信号通路相关蛋白的Western blot 结果Fig.4 Western blot results of mTOR signaling pathway protein
表2 mTOR、p70S6K 和4E-BP1 的RT-qPCR 结果Tab.2 RT-qPCR results of mTOR,p70S6K and 4E-BP1 genes ±s
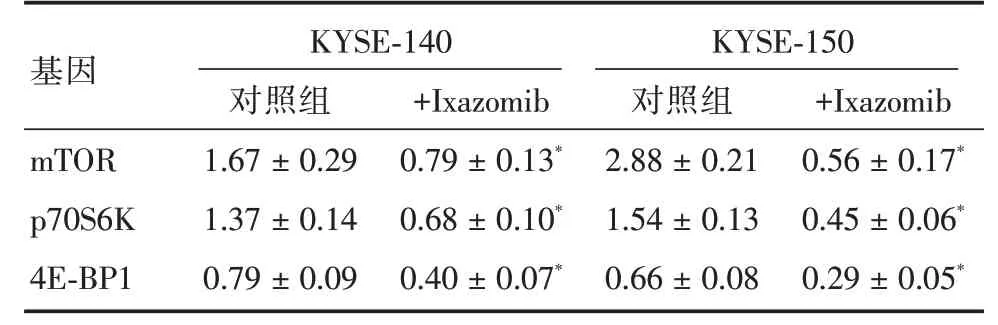
表2 mTOR、p70S6K 和4E-BP1 的RT-qPCR 结果Tab.2 RT-qPCR results of mTOR,p70S6K and 4E-BP1 genes ±s
注:与对照组相比*P <0.05
基因mTOR p70S6K 4E-BP1 KYSE-140对照组1.67±0.29 1.37±0.14 0.79±0.09+Ixazomib 0.79±0.13*0.68±0.10*0.40±0.07*KYSE-150对照组2.88±0.21 1.54±0.13 0.66±0.08+Ixazomib 0.56±0.17*0.45±0.06*0.29±0.05*
依沙佐米是第二代蛋白酶体抑制剂,相对于硼替佐米(PS-341)改善了药代动力学和药效学特征。多项研究表明依沙佐米不仅可用于血液系统恶性肿瘤的治疗[16-17],而且对多种类型的实体瘤的生长具有抑制作用[18-21]。有报道显示依沙佐米对人结肠腺癌Caco2 细胞具有抗增殖作用,可以下调NF-κB 和c-myc 的mRNA 表达,通过使线粒体的去极化和激活caspase-3 的活性诱导细胞凋亡[22]。体外结果表明依沙佐米对乳腺癌细胞具有抗肿瘤作用,可以诱导细胞的自噬和MKP-1 表达,促进JNK 和p38 的磷酸化,抑制IκBα的降解,增强细胞对阿霉素的敏感性[23]。体内研究也显示依沙佐米可以抑制肿瘤的生长,研究显示在成神经细胞瘤的小鼠移植瘤模型中,依沙佐米具有抗肿瘤的功效[24]。
本研究结果表明依沙佐米可以抑制食管鳞癌细胞KYSE-140 和KYSE-150 的增殖,并且存在剂量依赖性,低剂量的依沙佐米(10 nmol/L)即可对食管鳞癌细胞的生长产生抑制作用。依沙佐米通过增强caspase-3 活性,诱导PARP 发生裂解生成cleaved PARP,并促进凋亡激活标志物p-p38的表达来诱导食管鳞癌细胞的凋亡,说明依沙佐米可以抑制食管鳞癌细胞的增殖并诱导细胞的凋亡。
研究表明食管鳞癌细胞中mTOR/p70S6K 信号通路处于异常激活状态,mTOR 的高表达促使两个下游靶蛋白p70S6K 和4E-BP1 发生磷酸化,从而激活mTOR/p70S6K 信号通路[25-27]。对食管鳞癌临床组织标本的研究也表明mTOR 信号通路处于激活状态,其中磷酸肌醇-3 激酶、AKT、p-AKT、mTOR、p-mTOR、4E-BP1 等蛋白在肿瘤组织中显著上调,相反地磷酸酶和tensin 蛋白同源物的表达显著下调,特别是在pT3-T4 肿瘤中下调更为显著[15]。此外食管鳞癌组织中mTOR 信号通路蛋白的高表达和磷酸酶和tensin 蛋白同源物的低表达,与有无淋巴结转移和晚期TNM 分期存在相关性。mTOR靶蛋白和p70S6K1 的高表达与总体生存率相关,mTOR 信号通路的过表达被证明是食管鳞癌不良预后的独立危险因素[15]。本研究结果显示mTOR基因的mRNA 和蛋白表达水平均受到抑制,两个下游靶基因p70S6K 和4E-BP1 的mRNA 表达也受到了抑制。依沙佐米处理前和处理后p70S6K和4E-BP1蛋白的表达没有明显变化,但p-p70S6KThr421/Ser424 和p-4E-BP1Thr36 蛋白的表达显著下降,说明依沙佐米可能通过下调mTOR 的表达使下游靶点p70S6K 和4E-BP1 的磷酸化受到抑制,从而抑制食管鳞癌细胞中的mTOR/p70S6K 信号通路。
综上所述,依沙佐米可以抑制食管鳞癌细胞的增殖,并诱导细胞凋亡,可能通过抑制mTOR/p70S6K 信号通路参与细胞凋亡的调节,为开发蛋白酶体抑制剂作为食管鳞癌治疗药物提供依据。

