miRNA-330-3p/Ap2m1轴在过表达GATA-4骨髓间充质干细胞外泌体抗心肌细胞凋亡中的作用
贺继刚 王梓豪 李敏 谢巧丽 毛富刚
云南省第一人民医院,昆明理工大学附属医院1心脏大血管外科,2心血管内科(昆明650032)
冠状动脉硬化性心脏病(coronary arteriosclerotic heart disease,CAD)引起的心肌梗死(myocardial infarction,MI)已成为世界疾病谱中的头号“杀手”。目前对此危险因素的研究虽有一定进展,但仍无法对其进行有效的治疗[1-3]。至今,对冠心病引起的心梗治疗的中心为对心梗区域心肌细胞的保护,而目前生物治疗走在了前方。其中骨髓间充质干细胞(Bone marrow mesenchymal stem cells,BMSC)是生物治疗的主要手段[4-6]。GATA-4是调控心脏基因表达的重要转录因子,并可以抗心肌细胞凋亡[7-10]。外泌体(exosome)是由细胞分泌的脂质双层囊泡状物质,其内含有的miRNA 是其主要生物学功能分子,其可随exosome 远距离运输,并释放入“受体”细胞,而改变受体细胞生物学功能[11-15]。结合以上研究背景,课题组进一步发现过表达GATA-4 的BMSC 分泌的exosome(BMSCGATA-4-exosome)能够通过减少心肌细胞凋亡坏死,进而改善心梗后心功能。并证明在BMSCGATA-4-exosome 中miRNA-330-3p 表达明显增高,提示其是BMSCGATA-4-exosome抑制心肌细胞凋亡,改善心梗后心功能的关键分子[16]。前期在BMSC体系内过表达miRNA-330-3p并提取分泌的外泌体(BMSCmiRNA-330-3p-mimic-exosome)与心肌细胞在低氧无血清下共培养,其可以明显降低心肌细胞凋亡率。且miRNA-330-3p 在心肌细胞内高表达。进一步根据miRNA 靶基因数据库预测miRNA-330-3p 对应靶基因为Ap2m1、Cnot4,通过Western blot 证实Ap2m1 蛋白表达呈规律性降低,且与对照组比较差异有统计学意义(P<0.05)。本实验力图进一步通过建立小鼠心梗模型,采用尾静脉注射各组exosome,对miRNA-330-3p/Ap2m1轴在BMSCGATA-4-exosome 抗心肌细胞凋亡中的作用进行体内解析验证。exosome 取代干细胞促进心肌修复,不仅能实现无细胞修复,且降低了干细胞注入后对全身造成的影响,为exosome 成为心肌梗死治疗药物提供依据。
1 材料与方法
1.1 材料
1.1.1 实验动物37 只雄性C57BL/6 小鼠,购自成都达硕(SCXK(川)2015—030)。所有动物实验均已获得云南省第一人民医院动物实验伦理委员会批准(YS2018872)。
1.1.2 主要试剂和仪器miRNA-330-3p inhibitor试剂(广州锐博生物科技有限公司),miRNA-330-3p mimic 试剂(广州锐博生物科技有限公司),DMEM/F12 细胞培养基(Gibco 公司),提取exosome 试剂盒(广州锐博科技公司),Bulge-Loop miRNA qRTPCR Starter Kit(广州锐博科技公司),cel-miR-39 引物、miRNA-330-3p 引物(广州锐博科技公司),Ap2m1 一抗(上海市玉博科技公司),Cnot4 一抗(上海市玉博科技公司)。
1.2 实验方法
1.2.1 小鼠BMSC 分离、培养及鉴定小鼠胫骨全骨髓法提取骨髓间充质干细胞,采用酶消化法进行细胞传代培养,至干细胞到达第3 代(P3)时收集细胞采用CD11b 磁珠负选,去除造杂细胞。继续干细胞培养传至第7 代(P7)。待细胞汇合达90%时。完成骨髓间充质干细胞三系分化检测(三系分化按Cyagen Biosciences 公司分化试剂盒说明书操作)。
1.2.2 BMSCGATA-4通过采用基因开启技术及病毒载体进行构建在慢病毒质粒GV308中导入GATA-4 mRNA,构建重组慢病毒包装质粒。并转染入小鼠骨髓间充质干细胞中需要时加入基因开启剂强力霉素(Doxycycline,DOX)使GATA-4 基因表达。
1.2.3 细胞的分组及处理准备BMSC-exosome(5 μg/mL),BMSC空载体-exosome(5 μg/mL),BMSCGATA-4-exosome(5 μg/mL),BMSCmiRNA-330-3p-mimic-exosome(5 μg/mL),BMSCmiRNA-330-3p-inhibitor-exosome(5 μg/mL)经尾静脉注射入心梗小鼠体内,并将心梗未处理组、正常小鼠作为对照组(每组5 只)。
1.2.4 小鼠心肌梗死模型的建立采用水合氯醛(4%,0.1 mL/10 g)麻醉小鼠。直视下气管插管并连接呼吸机,左侧三肋间入胸,以9/0 缝线于左心耳根部下方。可见左心室前壁及心尖周围心肌组织运动减弱,关闭肋间隙。模型制作完成后,观察模型小鼠48 h,确保模型小鼠可以存活,用于后续实验[16]。本实验共应用小鼠37 只,存活36 只,由于心衰死亡1 只(死于模型制作48 h 以内)。小鼠心梗模型制作的成功率为95%。
1.2.5 心脏彩超将BMSC-exosome(5 μg/mL),BMSC空载体-exosome(5 μg/mL),BMSCGATA-4-exosome(5 μg/mL),BMSCmiRNA-330-3p-mimic-exosome(5 μg/mL),BMSCmiRNA-330-3p-inhibitor-exosome(5 μg/mL)在小鼠心梗模型建模后48 h时经尾静脉注射入体内,注射exosome的量为5 μg/mL,300 μL exosome,并将心梗未处理组、正常小鼠作为对照组(每组5 只)。于注射后48 h(前期已经证明在给予BMSCGATA-4-exosome后48 h 心梗心功能的改善开始出现[16])采用心脏彩超(PHILIPS EPIQ 7C)评估心功能改变。
1.2.6 RT-PCR取相同部位相同重量心肌组织,采用RT-PCR 方法检测下述各组BMSC-exosome组,BMSC空载体-exosome 组,BMSCGATA-4-exosome 组,BMSCmiRNA-330-3p-mimic-exosome 组、BMSCmiRNA-330-3p-inhibitor-exosome 组及心梗未处理组、正常小鼠,心肌细胞内miRNA-330-3p 表达的量。
提取各组总RNA,将miRNA-330-3p逆转录合成cDNA第一条链。在对目的基因进行扩增(95 ℃,10 min;95 ℃,2 s ;60 ℃,20 s;70 ℃,10 s),进行分析。
1.2.7 利用TUNEL技术评估心梗部位心肌细胞的凋亡数量小鼠心梗模型建立48 h后给予注射BMSCexosome组,BMSC空载体-exosome组,BMSCGATA-4-exosome组,BMSCmiRNA-330-3p-mimic-exosome 组、BMSCmiRNA-330-3p-inhibitorexosome 组的exosome,并将心梗未处理组及正常小鼠组作为对照组,评估心梗部位心肌细胞凋亡数量(每组五只小鼠,取相同部位心脏组织,× 40倍,计数心肌细胞凋亡数量)。
1.2.8 靶基因预测对miRNA-330-3p 利用十二个小分子RNA 靶基因预测Database 进行预测(条件:相同靶基因存在于≥10 个数据库同时靶基因和小分子RNA 匹配度≥8),提示Ap2m1、Cnot4 为miRNA-330-3p 靶基因。
1.2.9 Western blot用蛋白免疫印迹(Western blot)技术检测各组心肌细胞内Ap2m1、Cnot4 蛋白的表达。提取体内各组心梗部位心肌细胞的蛋白质,评估其细胞内Ap2m1、Cnot4 表达。
1.3 统计学方法采用SPSS 15.0 统计分析。数据采用单因素方差分析比较,统计假设检验为双侧,P<0.05 为差异具有统计学意义。
2 结果
2.1 小鼠BMSC 3 系分化结果见图1。
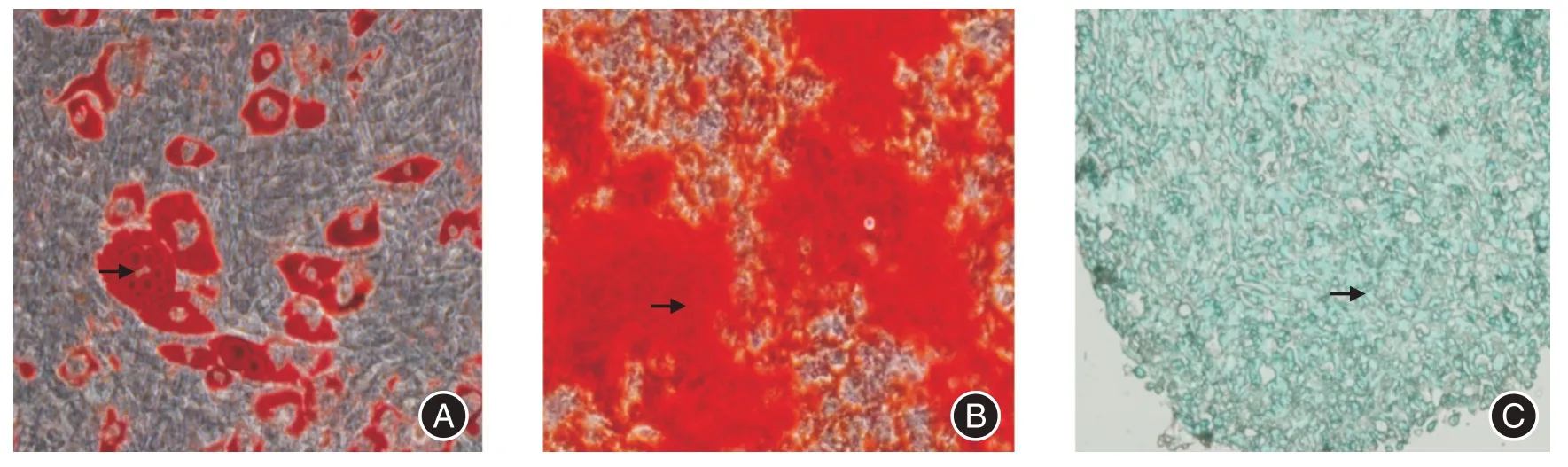
图1 骨髓间充质干细胞3 系分化图Fig.1 Mouse BMSC three-line differentiation
2.2 构建BMSCGATA-4 24 h 后采用RT-PCR 检测GATA-4的表达BMSCGATA-4组较对照组其GATA-4基因表达增加97.27 倍,较对照组明显增高(P<0.05)。见图2。

图2 慢病毒转染BMSC 后24 h GATA-4 的RT-PCRFig.2 RT-PCR of GATA-4 24 h after lentivirus transfection of BMSC
2.3 心功能改变采用心脏彩超(PHILIPS EPIQ 7C)评估心功能改变,每组共5 只小鼠,共3 次,见图3。

图3 心梗模型建立48 h 后给予exosome 48 h 处理后射血分数评价Fig.3 Ejection fraction was evaluated after 48 hours of exosome treatment after myocardial infarction model was established
2.4 miRNA-330-3p 的表达采用RT-PCR 定量评估各组心肌细胞中miRNA-330-3p 的表达,见图4。
2.5 利用TUNEL 技术评估心梗部位心肌细胞的凋亡数量小鼠心梗模型建立48 h 后给予注射BMSC-exosome 组、BMSC空载体-exosome 组,BMSCGATA-4-exosome 组、BMSCmiRNA-330-3p-mimic-exosome 组、BMSCmiRNA-330-3p-inhibitor-exosome 组的exosome,并将心梗未处理组及正常小鼠组作为对照组,每组5 只小鼠,取相同部位心脏组织,× 40 倍,计数心肌凋亡细胞,评估心梗部位心肌细胞凋亡数量(以一批为例展示),见图5。每组5 只小鼠,取相同部位心梗组织,高倍镜下观察各实验组及对照组心脏梗死区凋亡细胞量,见图6。
2.6 心梗心肌细胞Ap2m1、Cnot4 表达水平BMSCmiRNA-330-3p-mimic-exosome 组中心梗心肌细胞内Ap2m1的表达规律性降低,且与对照组差异有统计学意义(P<0.05)。但Cnot4 表达未见规律性。见图6、7。

图4 心梗模型建立48 h 给予干预措施48 h 后心梗组织中miR-330-3p 表达Fig.4 miRNA-330-3p expression in myocardial infarction tissues 48 hours after myocardial infarction model was established and intervention was administered
图5 各组心肌细胞凋亡数量(×40)Fig.5 Cardiomyocyte apoptosis each group(×40)
3 讨论
结合目前国内外研究结果,前期课题组发现BMSCGATA-4-exosome 能减少心肌细胞凋亡坏死,进而提高心梗后心功能[16]。同时可见在exosome 中miRNA-330-3p 表达增高,提示其可能是BMSCGATA-4-exosome 改善心梗后心功能的关键分子。
microRNAs(miRNAs)为小分子非编码RNA。成熟的miRNA 主要通过与靶基因的3′非翻译区(3′-UTR)结合而降解或抑制mRNA 的转录或翻译,从而调控细胞很多方面的功能,包括调控细胞周期、增殖、凋亡、分化和细胞应激[17]。在人类中,编码miRNAs 的基因只占基因的3%左右,但它们对大约30%的蛋白质的表达都具有调节作用[18]。许多研究表明miRNA 可以在多种肿瘤中异常表达,这些异常表达的miRNAs 可能通过调节多种抑癌基因或致癌基因调控肿瘤的发展[19]。而miR-330-3p 是在文献中经常被描述的一类miRNA[20-21]。
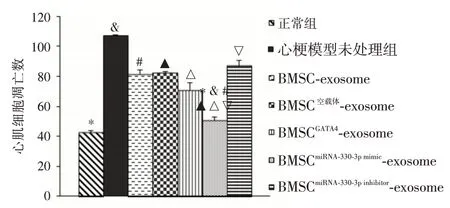
图6 心梗模型建立48 h 后给予干预措施处理后心梗局部细胞凋亡数量Fig.6 Myocardial infarction model is established after 48 hours and after the intervention measures to deal with the local number of apoptosis

图7 心梗心肌细胞在48 h Ap2m1 及Cnot4 表达水平Fig.7 The expression levels of Ap2m1 and Cnot4 in myocardial cells of myocardial infarction at 48 h

图8 心梗模型建立48 h 给予干预措施48 h 后心梗组织中Ap2m1、Cnot4 表达Fig.8 Ap2m1 and Cnot4 expression were observed in myocardial infarction 48 h after intervention
miR-330-3p 是WEBER 首次发现的,Has-miR-330位于人类染色体19q13.32[22]。miR-330-3p 是一种新发现的miRNA,其在乳腺癌[23]、食道癌[24]中表达上调。通过研究表明miR-330-3p 在以上肿瘤中可以抑制肿瘤细胞的凋亡,促进肿瘤细胞的增殖。在乳癌中如用miR-330-3p 转染乳腺癌细胞可减少G1 群体并促进了细胞存活[25]。在食管癌中,FACS研究表明,具有高miR-330-3p水平的食管上皮癌细胞具有较低比例的G0/G1 细胞。过表达和敲除实验显示,miR-330-3p水平与CDK 6和cyclinA水平呈正相关,与p21Waf1/Cip 1和p27Kip1水平呈负相关。CDK 6 和cyclinA 在DNA 合成前出现在G1 期,是S期进入和通过G2/M 期所必需的[26]。本实验通过建立小鼠心梗模型,发现BMSCmiRNA-330-3p-mimicexosome组心肌细胞凋亡明显减少,符合上述实验结果。进一步采用miRNA 靶基因预测数据库对miRNA-330-3p 的靶基因进行检测,提示Ap2m1、Cnot4 为miRNA-330-3p靶基因。笔者进一步研究发现Ap2m1表达具有明显的规律性,而Cnot4 规律性不明显。HELBIG 等[27]报道,AP2m1 变异是发育性和癫痫性脑病基础,Ap2m1 编码衔接蛋白复合物2(AP-2)的μ亚基参与网格蛋白介导的内吞作用(CME)和突触小泡回收。Ap2m1蛋白的变异缺失,导致了神经细胞的凋亡减少,异常增殖增加。此外据LE DUFF等[28]报道,细胞在诱导凋亡中AP2m1 的表达是上调的,与本研究结果一致。近几年国内外学者的研究侧重放在BMSC、GATA-4 以及exosome 修复受损心肌三者独立发挥的作用,而关于BMSCGATA-4-exosome 通过miRNA-330-3p/Ap2m1 轴抑制心肌细胞凋亡从而修复心肌损伤的分子调控网络研究尚无报道。本研究前期实验结果作为立项依据,将首次明确BMSCGATA-4-exosome 在心肌损伤修复中的分子调控网络。但据MIKULA 等[29]报道:通过对内质小体内化过程进行干扰,可致EGFR 数量增加,在抗凋亡过程中EGFR/ERK 途径被激活。课题组将在后续实验中检测EGFR的表达。并进一步设立多个研究时间点,探讨miRNA-330-3p/Ap2m1 轴的时量变化。
综上所述,miRNA-330-3p/Ap2m1轴是BMSCGATA-4-exosome 抗心肌细胞凋亡坏死的关键分子轴。

